雄性二倍体毛白杨再生体系的构建和遗传转化的研究
2022-11-29俞子承陈赢男李淑娴尹佟明李小平
俞子承,凌 聪,陈赢男,李淑娴,尹佟明,李小平
(南京林业大学林学院,南方现代林业协同创新中心,江苏 南京 210037)
毛白杨(Populustomentosa)原产于中国,具有生长快速、轮作周期短、材质优良、环境适应性强等特点,不仅是常见的速生用材和造林树种,也广泛应用于庭园和道路绿化,同时还是理论研究和遗传改良的理想材料[1-2]。自然条件下毛白杨为野生三倍体,通常伴随雄蕊异常、花药萎缩、花粉败育消失等育性现象,制约了杂交育种的开展。此外,三倍体植株拥有额外一组染色体,增加了遗传背景的复杂度,给基因功能的解析、测序片段的拼接和基因编辑位点的选择带来困扰,阻碍了组学测序及基因编辑等新技术的应用。因此,为了进一步开展毛白杨速生生长、性别发育相关等功能基因的研究,选用二倍体优良植株进行遗传转化体系的构建显得尤为重要。南京林业大学林木遗传育种重点实验室杨树课题组早先对我国南方毛白杨自然种质资源进行了收集,并利用流式细胞仪对其染色体倍性进行测定,发现多株长势良好的二倍体雄株,给毛白杨基因功能的研究带来了契机。
近年来,基因工程技术因其目的性强、可靠性高、育种周期短等优势,在世代周期长、遗传背景复杂的木本植物中广泛应用[3]。毛白杨的遗传转化主要选用农杆菌介导的叶盘法,植物材料、菌株类型、质粒载体等诸多因素协同影响整个进程[4]。现有的遗传转化研究大多选用三倍体植株为试验材料,其余所用材料也是倍性不明,鲜有二倍体材料的研究报道。此外,基于不同毛白杨植物材料构建优化的遗传转化体系各不相同,菌液浓度、侵染时间以及共培养时间等关键试验条件相差较大。龙萃等[5]对转化体系优化后发现,侵染液在600 nm波长的吸光值为0.3~0.5时,对应的转化率为9.38%;而Du等[6]和Jia等[7]则选用了600 nm波长时吸光值为0.8的侵染液,作为最优侵染条件。因此,针对选用的植物材料进行试验条件的筛选显得十分重要[8-9]。
现阶段,缺乏稳定的再生体系是毛白杨遗传转化的主要障碍[9-11]。从外源基因整合受体基因组,到脱分化形成完整独立再生植株,组织培养再生体系贯穿了整个遗传转化试验流程[12]。再生体系的发展离不开植物激素的分离和使用,外源激素有效促进了生长发育,提高了繁殖效率,缩短了再生周期[13]。杨属植物组织培养技术比较成熟,主要选用6-苄氨基嘌呤(6-BA)和萘乙酸(NAA)等作为外源激素,近年来有学者在再生体系中添加苯基噻二唑基脲(TDZ),有效提高了植株的繁殖系数[14-17]。本研究选用优良单株雄性二倍体毛白杨为材料,对组织培养的激素组合及农杆菌介导遗传转化的主要试验条件进行筛选,建立并优化二倍体毛白杨再生体系和遗传转化体系,以期为其他木本植物遗传转化研究提供参考,并为后期分子辅助育种奠定基础。
1 材料与方法
1.1 试验材料
试验材料采集于江苏省南京市玄武湖公园,选取优良基因型雄性二倍体毛白杨幼嫩含芽的茎段与枝条作为外植体。通过再生体系培育扩繁,获得无性系。选择优质组培苗移栽并存放于南京林业大学林木遗传育种系温室。
1.2 试验方法
1.2.1 雄性二倍体毛白杨确定
采用流式细胞仪对选取的雄性二倍体毛白杨样品单细胞的DNA大小进行检测,通过与标准品番茄样品的比较,确定选取植株的倍性。
1.2.2 雄性二倍体毛白杨外植体消毒
采集枝条上包含嫩芽的茎段,清除表面灰尘,流水冲洗1~2 h。使用70%(体积分数)乙醇与10%(质量分数)次氯酸钠溶液分别对毛白杨茎段消毒,消毒时间各设置3个水平(70%乙醇消毒20、30和40 s;次氯酸钠消毒5、10和15 min),共9个处理。消毒期间用无菌水多次冲洗,最后接种于相应培养基。每个处理接种50个茎段。7 d后统计染菌率、褐化率以及死亡率。
1.2.3 雄性二倍体毛白杨各阶段培养基筛选
基本培养基筛选:分别配置1/4 MS、1/2 MS、MS培养基与WPM培养基,每种培养基中分别接种30个外植体顶芽。分别于10 d与20 d时统计不同培养基中顶芽的生长情况。
生根培养基筛选:在外植体培养中选择生长阶段相近的顶芽,去除多余叶片后插入基本培养基中,同时添加不同浓度的激素NAA与IBA。两种外源激素各设置3个水平(0.3、0.5和0.7 mg/L),共9个处理。每个生长瓶中接种1个顶芽,每个处理10瓶,20 d后观察生根情况。
继代培养基筛选:选取生长旺盛的无菌苗叶片进行增殖继代培养。3种外源激素各设置3个水平(6-BA设置0.3、0.5和0.7 mg/L;NAA设置0.3、0.5和0.7 mg/L;TDZ设置0.005、0.010和0.015 mg/L),按照3因素3水平正交表设计试验。叶片均匀切成1 cm×1 cm大小的叶盘,放置于不同激素处理的培养基中,每个处理各接种30片叶盘,每14 d更换培养基,统计增殖系数。
芽伸长培养基筛选:选择继代培养基中生长状态相似的不定芽进行试验。两种外源激素各设置3个水平(6-BA为0.1、0.3和0.5 mg/L;NAA为0.1、0.3和0.5 mg/L),共9个处理。每个处理接种30个不定芽,每20 d更换培养基,清除死亡或褐化的材料,于40 d后统计不定芽生长长度。
1.2.4 二倍体毛白杨转化体系的构建
采用叶盘转化法,选择含有GUS报告基因的植物表达载体pBI121和根癌农杆菌菌株EHA105进行试验。植物材料为生长45~60 d的二倍体毛白杨无性系组培苗。试验过程中对影响毛白杨转化效率的因素进行筛选。
预培养时间筛选:将叶盘接种于不含外源激素的愈伤分化培养基中,分别在无光环境中培养不同时间。预培养时间设置为0、12、24和48 h(0 h为对照组)。每个处理接种100个叶盘,观察不同处理下叶盘的分化情况,统计产生抗性芽的叶盘数。
侵染液浓度与侵染时间筛选:选择不同的侵染液浓度和侵染时间进行试验。菌液在600 nm波长的吸光值梯度设定为0.2、0.4、0.6和0.8;侵染时间为10、20和30 min。每个处理接种50个叶盘,观察分化情况,统计产生抗性芽的叶盘数。
共培养时间筛选:叶盘完成侵染后,擦干表面多余菌液,转移至最优分化培养基中,于黑暗环境中共培养不同时间。共培养时间梯度设定为:8、16、24、32、40、48和56 h。每个处理接种50个叶盘,统计产生抗性芽的叶盘数。
卡那霉素浓度筛选:将叶盘接种在含有不同卡那霉素的最优分化培养基上,添加Hyg 10 mg/L + Cef 200 mg/L +Tim 200 mg/L作为抑菌抗生素,卡那霉素的质量浓度梯度设置为0、10、20、30、40和50 mg/L。每个处理接种30个叶盘,20 d后观察叶盘生长状况。
阳性植株的鉴定:分别摘取抗性植株和对照植株的叶片放入配置好的GUS染液进行快速检测,观察叶片变色情况。提取抗性植株叶片DNA,根据质粒载体pBI121序列设计引物进行PCR验证,观察是否存在对应条带。
引物使用Primier 6软件设计,交由南京金斯瑞公司合成。上游引物序列为TTTCCTTGATCTGCTGCTTCG,下游引物序列为ATTTCCGCGCAGACGATGACG,目的片段大小为2 058 bp。
1.2.5 二倍体毛白杨瞬时表达体系构建
选用生长4~6周的二倍体毛白杨,取10片叶子切成叶条,避光酶解3~5 h,镜检确认原生质体成功分离后,去除杂质,过滤重悬,获得毛白杨原生质体溶液。随后将含有EGFP(enhanced green fluorescent protein)基因的p2GWF7质粒与制备的毛白杨原生质体溶液混匀,室温孵育15 h,检测荧光蛋白(EGFP)的瞬时表达情况。
1.3 数据处理
使用IBM SPSS Statistics(Version 20)中的单因素ANOVA模型、一般线性模型等工具对组培苗测定数据进行方差分析和差异显著性分析。
2 结果与分析
2.1 雄性毛白杨外植体材料的倍性测定结果
通过流式细胞技术(flow cytometry, FCM)对毛白杨样品单细胞的DNA大小进行检测结果见图1。二倍体供试番茄与二倍体毛白杨基因组大小分别为900 Mb与480 Mb[18-19],比值为1.875。标准品番茄与待测毛白杨样品比值约为1.818,与基因组大小比值相近,表明供试雄性毛白杨样品为二倍体。
2.2 二倍体毛白杨再生体系构建与优化
基于前期研究,本试验选用70%(体积分数)乙醇与10%(质量分数)次氯酸钠作为消毒剂进行外植体消毒。筛选结果显示,不同消毒处理的植株死亡率差异很大,随着消毒时间的延长,毛白杨外植体死亡率上升明显。综合9个消毒方案的统计结果,处理4(70%乙醇30 s,次氯酸钠5 min)的外植体污染数最少,褐化率与死亡率相对较低,为最优方案(表1)。基本培养基筛选结果显示,1/2 MS培养基中外植体的生长速度最快,WPM培养基与MS培养基生长状况相似,1/4 MS培养基生长速度最慢(表2)。因此选择1/2 MS作为基本培养基,进行再生体系的构建。
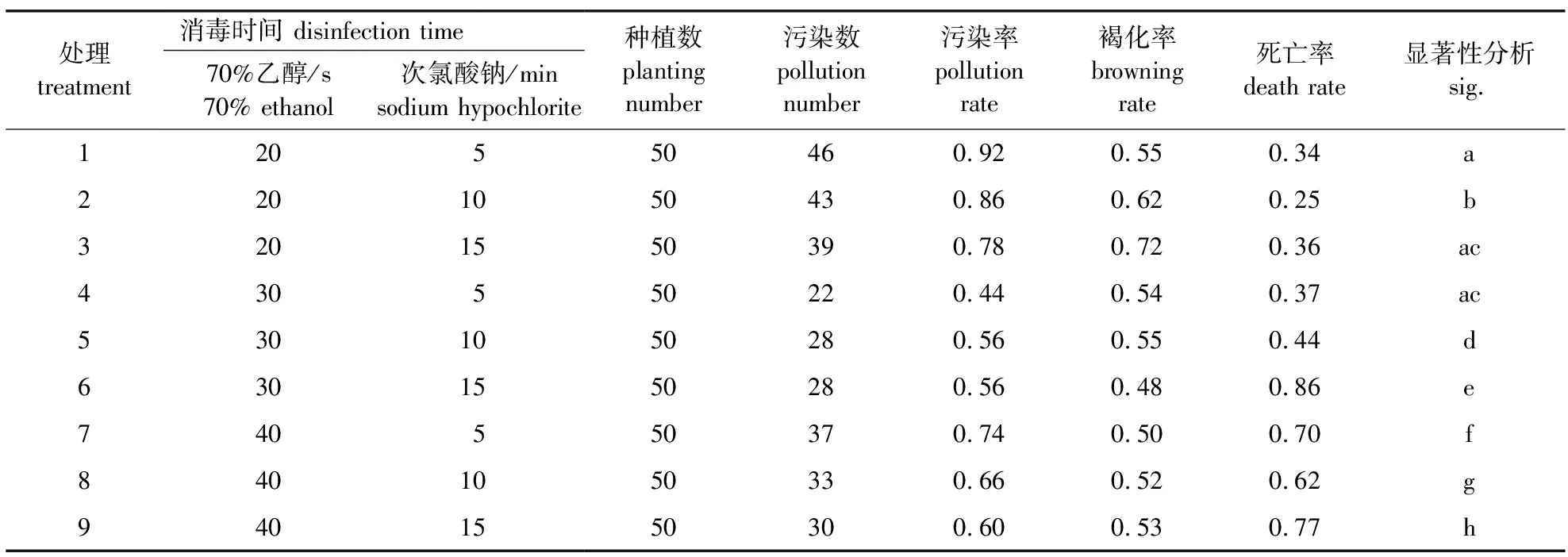
表1 外植体消毒筛选试验结果

表2 基本培养基筛选试验结果
将生长相近的外植体顶芽转入不同激素组合的基本培养基,统计其生根率作为生根培养基筛选的依据。在所有的9个组合中,处理2(NAA 0.3 mg/L,IBA 0.5 mg/L)的毛白杨生根情况最好,平均生根率达到了96.7%(表3),且植株根系粗壮,并伴生大量侧根,为最优激素组合(图2)。值得注意的是,随着激素浓度的升高,植株生根率逐渐下降。在处理8与处理9中,NAA质量浓度达到0.7 mg/L时,毛白杨的生根率大幅下降,出现植株死亡的现象。二倍体雄性毛白杨植株再生过程见图3。
将均匀处理后的叶盘放置于不同激素处理的培养基中,统计产生的不定芽,计算增殖系数,作为评价各个继代培养方案的标准。结果显示,增殖系数平均值最高的是处理5(6-BA的0.5 mg/L,NAA的0.5 mg/L,TDZ的0.005 mg/L),其平均增殖系数达到6.63;其次是处理4的4.47,处理8的4.10以及处理9的4.03(表4)。增殖继代过程中,不适宜的激素组合会促使叶盘出现褐化死亡的现象。对9个处理增殖系数的多重对比分析指出,处理5与其他处理间存在显著性差异,因此毛白杨最佳增殖继代培养基为:1/2 MS + 0.5 mg/L 6-BA + 0.5 mg/L NAA + 0.005 mg/L TDZ。

表4 激素配比对增殖继代培养的影响
芽伸长培养是建立再生体系的必要步骤。叶盘增殖出的不定芽需要转入对应的芽伸长培养基中,待新生芽逐步伸长且茎基粗壮后,再转入生根培养基,以保证植株的生根率和成活率。研究表明,TDZ能够促进不定芽基部产生大量愈伤组织,但是高浓度的TDZ又会阻碍不定芽的生长,出现玻璃化现象[20-21]。所以本研究在对芽伸长培养基进行筛选时,仅保留6-BA与NAA两种激素,同时尽可能降低筛选所用的浓度。以培养30 d后不定芽平均生长长度为标准,其中处理8(6-BA 0.5 mg/L,NAA 0.3 mg/L)达到了26.3 mm,为最优组合(表5)。此外,6-BA与NAA均对芽的生长有促进作用。芽伸长培养基对NAA的依赖性相对较低,不定芽伸长的速度受NAA影响不大。
2.3 二倍体毛白杨转化体系的构建与优化
本研究采用叶盘转化法,选择含有GUS报告基因的植物表达载体pBI121和根癌农杆菌菌株EHA105进行试验。借助试验过程,对二倍体毛白杨转化体系进行探索与优化。
预培养在植物遗传转化过程中起调节植物细胞状态的作用,能够加快叶片伤口处细胞增殖分化,促使叶片在侵染过程中与外源DNA接触,进而提高转化效率。在预设的4组对照试验中,毛白杨叶片在预培养12 h的情况下,获得的含抗性芽叶盘比例最高,达到9%。当预培养时间达到24 h时,其分化能力大幅度下降。而预培养时间达48 h时,毛白杨叶盘失去形成不定芽的能力,抗性芽获得率为0。与对照组相比,12 h的预培养能小幅提高毛白杨的转化效率,但不宜超过12 h(表6)。
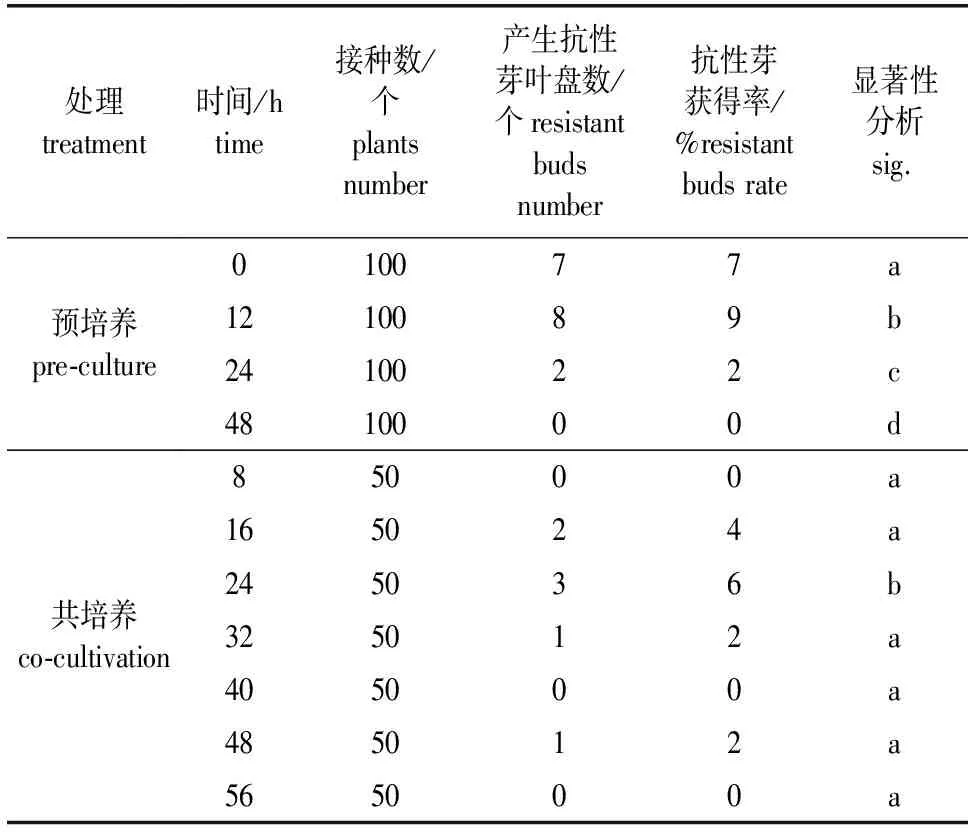
表6 预培养和共培养时间对毛白杨产生抗性芽的影响
在转化过程中,侵染菌液浓度和侵染时间是影响转化成功率的关键因素。侵染能力过强,容易导致菌液对叶盘造成不可逆伤害,导致受侵染植株大量死亡;而侵染不足,又会影响植物转化效率,无法获得抗性植株。合适的侵染液浓度和侵染时间在既可以保证高转化率、又能减少农杆菌对植物体的损害方面显得尤为重要。试验结果显示,毛白杨对菌液浓度以及侵染时间的变化非常敏感。当菌液浓度[以600 nm波长吸光值(OD600)表示,下同]高于0.6时,叶片受侵害严重,无法正常生长;在菌液浓度低于0.2时,农杆菌与叶片伤口接触减少,转化效率低,难以产生抗性芽。同样,侵染时间对抗性芽的获得率也有着一定影响。当菌液浓度小于0.4时,抗性芽叶盘的获得率与侵染时间呈现正相关。当菌液浓度达到0.4时,随着侵染时间的增长,抗性芽的获得率先上升后下降。综上所述,菌液浓度0.4,侵染20 min,为二倍体雄性毛白杨转化效率最高的组合(表7)。
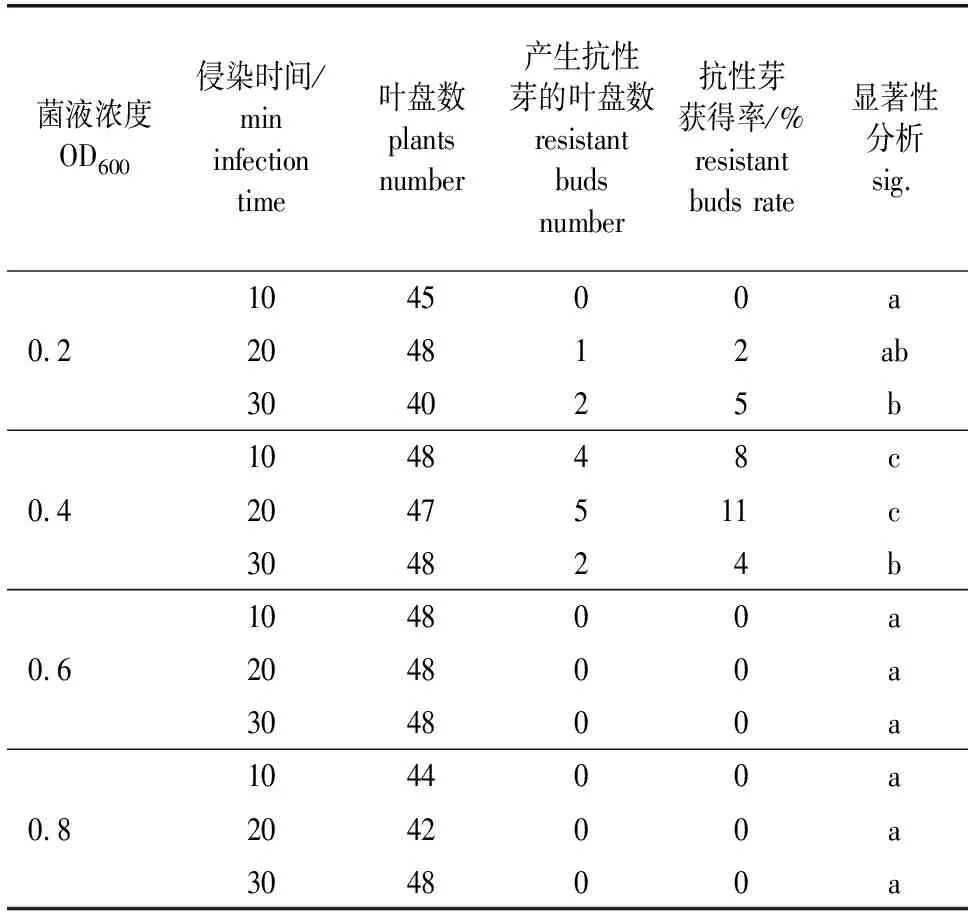
表7 侵染菌液浓度、侵染时间对毛白杨抗性芽的影响
避光条件下的共培养,可以促进植物细胞脱分化产生愈伤组织,同时诱导农杆菌携带的外源DNA整合到植物染色体上。试验结果显示,共培养时间为8 h时,农杆菌中的外源DNA未完成转移与整合,无法获得抗性芽。共培养时间为16~24 h时,叶盘产生抗性芽,在时间为24 h时,抗性芽比例达到最高。其后,随着共培养时间的继续增加,叶盘生长受到农杆菌抑制,抗性芽比例下降。当共培养时间超过40 h,大量叶盘染菌死亡。综上,筛选出的最佳共培养时间为24 h(表6)。
本研究通过遗传转化试验,共获得86株抗性植株(图4),并通过GUS染色和PCR的方法进行分子鉴定,获得14株阳性结果(图5)。
卡那霉素(kanamycin, Kan)通过干扰植物细胞叶绿体及线粒体蛋白质的合成,抑制植物细胞组织的生长发育,最终使植物细胞黄化死亡[22]。梯度试验结果表明,随着卡那霉素浓度的上升,毛白杨叶盘的分化能力逐渐降低,生长速度逐渐下降。在卡那霉素质量浓度达到30 mg/L时,叶盘无法产生不定芽;在抗生素质量浓度大于40 mg/L,叶盘无法生长,且短时间内完全死亡(图6)。
2.4 二倍体毛白杨瞬时表达体系
借鉴现有的原生质体分离方法[23],选择生长时间在4~6周的毛白杨,切成叶条后酶解3~5 h,溶解细胞壁,直至酶解液呈现绿色,原生质体完全释放。镜检图片显示,制备的原生质体呈现游离状态,数量平均达到了1×106个/mL,且获得的原生质体大小一致,状态良好,可以进行后续瞬时表达试验。
本研究将分离出的毛白杨原生质体与p2GWF7质粒混匀,在室温下孵育15 h后检测报告基因的瞬时表达情况。在Zeiss LSM 710激光共聚焦显微镜下,视野中出现同时包含EGFP绿色荧光信号以及红色叶绿体自发荧光的毛白杨原生质体。表明携带EGFP报告基因的质粒成功转入毛白杨的原生质体,并在原生质体中稳定表达(图7)
3 讨 论
参考大多数木本植物的消毒策略,本试验选用对植株伤害较小的酒精和次氯酸钠作为毛白杨外植体消毒剂,用以替代传统消毒剂氯化汞。外植体的消毒效果主要受到消毒剂和消毒时间的影响[24]。本研究不同消毒条件试验组的外植体染菌率差距明显,最低为44%,最高达92%。研究发现,酒精消毒时间不宜超过30 min,否则外植体死亡率明显上升;次氯酸钠最佳消毒时间为10 min,此时植株染菌率和致死率均相对较低。毛白杨嫩芽对消毒剂的敏感性较强,消毒剂极易造成外植体受损,导致死亡。此外,消毒过程中外植体植株出现较为严重的褐化,而褐化主要是由伤口破损处渗出的酚类物质与培养基中蛋白质聚合产生[25]。后续试验中,在培养基中添加适量硝酸银和活性炭,褐化情况得到明显缓解。值得注意的是,外植体材料自身携带的内生真菌难以通过表面消毒的方式去除,导致部分批次外植体植株出现染菌情况。本试验通过使用含有抗生素的无菌水浸泡冲洗和控制外植体采集时间的方法,有效降低了内生真菌的影响[26]。
基于前期的筛选工作,本试验选择IBA、NAA、6-BA、TDZ 4种外源激素进行二倍体毛白杨再生体系的构建。在生根阶段,外源激素的浓度对毛白杨植株生根率影响很大,最适激素条件下,生根率高达96.7%;随着激素浓度的上升,植株生根率骤降。值得关注的是,IBA和NAA两种激素对于二倍体毛白杨的生根均非常重要,仅保留1种激素进行的对照试验中,植株生根缓慢甚至无法生根。在不定芽增殖阶段,适宜的激素配比使毛白杨增殖系数达到6.63,与李慧等[27]获得的增殖系数相近(6.28),略低于鲁好君[16]的研究结果(7.98)。在芽伸长阶段,植株对6-BA激素的浓度变化较为敏感,对NAA依赖性相对不高。借助构建优化的再生体系,毛白杨外植体顶芽仅需要70 d即可快速生长成为完整健壮的植株,大大缩短了无性系培育扩繁的时间。在后续遗传转化阶段,本研究构建优化的再生体系同样表现出较高的增殖效率。
与其他毛白杨材料的研究结果不同,本研究发现预培养并不能显著提高雄性二倍体毛白杨的转化效率,预培养超过12 h,叶盘的分化能力明显降低,与李春利[15]的筛选结果相似。在转化阶段,侵染菌液浓度和侵染的时间是影响转化效率的关键因素[8]。现有研究中,毛白杨转化体系的侵染条件和获得的转化效率差异较大。在本研究中,菌液浓度(OD600条件)下为0.4,侵染20 min时雄性二倍体毛白杨转化效率最高,含有抗性芽叶盘的获取比例为11%。通过在侵染过程中控制农杆菌和叶盘的接触,能够有效减少农杆菌爆发,同时降低频繁洗菌对叶盘的伤害。毛白杨抗性筛选阶段通常使用30~50 mg/L的工作浓度进行一次或者梯度抗性筛选[6-7,15,28-29]。基于抗生素梯度筛选试验的结果,本研究选择30 mg/L的抗生素进行一次抗性筛选,未成功转化的叶盘迅速白化死亡。分子鉴定结果表明,获得的86株抗性植株中有14株分子检测为阳性,占比16.3%。假阳性比例偏高的现象在植物转基因试验中普遍存在。由于嵌合体芽的存在,一些植株没有受到抗生素的影响,得以正常生长,是形成假阳性植株的因素之一。此外,较短的共培养时间和偏低的抗生素筛选浓度也会造成假阳性植株比例的偏高[16]。雄性二倍体毛白杨遗传转化较为困难,本试验中酌情下调了抗生素的工作浓度,以期减少植株承受的筛选压力。获得的所有抗性植株都会通过分子检测的方法进行筛选验证,排除假阳性的干扰,保证结果的可靠性。后续可通过提高抗生素工作浓度或选用其他高效抗生素进行筛选,以达到更高的区分效率。
现阶段毛白杨研究大多选择拟南芥、烟草等异源原生质体作为材料进行瞬时表达,鲜有转化至叶肉细胞原生质体的报道。本研究基于现有的杨属植物原生质体分离方法,制备了雄性二倍体毛白杨原生质体,数量平均达到了1×106个/mL,略低于Tan等[30]以毛果杨为材料制备的叶肉细胞原生质体数量。研究验证了在雄性二倍体毛白杨原生质体同源转化的可行性,并成功表达了报告蛋白,为后续基因功能的鉴定与研究提供了重要实验平台。
与现有的三倍体毛白杨体系相比,本研究在保证再生效率的前提下,有效缩短了无性系培育的时间,并在此基础上成功进行了遗传转化和原生质体瞬时表达。相较于三倍体植株,二倍体植物材料只有两套染色单体,在测序数据组装和基因编辑靶点选择等方面更具优势,有着广阔的应用前景和科研价值。杨树是木本植物基础研究和遗传改良的模式植物,雄性二倍体毛白杨再生体系和遗传转化平台的构建,补充了毛白杨基础理论研究资料,为分子辅助品种选育奠定了基础,也为其他木本植物遗传转化研究提供了参考。
