基于分子对接法的硝基PAHs与α-淀粉酶的相互作用
2022-11-28张静蔡心如刘巧畅何毅聪
张静,蔡心如,刘巧畅,何毅聪
(1.河口生态安全与环境健康福建省高校重点实验室,福建 漳州 363105;2.厦门大学 嘉庚学院,福建 漳州 363105;3.煤炭科学技术研究院有限公司,北京 100013;4.煤炭资源高效开采与洁净利用国家重点实验室,北京 100013)
多环芳烃(polycyclic aromatic hydrocarbons, PAHs)是一类环境中广泛存在的典型持久性有机污染物,具有三致效应.硝基多环芳烃(nitrated polycyclic aromatic hydrocarbons, NPAHs)是一类硝基取代的PAHs衍生物,主要来源于有机物的不完全燃烧或由母体PAHs与硝酸根或羟基自由基等发生氧化加成反应生成[1-2].由于其独特的物化性质,NPAHs在多种环境介质中广泛存在,并可经呼吸、饮食和皮肤接触进入人体,引发人体健康问题.NPAHs的致癌性和致突变性已多有研究.尽管NPAHs在自然界中的含量通常比其母体PAHs低1~2个数量级,但其致突变性和致癌性远超母体PAHs,一些NPAHs的致癌性可达其母体PAHs的10倍,致突变性甚至可达其105倍[3-4].此外,近年来研究报道PAHs暴露与人体代谢性疾病(如Ⅱ型糖尿病)发病风险增加明显相关[5-7],而N-PAHs暴露是否会对血糖调节或脂质、碳水化合物代谢等与代谢失调疾病相关的重要生化过程产生影响,目前还知之甚少.
目前,糖尿病是世界范围内严重危害人体健康的第三大疾病[8].α-淀粉酶作为人体内重要的蛋白酶,直接参与淀粉和糖原的代谢,调节人体的糖代谢及平衡.α-淀粉酶活性改变会影响人体血糖水平,而血糖水平失衡与糖尿病、消化不良等多种饮食相关的慢性疾病有关,提高α-淀粉酶活性能够减缓一些消化不良、频繁腹泻等消化道疾病,而抑制糖尿病患者体内α-淀粉酶活性则能够有效控制糖尿病的发展[9].因此研究NPAHs与α-淀粉酶的相互作用及其对α-淀粉酶活性的影响有助于了解NPAHs对生物体内糖代谢的潜在影响.分子对接作为一项重要的实验辅助技术,它基于主客体分子结构的几何互补和能量匹配的原则,在小分子与生物大分子的相互作用研究中发挥着重要作用,可快速、简便获得小分子在大分子中的结合位点、结合强度、作用信息等,预测复合物的结合亲和力等[10-11].因此,本文选取典型PAHs芘(pyrene,PYR)及5种NPYRs——1-硝基芘(1-nitropyrene,1-NPYR)、2-硝基芘(2-nitropyrene,2-NPYR)、1,3-二硝基芘(1,3-dinitropyrene,1,3-DNPYR)、1,6-二硝基芘(1,6-dinitropyrene,1,6-DNPYR)、1,8-二硝基芘(1,8-dinitropyrene,1,8-DNPYR),利用分子对接技术探究取代基位置及数量不同的NPAHs与α-淀粉酶的相互作用信息,从分子层面快速、简便、可视化地了解其相互作用机制和差异,为了解NPAHs对人体糖代谢平衡的潜在影响提供数据支持.
1 实验部分
1.1 配体分子的准备
在PubChem网站下载6种小分子的三维结构的sdf文件,利用OpenBabelGUI软件将其转换为pdb格式.6种小分子结构如图1所示.导入AutoDockTools-1.5.6(ADT)软件处理小分子,在添加电荷、合并非极性氢、添加原子类型后,保存为pdbqt文件.

图1 PYR及5种NPYRs的分子结构
1.2 受体大分子处理
α-淀粉酶的晶体结构(PDB ID:3BAJ)由 RCSB蛋白质数据库(http://www.rcsb.org/)获得,其结合特异性配体阿卡波糖(acarbose)的活性口袋以网格状(mesh)显示,如图2所示.
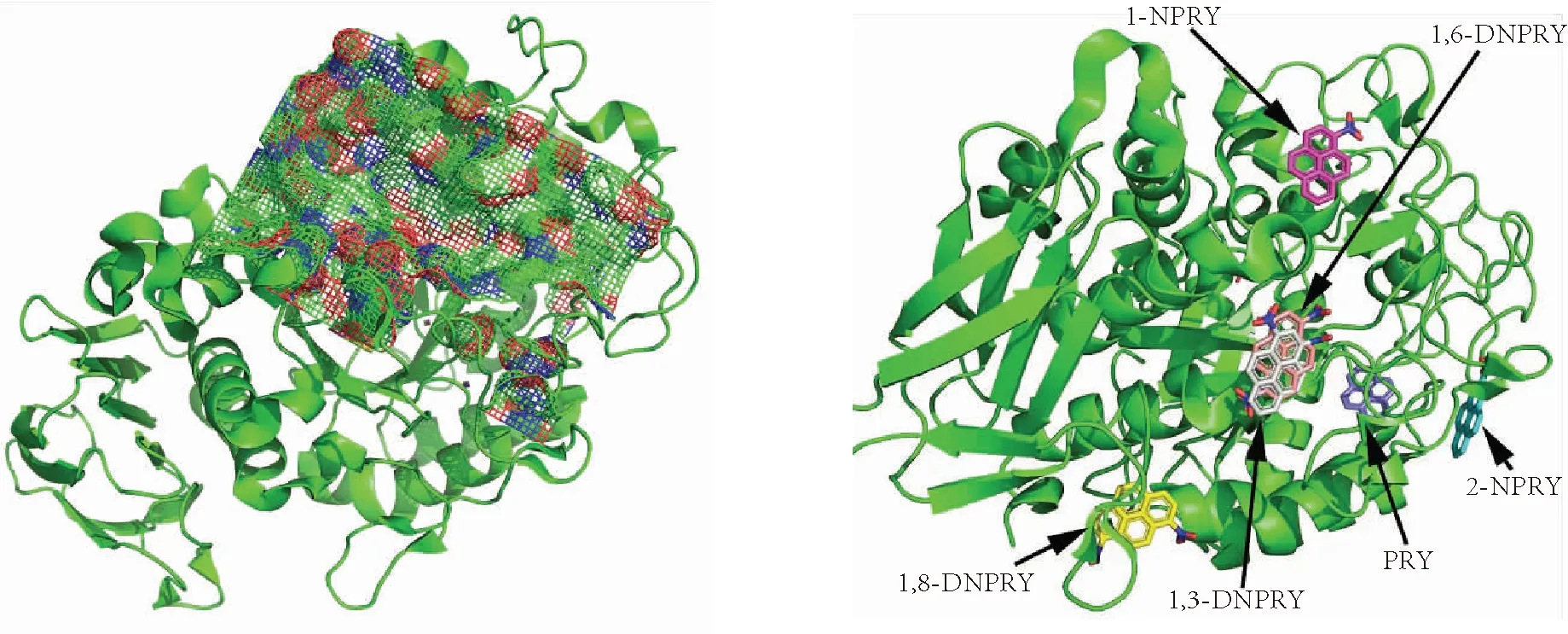
图2 α-淀粉酶大分子的结构 图3 PYR和5种NPYRs在α-淀粉酶分子内的结合位点信息
运行 ADT软件,对α-淀粉酶大分子作去水、加氢、添加电荷、添加原子类型等预处理,保存为pdbqt文件.
1.3 分子对接过程
利用 Autodock4.2.6软件,采用Blind docking 方法预测配体分子在α-淀粉酶内的最佳结合位点[12].经Autogrid设置以酶的中心的网格参数,其中网格大小12.6 nm×12.6 nm×12.6 nm,格点间距0.037 5 nm;通过Lamarckian Genetic Algorithm算法运行对接过程.参数:the number of GA runs=10,the population size=150,the maximum number of evals=250 000.选取结合自由能最低的复合物构象为最优构象,利用PyMOL软件和Protein-Ligand Interaction Profiler(PLIP)website[13]进行可视化分析.
2 结果与讨论
2.1 结合位点
为探究PYR及5种NPYRs与α-淀粉酶的结合机制及差异,选取6种小分子与α-淀粉酶的最优复合物构象,利用PyMOL软件可视化分析(图3).由图中可见,6种小分子在α-淀粉酶中的结合位点和分子朝向存在明显差异,其中1,3-DNPYR和1,6-DNPYR的结合位点较为接近.
2.2 结合能和抑制常数
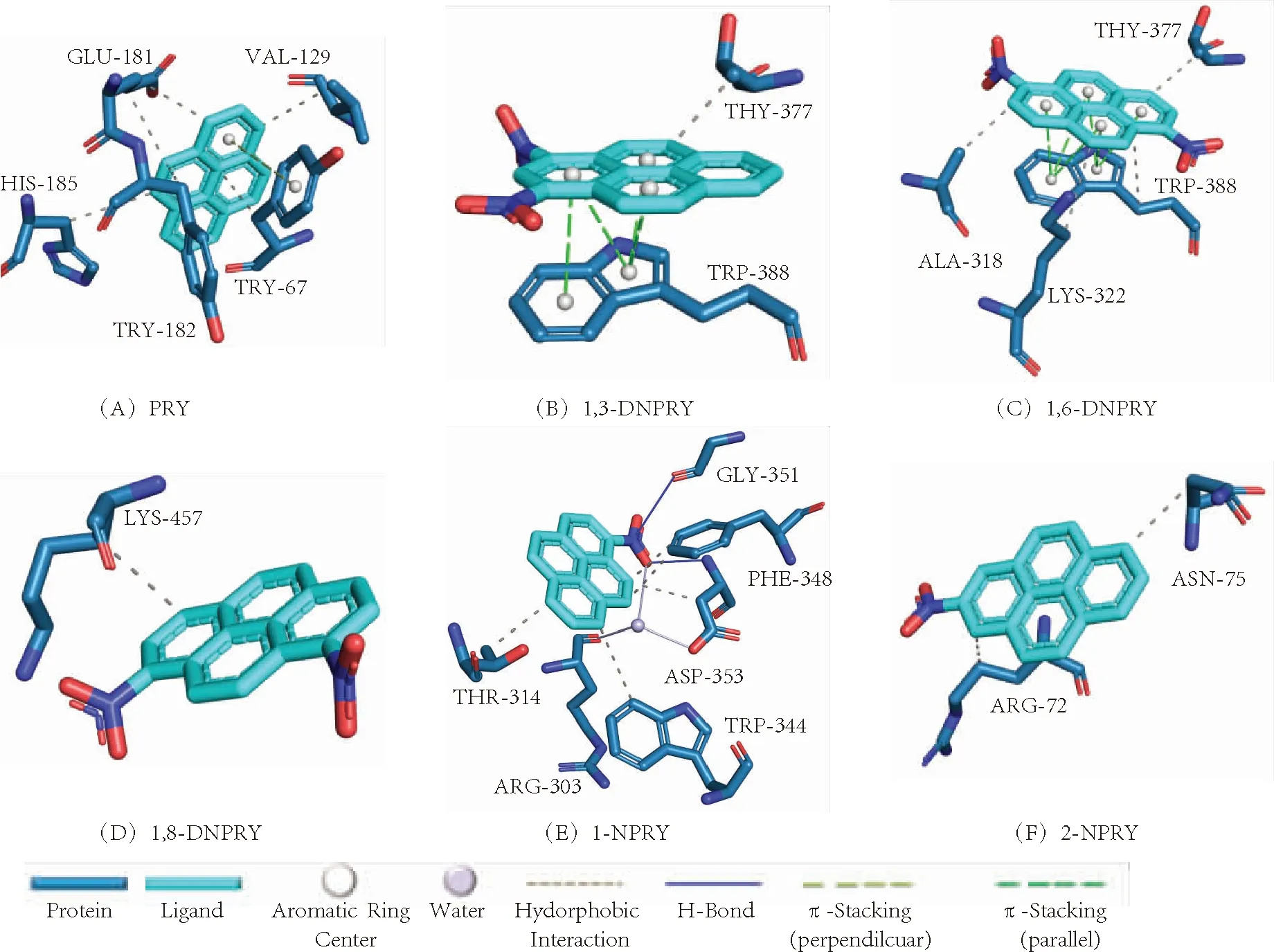
进一步对比分析最优构象中PYR及其5种NPYRs与α-淀粉酶的结合能和结合常数信息,详见表1.由表中可知,PYR、1,3-DNPYR、1,6-DNPYR、1,8-DNPYR、1-NPYR和2-NPYR与α-淀粉酶的结合能ΔG值分别为-29.87、-26.57、-27.36、-26.74、-25.73、-28.16 kJ/mol,相应的抑制常数为5.91、22.11、16.03、20.56、30.79、11.65 μmol/L.PYR及5种NPYRs对α-淀粉酶的抑制能力顺序为1-NPYR <1,3-DNPYR <1,8-DNPYR <1,6-DNPYR <2-NPYR 表1 PYR及5种NPYRs的理化性质及其与α-淀粉酶的抑制常数和结合自由能 为进一步揭示PYR及其5种NPYRs与α-淀粉酶结合能力差异机制,利用PLIP软件(可分析蛋白-配体复合物在原子水平的非共价相互作用,包括氢键、水桥、盐桥、卤键、疏水相互作用、π-堆叠、π-离子相互作用和金属复合物),获得了6种小分子与α-淀粉酶结合位点处周围的氨基酸残基的相互作用信息(图4及其支持信息),并结合Autodock对接结果中结合作用力分解信息(表2)对比分析. 图4 PYR 及5种NPYRs与周围氨基酸残基的相互作用信息 表2 PYR及5种NPYRs与α-淀粉酶结合自由能分解 由图4(A)可知,PYR主要与TYR67、VAL129、GLU181、TYR182和HIS185残基发生疏水相互作用.此外,PYR与TYR67残基的苯环形成了近乎垂直的T型π-堆积作用(两者质心距离0.490 nm,二面角79.72°).T型π-堆积作用的形成,使得PYR-α-淀粉酶复合物更加稳定. 由图4(B~D)可知,1,3-DNPYR与THR-377间依靠疏水作用力产生连接(原子间距离d为0.314 nm);而与TRP-388的芳香体系间形成了错位平行构象(Parallel-displaced)的π-π堆积作用(质心距离d分别为0.417、0.393、0.396和0.317 nm;二面角夹角分别为23.34°、23.34°、23.51°和23.34°).而 1,6-DNPYR主要与其结合位点周围4个氨基酸残基发生作用.其与 ALA-318(d为0.312 nm)、LYS-322(d为0.394 nm)、THR-377(d为0.314 nm)和 TRP-388(d为0.394 nm)间分别产生了疏水作用力;且其π-π共轭体系与TRP-388的芳香体系之间形成了不完全平行构象的π-π堆积作用(质心距离d分别为0.378、0.367、0.392、0.358、0.411和0.349 nm;二面角夹角分别为15.42°、15.27°、15.45°、15.22°、15.41°和15.30°)与大分子结合.而1,8-DNPYR仅与LYS-457残基产生疏水作用力(d为0.330 nm)连接.对比这3种NPYR与酶结合方式及表2可知,更多的疏水作用和π-π堆积作用[15]是造成1,6-DNPYR的范德华力和氢键作用力大于1,3-DNPYR和1,8-DNPYR的原因.此外,由表2可知,在三者与α-淀粉酶结合过程中,静电作用力(非键作用,PLIP软件未显示出)也为其者结合作用做出了较大的贡献. 据图4(E、F)可见,1-NPYR与THR-314(d为0.356 nm)、TRP-344(d为0.392 nm)、PHE-348(d为0.314、0.351 nm)和 ASP-353(d为0.356 nm)间产生了疏水作用力,并与ARG-303、ASP-353之间产生水桥作用,且与GLY-351、ASP-353残基之间分别形成了键长0.371、0.294 nm 的氢键.而2-NPYR则与周围2个氨基酸残基ARG-72(d为0.350 nm)和 ASN-75(d为0.349 nm)通过疏水作用力结合.结合表2可知,相比2-NPYR,1-NPYR与α-淀粉酶的范德华力和氢键作用力更强.然而2-NPYR与α-淀粉酶之间强的静电作用力(-4.31 kJ/mol)使得其结合能力最终强于1-NPYR. PYR及5种NPYRs均可依靠疏水作用力与α-淀粉酶结合,同时1,3-DNPYR和1,6-DNPYR与α-淀粉酶间还存在π-π堆积作用,1-NPYR与α-淀粉酶间还存在水桥和氢键作用.此外,1,8-DNPYR和2-NPYR与α-淀粉酶之间还存在强的静电作用力.在上述作用力中,疏水作用和静电作用对6种目标物与酶的结合作用大小贡献最重要.由于分子结构不同,致使PYR及5种NPYRs与α-淀粉酶之间的结合位点的氨基酸残基、结合作用力的类型、作用力强度表现出明显差异.总体而言,PYR及5种NPYRs与α-淀粉酶之间的结合能力主要受小分子疏水性的影响,而静电作用力和取代基个数、位点等分子构型差异也是影响NPYRs与α-淀粉酶结合的重要因素.此外,由α-淀粉酶的三维序列来看(https://www.rcsb.org/3d-sequence/3BAJ),图4(A)中GLU181、TYR182和HIS185,图4(B)中TRP-388,图4(C)中TRP-388、ALA-318、LYS-322,图4(E)中ARG-303、THR-314及图4(F)中ASN-75残基参与组成了该酶的α-螺旋(Helix)结构;而图4(D)中LYS-457、4(E)中PHE-348、ASP-353残基参与构建该酶的β-折叠(Sheet)结构.因此,可以推测虽然PYR及5种NPYRs并未落在α-淀粉酶的活性口袋中,但其与上述氨基酸之间的疏水、氢键、水桥等结合作用的形成很可能会破坏α-淀粉酶分子本身的氨基酸间氢键网络或螺旋结构、折叠结构等二级结构或三级构象,继而导致酶催化能力和活性变化. 本文利用分子对接技术对PYR及5种NPYRs与α-淀粉酶的相互作用进行了模拟研究.结果表明,6种PAHs与α-淀粉酶的结合位点存在明显差异.由于6种小分子在结合区域内的状态,结合的氨基酸残基的不同,其结合能力也有一定的差异.6种小分子与α-淀粉酶亲和能力的顺序为1-NPYR <1,3-DNPYR <1,8-DNPYR <1,6-DNPYR <2-NPYR 此外,静电作用力和取代基个数、位点等分子构型差异也是影响NPYRs与α-淀粉酶结合的重要因素.该结合作用很可能影响α-淀粉酶分子的二级结构,影响α-螺旋、β-折叠结构,破坏其氢键网络等,并干扰酶与底物结合能力,导致酶催化能力和活性变化.所获结果提示PYR及5种NPYRs污染物的摄入很可能会影响糖代谢相关酶的正常生理功能,进而干扰人体糖代谢过程.后期研究可结合多种光谱分析手段进一步实验探究NPAHs对α-淀粉酶分子的结合机制、对酶活性和结构的影响,验证并辅助本文结果,深入了解NPAHs与α-淀粉酶的结合作用及其不利影响.
2.3 小分子与其结合位点周围氨基酸残基的作用

3 结论
