克罗米芬与来曲唑联合注射用尿促性素治疗排卵障碍性不孕患者的疗效比较
2022-11-28刘丽娟陈贵芹
刘丽娟 冯 燕 陈贵芹
1 郑州金水锦华综合门诊部妇科,河南省郑州市 450000; 2 河南省人民医院妇产科
排卵障碍性不孕(Ovulatory disorder infertility,ODI)是临床妇科常见生殖疾病,占女性不孕病因的25%~30%,会导致多毛、闭经、月经失调、肥胖等,严重影响女性身心健康[1]。目前临床多采用促排卵方式治疗,但不同药物治疗效果有所差异,应保证优势卵泡质量并减少不良事件的发生。注射用尿促性素是治疗排卵障碍的常用药物,主要作用于无排卵所致不孕。克罗米芬属于一线促排卵药物,对雌激素具有强拮抗作用,能刺激卵泡生长与排卵,应用于ODI效果显著[2]。而来曲唑是芳香化酶抑制剂,能选择性抑制雌激素合成,刺激卵泡发育成熟,有助于排卵,但与克罗米芬的应用疗效对比在临床有待进一步探讨说明[3]。本文选取我院ODI患者88例,从性激素水平、雄激素受体通路等方面对比克罗米芬与来曲唑联合注射用尿促性素的治疗效果,现报告如下。
1 资料和方法
1.1 一般资料 选取2019年3月—2020年3月我院收治的88例ODI患者,按照随机数字表法分为来曲唑组、克罗米芬组,各44例。来曲唑组年龄23~41岁,平均年龄(30.68±3.78)岁;病程1~8年,平均病程(4.14±1.48)年;不孕类型:原发性不孕28例,继发性不孕16例。克罗米芬组年龄22~42岁,平均年龄(31.54±3.85)岁;病程1~9年,平均病程(4.27±1.53)年;不孕类型:原发性不孕29例,继发性不孕15例。两组基线资料(年龄、病程、不孕类型)均衡可比(P>0.05)。本研究经我院医学伦理委员会批准。
1.2 选择标准 (1)纳入标准:夫妻正常性生活无避孕>1年未受孕;经血性激素、子宫内膜、超声卵泡监测检查确诊为ODI;经腹腔镜检查至少一侧输卵管通畅;男性性功能正常;未采用其他任何激素或促排卵药物治疗;均签署知情同意书。(2)排除标准:子宫肌瘤、生殖器官发育障碍、盆腔疾病、生殖器官肿瘤等其他原因所致不孕;合并其他系统疾病无法接受治疗;对本研究药物过敏;配合度较低。
1.3 方法 来曲唑组采用来曲唑(Novartis Pharma Schweiz AG,批准文号:H20140149)治疗,月经周期第5天开始口服,5mg/次,1次/d,连续应用5d;克罗米芬组采用克罗米芬(上海衡山药业有限公司,国药准字H31021107)治疗,月经周期第5天开始口服,150mg/次,1次/d,连续应用5d。两组均于月经周期第6天给予注射用尿促性素(宁波人健药业集团股份有限公司,国药准字H20033042),肌内注射,75U/次,1次/d,连续用药9d。两组均连续治疗6个月经周期。
1.4 观察指标 排卵率、妊娠率、不良事件均于治疗月经周期后评估,卵巢体积、卵泡数目、子宫内膜厚度、血清性激素水平、雄激素受体通路指标均于治疗前、治疗6个月经周期后评估。(1)排卵率、妊娠率,排卵标准为B超检查显示优势卵泡形成且成熟,直径≥18mm,排卵后直径缩小,子宫直肠陷凹产生游离液体,阴道脱落细胞学涂片呈现周期性变化;妊娠标准为尿人类绒毛膜促性腺激素(HCG)实验为阳性,基础体温连续20d以上上升,B超检查可见孕囊与胎心搏动。(2)卵巢体积、卵泡数目、子宫内膜厚度,均采用B超检查测量。(3)血清性激素水平[卵泡刺激素(FSH)、雌二醇(E2)、促黄体生成素(LH)],采集清晨空腹静脉血5ml,以3 000r/min的速度离心5min,分离血清,采用化学发光法,严格按照试剂盒说明书操作步骤进行,试剂盒购自郑州安图生物工程股份有限公司。(4)雄激素受体通路指标[双调蛋白(Areg)、环氧合酶(COX-2)、雄激素受体(AR)],血清采集方法同上,取500μl装于EP管中,储存于-80℃冰箱,采用实时荧光定量聚合酶链反应测定。(5)不良事件,包括流产、盆腔/下腹部疼痛、卵巢过度刺激综合征(OHSS)。
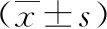
2 结果
2.1 排卵率、妊娠率 来曲唑组排卵率、妊娠率高于克罗米芬组,两组差异有统计学意义(P<0.05)。见表1。
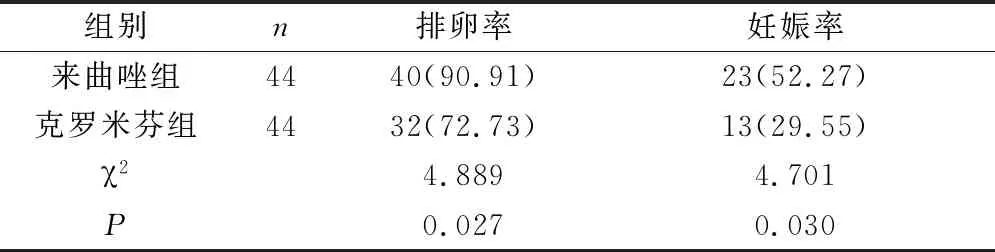
表1 两组排卵率、妊娠率对比[n(%)]
2.2 子宫内膜厚度、卵泡数目、卵巢体积 治疗6个月经周期后两组子宫内膜厚度大于治疗前,卵泡数目、卵巢体积小于治疗前,且来曲唑组子宫内膜厚度大于克罗米芬组,卵泡数目、卵巢体积小于克罗米芬组(P<0.05)。见表2。
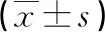
表2 两组子宫内膜厚度、卵泡数目、卵巢体积比较
2.3 血清性激素水平 治疗6个月经周期后两组血清LH、E2、FSH水平高于治疗前,且来曲唑组高于克罗米芬组(P<0.05)。见表3。
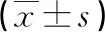
表3 两组血清性激素水平比较
2.4 雄激素受体通路指标 治疗6个月经周期后两组Areg、COX-2、AR低于治疗前,且来曲唑组低于克罗米芬组(P<0.05)。见表4。
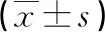
表4 两组雄激素受体通路指标比较
2.5 不良事件发生率 来曲唑组流产1例、OHSS 1例、盆腔/下腹部疼痛1例,不良事件发生率6.82%(3/44),克罗米芬组流产2例、OHSS 1例、盆腔/下腹部疼痛2例,不良事件发生率11.36%(5/44),组间比较差异无统计学意义(χ2=0.138,P=0.711)。
3 讨论
随着社会与家庭精神压力的剧增,会引起女性内分泌失调,性激素水平紊乱,引发不孕,据统计,ODI发生率为15%~25%[4]。
目前促排卵治疗是一线方案,注射用尿促性素是FSH类药物,含有1∶1的FSH与LH,直接替代垂体促性腺激素(Gn)作用于靶器官,调控卵巢生殖功能,促进卵泡成熟及排出。相关学者研究表明,注射用尿促性素配合其他促排卵药物治疗ODI能提升促排卵效果,提高妊娠率[5]。但不同促排卵药物作用效果不一致,本文对比克罗米芬、来曲唑两种药物,结果显示来曲唑组排卵率、妊娠率高于克罗米芬组,治疗6个月经周期后来曲唑组子宫内膜厚度大于克罗米芬组,卵泡数目、卵巢体积小于克罗米芬组(P<0.05)。其中克罗米芬能竞争性结合下丘脑雌激素受体,反馈性调节LH、FSH等性激素水平,发挥促卵效果[6]。但其抗雌激素作用会增加宫颈黏液稠度,不利于精子进入着床,整体促卵效果有待提升,且易发生不良事件。而来曲唑能强效抑制雌激素负反馈作用于下丘脑—垂体轴,刺激垂体分泌促性腺激素,有助于卵泡成熟,提高卵泡质量[7];且能改变周期性内膜,增厚子宫内膜,有助于受精卵着床,提高受孕率,效果明确。
性激素是ODI中的重要改变环节,与卵泡生长发育具有密切关联性,本文中对血清性激素水平进行分析探讨,结果显示治疗6个月经周期后来曲唑组血清LH、E2、FSH水平高于克罗米芬组(P<0.05),表明与克罗米芬比较,来曲唑对性激素的调节功能更加显著,有助于治疗效果的提升。另外,高雄激素不利于形成优势卵泡,导致闭锁,影响排卵。Areg是表皮相关生长因子,参与女性卵泡发育的调控;COX-2是重要限速酶,具有雄激素依赖性;而AR可激活并上调Areg的分泌,与COX-2免疫表达有关联[8]。因此,本文为进一步探讨来曲唑的治疗效果,从雄激素受体通路的调控入手进行分析,结果显示治疗6个月经周期后来曲唑组Areg、COX-2、AR低于克罗米芬组(P<0.05)。分析其原因为,来曲唑能通过竞争芳香酶活性位点来抑制COX-2表达,并间接性影响Areg、AR水平,促进排卵,表明其作用机制与雄激素受体通路的调控密切相关[9]。另外,两组不良事件发生率比较无差异(P>0.05),表明来曲唑不会增加不良反应的发生,安全性较高。但本研究样本量单一,临床进一步研究过程中应收集不同地域、不同年龄段患者,进行多中心分析。
综上所述,与克罗米芬比较,来曲唑联合注射用尿促性素治疗ODI能提高排卵率、妊娠率,改善子宫与卵巢功能,调节血清性激素水平,其作用机制可能与雄激素受体通路的调控有关。
