船盔乌头快速繁殖技术研究初探*
2022-11-28央金拉姆尼珍
央金拉姆 尼珍
(西藏自治区高原生物研究所,西藏 拉萨 850000)
船盔乌头(Aconitum naviculare(Bruhl.)Stapf)又名船形乌头、其藏药名为“榜嘎”,属于毛茛科乌头属的矮小草本植物,块根小,胡萝卜形,茎高10~45 厘米,下部无毛,上部疏被反曲并贴伏的短柔毛。基叶及下部茎生叶具长柄;叶片半圆状五角形或肾形,长1~2厘米,宽1.4~3 厘米,基部心形或截形,3 裂近中部,表面疏被短柔毛,背面无毛,叶柄长2.5~14 厘米,无毛。茎生叶1~3,渐变小。总状花序具2~4 花;轴及花梗被反曲的短柔毛;花梗长达6厘米;小苞片生花梗茎顶部处,线形,长6~7 毫米;萼片堇色,外面疏被短柔毛,上萼片船形,自基部至喙长约1.6 厘米,侧萼片宽倒卵形,长约1.6 厘米;花瓣无毛,瓣片长约2.5 毫米,唇长约1.5 毫米,距长约1 毫米,向外弯;心皮5,子房疏被短柔毛。9月开花。性味苦,寒,有小毒。生于高山碎石缝隙和高山草甸,灌丛中、或河滩上,海拔4100~5000 米。产于拉萨、朗县、加查、乃东(泽当)、墨竹工卡(格桑)、错那、亚东(帕里)。其块根状如小象犬牙,叶翠绿,螺状,有清热解毒利湿的功效,能治胃炎、肝炎、肾炎、肠炎。[1]
《概念释诠》中说:“榜嘎生长在阴凉的石山坡,螺形根如象牙,叶如玉叶,螺状花很美丽,为解毒清胆热之后药。”《图鉴》中说:“榜嘎分白、黑、红、黄四种,白、红、黄三种是药,黑乌头有毒亦可入药。”据《晶珠本草》记载“船盔乌头味苦,性凉。清热解毒。治瘟病时疫、赤巴病、传染病发烧、肝胆热病,特别是胆热病和宿热病疗效尤佳,食物中毒、胃炎、肝炎。外用洗蛇、蝎咬伤。其主要化学成分有二萜生物碱,经鉴定有C20二萜生物碱阿替辛及C19内酯型二萜生物碱杂阿替辛及苯甲酰杂阿替辛。船盔乌头中含有的生物碱阿替辛对猫、兔及狗具有降压作用,小剂量能加强肾上腺素的升压作用但减少心动徐缓。异阿替辛则有降压及阻碍呼吸的作用,并能对抗由于乌头碱或氯化钙所导致的心律不齐的作用。船盔头的块根对小鼠的LD50(静注)为2.374mg/kg,而船盔乌头中所含主要生物碱之一杂阿替辛对小鼠LD50(静注)为180~190g/kg,因而船盔乌头在乌头类中属于毒性较低的一类。”
2015 年由西藏自治区科技厅组织的根据我区藏医药专家、植物学家、各企业等对我区濒危藏药材品种的选定进行收集和整理后,评选出西藏濒危藏药材品种,划分为三个保护等级,其中,船盔乌头列入一级濒危名录。
1 船盔乌头组培快繁技术研究背景
组培快繁技术是根据细胞的全能性理论,也称离体培养,是指从植物体分离出符合需要的组织、器官或细胞,原生质体等,通过无菌操作,在无菌条件下接种至含有各种营养物质及植物激素的培养基上进行培养,来获得再生的完整植株技术。有研究表明,西藏地区藏药“榜嘎”的实际基原是船盔乌头的干燥全草或地上部分,据自治区藏药厂提供的资料,约30%的藏药组方中都有船盔乌头的组分,安儿宁颗粒、大月晶丸、坐珠达西、流感丸、十三味榜嘎丸、十二味奇效汤散、八味獐牙菜、二十五味松石丸和亚玛众清制剂等藏药当中都含有船盔乌头。[2]目前船盔乌头的供给主要是靠野生资源,但是市场上对船盔乌头的需求量日不断增多,但自然状态下船盔乌头分布零星,单株产量低下,自然生长赶不上人为采集,采集量的增大不仅破坏种群的自然更新,也破坏了船盔乌头的生境,使得船盔乌头的资源趋于濒危状态,已经在一定程度上影响到藏医药事业的健康发展。因此,研究船盔乌头的组培快繁技术迫在眉睫。[3]
2 船盔乌头组织培养研究现状
目前,有关一级濒危藏药植物船盔乌头的研究,涉及资源与使用情况、种子萌发特性研究、染色体数目和核型分析、化学成分分离及其薄层色谱定性鉴别研究、生物碱成分分离及质量标准研究、总生物碱的抗炎作用等领域,但涉及本研究特点的一级濒危藏药植物船盔乌头的组织培养快速繁殖研究尚属空白,因此,通过本研究进行一级藏药植物船盔乌头的快速繁殖研究,从而能够缓解船盔乌头野生资源匮乏、用药资源紧缺的压力。
3 无菌苗的获取
3.1 外植体的选取和处理
本实验选择2019 年拉萨周边采集的船盔乌头植株作为实验材料,分别用船盔乌头的种子、船盔乌头的根、船盔乌头的茎段和船盔乌头的叶片四种组织作为外植体。
外植体材料的消毒灭菌处理,是植物组培实验过程中的关键一步,影响愈伤组织的褐化率或诱导率,进而影响组培苗的存活率。
船盔乌头干种子黑褐色,呈“扁金字塔”形,长1.5~2.2mm,宽0.6~1.1mm,厚可达0.8mm。种子表面不光滑,皱缩,种脊边缘延生成翅状。船盔乌头种子千粒重为(0.495±0.003)g,属于极小粒种子。首先用肥皂水将种子清洗干净,后用酒精对种子进行消毒,最后在超净工作台上以0.1% HgCL 溶液设置消毒处理时间梯度,再用无菌水清洗4~5 次,沥干水分备用。
船盔乌头的叶片肾状五角形或肾形,长1~2 厘米,宽1.4~3厘米,三裂近中部,中央裂片菱状倒梯形,侧裂片斜扇形,不等二裂近中部,表面疏被短柔毛,背面无毛;叶柄长2.5~14 厘米,无毛,基部具不明显的鞘。茎生叶1~3 枚,稀疏排列,具较短柄。选择较嫩的叶片,剪成两片,先用水清洗干净,再用酒精进行消毒,后用0.1% HgCL 溶液设置消毒处理时间梯度,再用无菌水清洗4~5 次,沥干水分。
船盔乌头的茎段下部无毛,上部疏被反曲而紧贴的短柔毛,呈圆柱形空心,取嫩枝上的茎段,用肥皂水进行清洗,再用酒精进行消毒,以0.1% HgCL 溶液进行消毒处理,设置消毒处理时间梯度,再用无菌水清洗4~5次,沥干水分备用。
3.2 外植体启动培养
已经消毒处理过的三种外植体(种子、茎段、叶片)在超净工作台上分别接种至初始培养基上,初始培养基为MS+肌醇0.1g/L+蔗糖30g/L+琼脂粉5g/L,PH 值5.8。培养基是植物组织快繁过程中最主要的部分,是植物组织生长发育的主要营养来源。接种后在智能人工气候培养箱内暗培养14d后,三种外植体中只有消毒时间为8 min 和10 min的种子开始发芽,再移至培养室光照条件下培养20d,培养温度为20±2℃。即可长出小苗,再培养20d 无菌小苗可长至约4cm 高,茎段和叶片作为外植体启动培养都未发芽成功。此处,对三种外植体的消毒处理,都是用酒精和0.1% HgCL 进行消毒处理。

表1 0.1% HgCL不同处理时长萌发情况对比
4 分化及生根培养
4.1 船盔乌头分化培养
分化培养是促进细胞发育成各自的组织。将初始培养得到的船盔乌头无菌苗剪切成节段,分别接种到以下9种不同的培养基当中:
(1)1/2MS+6-BA10mL/L+蔗糖30g/L+琼脂粉6g/L+肌醇0.1g/L,PH值5.8;
(2)1/2MS+6-BA15mL/L+蔗糖30g/L+琼脂粉6g/L+肌醇0.1g/L,PH值5.8;
(3)1/2MS+6-BA20mL/L+蔗糖30g/L+琼脂粉6g/L+肌醇0.1g/L,PH值5.8;
(4)1/2MS+IAA0.05mL/L+蔗糖30g/L+琼脂粉6g/L+肌醇0.1g/L,PH值5.8;
(5)1/2MS+IAA0.1mL/L+蔗糖30g/L+琼脂粉6g/L+肌醇0.1g/L,PH值5.8;
(6)1/2MS+IAA0.15mL/L+蔗糖30g/L+琼脂粉6g/L+肌醇0.1g/L,PH值5.8;
(7)1/2MS+NAA0.05mL/L+蔗糖30g/L+琼脂粉6g/L+肌醇0.1g/L,PH值5.8;
(8)1/2MS+NAA0.1mL/L+蔗糖30g/L+琼脂粉6g/L+肌醇0.1g/L,PH值5.8。
(9)1/2MS+NAA0.15mL/L+蔗糖30g/L+琼脂粉6g/L+肌醇0.1g/L,PH值5.8。
在培养室的光照条件下培养至20d,能观察到3号分化培养基里的船盔乌头无菌苗存活率和长势都优于其余8种分化培养基。
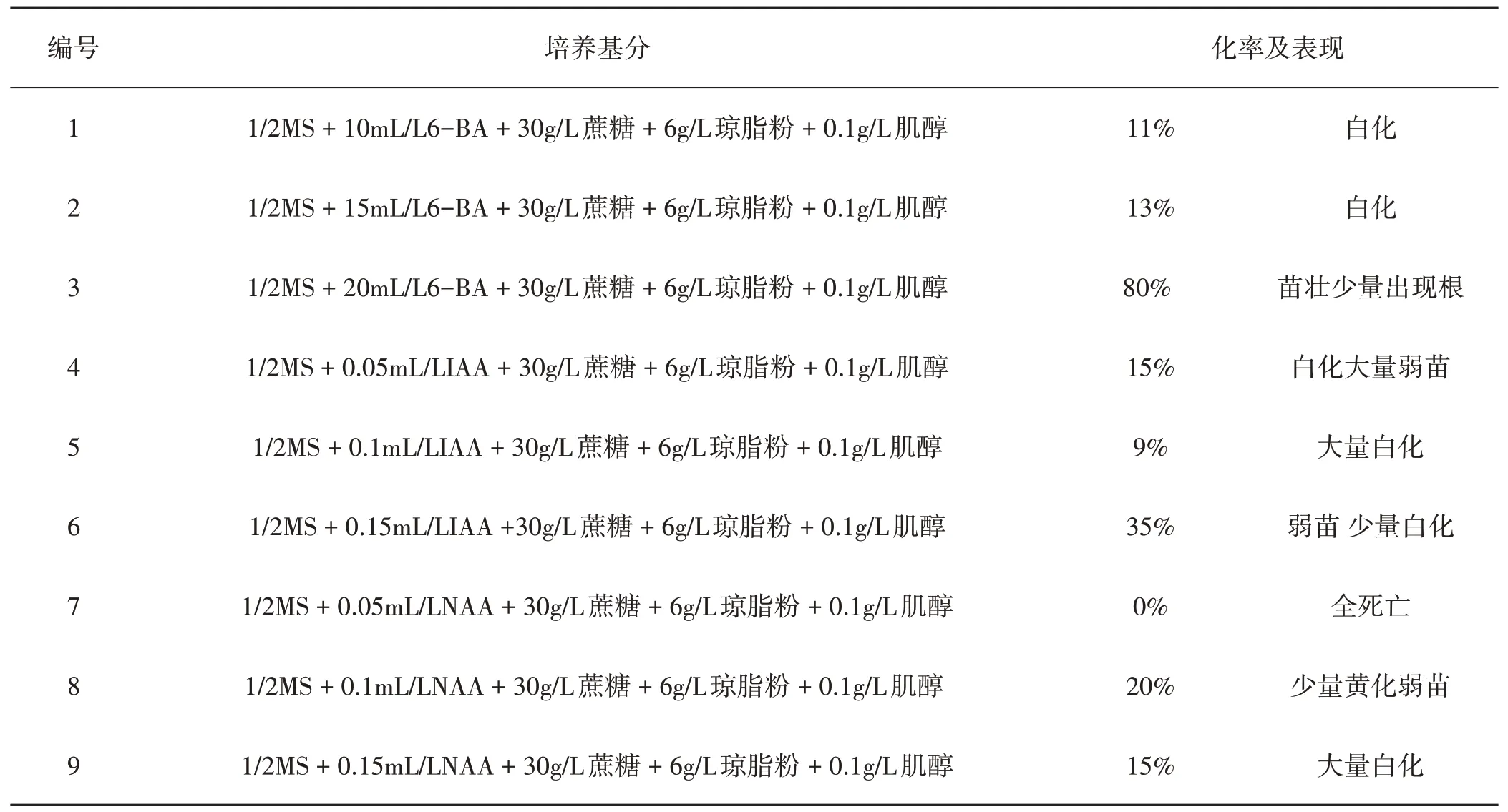
表2 不同分化培养基对比
4.2 船盔乌头生根培养
生根培养是使无根苗生根的过程,这个过程目的是使生出的不定根浓密而粗壮。将分化培养得到的无菌苗分别接种到以下10种不同的培养基当中:
(1)MS+蔗糖30g/L+琼脂粉5g/L+活性炭0.25g/L+肌醇0.1g/L,PH值5.8;
(2)1/2MS+6-BA5mL/L+蔗糖30g/L+琼脂粉6g/L+活性炭0.25g/L+肌醇0.1 g/L,PH值5.8;
(3)1/2MS+6-BA7mL/L+蔗糖30g/L+琼脂粉6g/L+活性炭0.25g/L+肌醇0.1 g/L,PH值5.8;
(4)1/2MS+6-BA9mL/L+蔗糖30g/L+琼脂粉6g/L+活性炭0.25g/L+肌醇0.1 g/L,PH值5.8;
(5)1/2MS+NAA0.5mL/L+蔗糖30g/L+琼脂粉6g/L+活性炭0.25g/L+肌醇0.1g/L,PH值5.8;
(6)1/2MS+NAA1mL/L+蔗糖30g/L+琼脂粉6g/L+活性炭0.25g/L+肌醇0.1g/L,PH值5.8;
(7)1/2MS+NAA1.5mL/L+蔗糖30g/L+琼脂粉6g/L+活性炭0.25g/L+肌醇0.1g/L,PH值5.8;
(8)1/2MS+IAA0.5mL/L+蔗糖30g/L+琼脂粉6g/L+活性炭0.25g/L+肌醇0.1g/L,PH值5.8;
(9)1/2 MS+IAA1mL/L+蔗糖30g/L+琼脂粉6g/L+活性炭0.25g/L+肌醇0.1g/L,PH值5.8;
(10)1/2 MS+IAA1.5mL/L+蔗糖30g/L+琼脂粉6g/L+活性炭0.25g/L+肌醇0.1g/L,PH值5.8。
接种时将带腋芽节段斜插在培养基上,接种后放在人工智能培养箱内进行培养。培养箱的环境设置模拟船盔乌头的野外生长环境,即白天、夜晚两个时段,白天12 小时,温度20℃,光照强度1000~1500Lx;夜晚12 小时,温度10℃,无光照,在此培养箱内培养20d 左右可以发现有明显的根部粗壮现象,相比之下10 种培养基当中1 号生根培养基和2 号生根培养基的长势最好。

表3 不同生根培养基对比
5 结果与分析
5.1 本次船盔乌头组织培养启动实验通过酒精和0.1%HgCL 对所选外植体进行消毒处理,利用初始培养基MS+肌醇0.1g/L+蔗糖30g/L+琼脂粉5g/L,PH值5.8,在人工气候培养箱里进行暗培养,结果只有种子作为外植体时萌发成功,茎段和叶片作为外植体进行启动试验时并未成功萌发,因此,种子作为外植体比较方便消毒,成功获得无菌苗。
5.2 船盔乌头的组织培养分化培养过程中,通过添加不同浓度的细胞生长素和细胞分裂素的MS 培养基,研究对船盔乌头初始无菌苗形成的影响,表明培养基1/2MS+6-BA 20mL/L+蔗糖30g/L+琼脂粉6g/L+肌醇0.1g/L,PH5.8适合于船盔乌头初始无菌苗的分化。
5.3 船盔乌头组织培养生根培养过程中,通过添加不同浓度的细胞生长素和细胞分裂素的MS 培养基,研究对船盔乌头已经分化的组培苗形成的影响,结果表明培养基MS+蔗糖30 g/L+琼脂粉5g/L+活性炭0.25g/L+肌醇0.1g/L,PH 值5.8 和1/2MS+6-BA 5mL/L+蔗糖30 g/L+琼脂粉6g/L+活性炭0.25g/L+肌醇0.1 g/L,PH值5.8,最适合船盔乌头的生根培养。
