‘锦苗标靶’诱抗剂抑制列当寄生向日葵的机制研究
2022-11-26刘志达郭晓晴张之为张文兵
段 锐,刘志达,郭晓晴,张之为,张文兵,赵 君,张 键*
(1 内蒙古农业大学 园艺与植物保护学院,呼和浩特 010018;2 内蒙古自治区农牧业技术推广中心经济作物技术处, 呼和浩特 010020)
向日葵(HeliauthusannuusL.) 又名朝阳花,一年生菊科向日葵属植物,原产于北美,目前在世界各地均有种植,并逐渐发展成为具有较高经济价值的作物之一。中国向日葵种植面积约为80万hm2,其中内蒙古和新疆是中国向日葵的主要种植地区[1]。近年来,由于向日葵杂交种的大量进口,国内检疫力量的薄弱,导致列当在中国向日葵主产区呈现出大面积扩增和蔓延的态势。据调查,普通发病地块能够导致向日葵减产15%~30%,严重的地块可减产60%[2]。目前,向日葵列当已经成为限制中国向日葵产业发展的主要瓶颈因素,极大地影响了中国向日葵产业的稳步发展。
向日葵列当(OrobanchecumanaWallr.)又称毒根草、兔子拐棍,是双子叶植物纲管状花目列当科列当属一年生寄生草本植物。由于自身缺乏叶绿素,不能进行光合作用,无真正的根,只是靠短须状假根侵入向日葵的根系组织内夺取水分、碳水化合物和矿质营养来满足自己的生长和繁殖[3]。向日葵列当的寄主广泛,主要寄生于向日葵、西瓜、番茄等作物[4]。目前,向日葵列当在中国主要发生在河北、新疆、内蒙古等地区,其中新疆和内蒙古向日葵种植区列当的发生面积最大,危害最为严重[5]。
植物免疫诱导抗病性是利用诱导因子激活植物自身的天然免疫系统,增强植物对病原物侵害和逆境胁迫的防御能力[6]。利用弱毒的病原菌侵染植物后,植物的防御反应被激活,被侵染部位释放出信号产物,如水杨酸(SA)被转移到植物其他部位进而诱发植物全株性防御反应体系的建立,即系统获得性抗性(SAR)的建立。植物诱导的系统性抗性,通过调节植物自身的防卫、代谢系统,诱导产生免疫反应,以达到延迟或减轻病害发生的目的[7]。因此,植物的这种诱导抗病性逐渐得到了广泛的关注。
植物诱抗剂分为生物源和非生物源两类,生物源类诱抗剂包括寡糖类诱抗剂(如几丁寡糖)、蛋白质和类糖源诱抗剂(如糖蛋白)、微生物类诱抗剂(如真菌);非生物源类诱抗剂包括物理诱抗剂(如电磁处理)和化学诱抗剂(如抗生素)[8]。
在植物抵御病原菌入侵过程中,寄主细胞壁中的胼胝质会迅速沉积堵塞筛管,调控筛管的运输功能,从而影响植物正常的生长代谢过程。病原物还会诱导活性氧(ROS)的积累,进而会促使体内ROS清除酶活性迅速增高,促使ROS转换为毒害较低或无害的物质。此外,一些信号分子如SA、JA以及ETH等也会在诱抗剂的作用下大量积累,促使寄主系统获得性抗性的建立。
目前,植物免疫诱抗剂被广泛应用于农作物有害生物的防控中[9],特别是在向日葵上也有一定的应用。如 Sauerborn J等[10]利用苯并噻二唑诱导向日葵抑制列当的寄生取得了良好的效果。Yang等[11]的研究表明,外源施用水杨酸能诱导向日葵产生防御机制抵抗向日葵列当的侵染。Li等[12]利用5-氨基乙酰丙酸(ALA)抑制列当侵染向日葵,施用ALA后能够促使JA和ETH生物合成途径的相关基因在列当侵染后显著上调。这些研究表明,外源施用诱抗剂能够抑制列当对向日葵的寄生,而这种抑制效果是通过在结构抗性以及生理生化水平抗性的变化而实现。
‘锦苗标靶’是一种富含氨基酸的水溶肥诱抗剂,可通过叶片喷雾或根系浇灌来诱导植物抗性的建立。本研究通过根系浇灌‘锦苗标靶’,研究了在不同向日葵品种上列当寄生后向日葵的结构抗性以及生理生化抗性指标的变化。这一研究结果将为利用‘锦苗标靶’防控向日葵列当提供一定的理论依据。
1 材料和方法
1.1 供试材料
供试的2个向日葵为食葵品种LD5009(购自北京凯福瑞种业公司)和JK103(购自华夏种业公司)。
供试药剂‘锦苗标靶’购自内蒙古锦苗农业发展有限公司,浓度为1.08 g·mL-1,基于实验室前期研究结果,室内根系浇灌的稀释倍数为1∶2 000。
向日葵列当的种子采自于内蒙古四子王旗小前地村(E111°42′,N41°31′),生理小种鉴定为G小种。
1.2 向日葵幼苗准备(培养皿滤纸法)
(1)催芽:将向日葵种子置于培养皿内,自来水浸泡24 h后用纱布包好,覆盖湿抹布后,在室温下催芽4~5 d,其间每日需用自来水冲洗1~2次。
(2)备皿:首先,在13 cm×13 cm的方皿内铺厚度约为4 cm的棉花并将其浸湿;其次,剪与方皿等大的滤纸,并称取4 mg已纯化的列当种子于滤纸上,用刷子使其均匀分布于滤纸四分之三的位置并铺于已浸湿的棉花上备用。
(3)接苗:将已催好芽的向日葵幼苗去壳后将其根平铺于方皿内,同时,将子叶置于皿外侧,每皿接种2株向日葵幼苗。之后用锡箔纸包裹方皿,使其垂直放置在光照培养箱内进行培养,每2 d浇水1次。培养条件:温度23~27 ℃、相对空气湿度约50%~70%、光周期 14 h/10 h(光照/黑暗)。
1.3 试验方法
1.3.1 根系浇灌与取样(1)根系浇灌:将‘锦苗标靶’与蒸馏水按照1∶2 000稀释到三角瓶中,避光保存。接苗10 d后在解剖显微镜下观察列当种子萌发的情况;在向日葵幼苗长到13 d时,此时列当种子萌发的芽管刚刚接触到向日葵根系但是还未有瘤结形成时,向培养皿中向日葵的根系均匀浇灌5 mL稀释的‘锦苗标靶’药剂,对照浇灌5 mL的蒸馏水。
(2)取样:在根系浇灌处理液后0、24、48 和72 h进行取样。每日在相同时间取带有瘤结的向日葵根系,作为后续试验的材料。每个处理设3次重复。
1.3.2 向日葵生长指标的测定先将泥土、蛭石和基质以1∶1∶1的比例混合均匀,一部分先加水拌匀后,铺在12 cm(直径)×13 cm(高)的营养钵三分之一处,另一部分混合土加0.1 g列当并充分混匀倒入营养钵中间三分之一,上层铺少许湿润的混合土。将提前准备好的LD5009和JK103的种子按照每个营养钵2粒种到土里,在种子表面覆盖1层混合土。将营养钵置于光照培养箱内,培养条件与向日葵幼苗培养条件相同。每个处理设8次重复。在播种后第13天根系浇灌1∶2 000‘锦苗标靶’稀释液,待向日葵生长20 d后,统计各处理向日葵根系列当的寄生数量和鲜干质量,以及向日葵株高、茎粗、地上和地下部鲜干质量。
1.3.3 胼胝质的组织化学染色取新鲜的向日葵根系,利用苯胺蓝进行染色[13]。称取0.01 g苯胺蓝溶于150 mmol/L的K2HPO4中(pH 9.5),将向日葵根系浸泡于染液中染色1 h,在显微镜下观察染色情况。每个处理重复3次。
1.3.4 H2O2含量测定利用上面不同的根系样本,按照索莱宝公司提供的检测试剂盒测定H2O2含量。在波长415 nm测定样本吸光度(A),利用公式计算H2O2含量。每个样品3次重复。
H2O2含量(μmol/g)=2×ΔA测定÷ΔA标准÷W
式中:ΔA测定=A测定管-A空白管;ΔA标准=A标准管-A空白管;W为组织质量,单位为g。
1.3.5 ROS清除酶活性测定利用上面不同的根系样本进行ROS清除酶活性的测定。其中超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)光还原法[14];过氧化物酶(POD)测定采用愈创木酚法[15];过氧化氢酶(CAT)测定采用H2O2消光系数法[16];多酚氧化酶(PPO)测定采用分光光度法[17]。每个处理设3次重复。
1.3.6 抗性相关基因表达分析不同样本总RNA的提取按照Li等[12]的方法。使用金百特试剂盒反转录成cDNA。qRT-PCR特异性引物见表1。qRT-PCR采用CFX96TM系统(Bio-Rad),反应体系根据TaKaRa操作说明,反应条件为95 ℃预变性30 s,95 ℃变性5 s,59 ℃退火和延伸45 s,40个循环。
1.4 数据处理
采用SPSS方法对各指标的差异显著性进行检验。
2 结果与分析
2.1 ‘锦苗标靶’对向日葵列当寄生的抑制
向日葵根系浇灌诱抗剂‘锦苗标靶’后,对不同品种列当寄生的影响结果如表2所示。在施用‘锦苗标靶’20 d后,LD5009中列当瘤结数相比对照(施用清水,下同)减少了95.5个,寄生率降低了98.20%;列当的鲜质量和干质量分别降低了0.35和0.08 g,降幅为94.60%和81.63%;而相应的向日葵株高和茎粗分别增加了2.09 cm和0.52 mm,增幅为14.92%和15.29%;地上部的新鲜质量和干质量也分别增加0.17和0.08 g,增幅为4.42%和25%。JK103中列当瘤结数相比对照减少37.5个,寄生率降低了98.04%;列当的鲜质量和干质量也分别降低了0.33和0.04 g,降幅为97.06%和82.69%;而向日葵的株高和茎粗分别增加2.07 cm和0.39 mm,增幅为12.26%和9.70%;同时,JK103地上部的新鲜质量和干质量分别增加0.30和0.12 g,增幅分别为6.79%和27.27%。

表2 诱抗剂抑制列当对向日葵的寄生
2.2 ‘锦苗标靶’对向日葵根系胼胝质沉积的影响
施用‘锦苗标靶’后,向日葵根系细胞壁胼胝质染色结果(图1,A-D)显示,LD5009锦苗标靶在瘤结(图中标红色五角星)附近0 h(图1,A)胼胝质的沉积量显著低于JK103锦苗标靶。在根系浇灌24 h(图1,B)后,无论是处理还是对照,不同品种向日葵根系的瘤结附近,细胞壁中胼胝质的沉积量相比0 h均有增加。但是,就整体而言,JK03锦苗标靶根系中沉积的胼胝质量更多。在根系浇灌48 h(图1,C)后,处理组与对照组根系中瘤结附近的胼胝质均有大量的沉积,整体沉积量均高于24 h根系样本中的沉积量。在根系浇灌72 h(图1,D)后,根系中瘤结附近胼胝质的沉积量较48 h略有下降。
施用‘锦苗标靶’后,向日葵根系细胞壁胼胝质染色后的荧光结果(图1,E)显示,在根系浇灌0 h,JK103、LD5009胼胝质的荧光强度没有明显差异;24 h后,JK103锦苗标靶、LD5009锦苗标靶胼胝质荧光强度均有所增加,且与各自对照差异显著。48 h后,JK103锦苗标靶、LD5009锦苗标靶根系胼胝质荧光强度与其对照差异显著,且荧光强度均达到最大值。72 h后,2个品种的处理与对照在胼胝质荧光强度上均无显著差异。
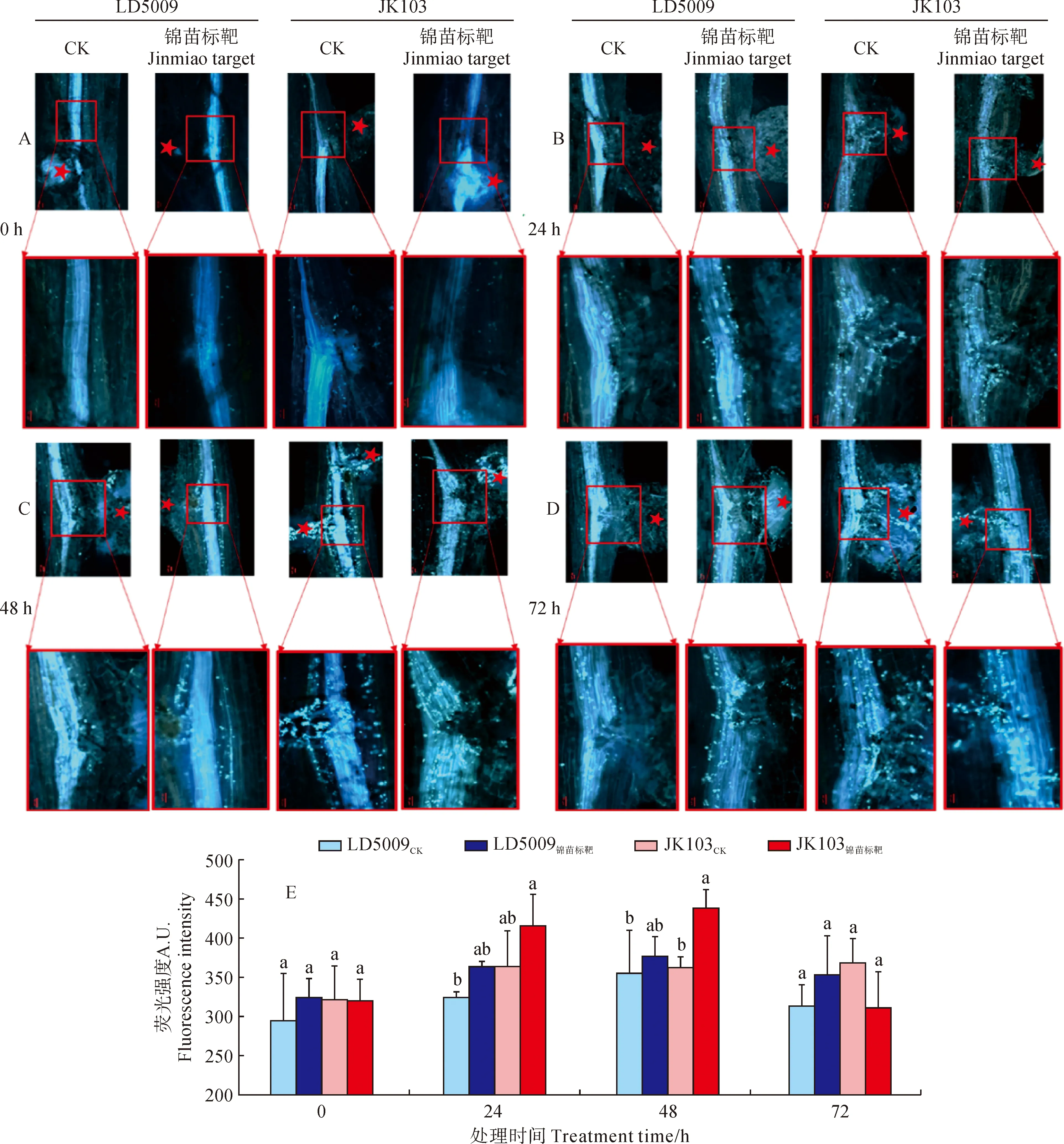
A-D为LD5009和JK103分别在0、24、48和72 h取样染色,红色五角星代表瘤结
2.3 ‘锦苗标靶’对向日葵根系中H2O2积累的影响
根系浇灌‘锦苗标靶’后,不同品种向日葵根系中H2O2含量的测定结果(图2)显示,诱抗剂处理24 h后,JK103锦苗标靶H2O2含量较JK103CK增加了0.31 μmol·g-1,增幅为9.63%;LD5009锦苗标靶较LD5009CK增加了1.81 μmol·g-1,增幅为208.05%。48 h后,JK103锦苗标靶、JK103CK和LD5009锦苗标靶中H2O2含量均比24 h的样本有所下降,仅LD5009CK较24 h增加了1.28 μmol·g-1,增幅为147.13%。72 h后,所有处理样本中H2O2含量均有所降低,其中LD5009锦苗标靶较对照降低了38.24%,而JK103锦苗标靶较对照降低了34.23%。
2.4 ‘锦苗标靶’对向日葵根系中ROS清除酶活性的影响
根系浇灌‘锦苗标靶’后,JK103和LD5009根系的4种ROS清除酶活性总体均呈现先升高后下降的趋势(图3)。JK103锦苗标靶和LD5009锦苗标靶均在48 h达到峰值,此时,JK103锦苗标靶较JK103CK的SOD、POD、CAT、PPO活性分别增加了69.77 U·g-1、5.44 U·g-1·min-1、1.88 U·g-1·min-1和527 U·g-1·min-1;LD5009锦苗标靶较LD5009CK的4种ROS清除酶的活性分别增加了25.91 U·g-1、13.16 U·g-1·min-1、0.50 U·g-1·min-1和313 U·g-1·min-1。

图3 ‘锦苗标靶’处理后向日葵根系抗氧化酶活性的变化
2.5 ‘锦苗标靶’对抗性相关基因转录水平的影响
为了明确‘锦苗标靶’对向日葵抗性基因转录水平的调控影响,在诱抗剂处理下对7个不同抗性基因的转录本进行了检测。结果(图4)显示,在根系浇灌‘锦苗标靶’后,供试7个抗性基因的相对表达量均呈现先升高后下降的趋势,尤其以48 h表达量最为显著。

图4 ‘锦苗标靶’处理后向日葵根系抗性相关基因的表达
在‘锦苗标靶’处理24 h后,LD5009锦苗标靶中的CAT、PAL、Mn-SOD和XTH6基因的相对表达量相比对照分别上调了347.02%、63.61%、115.25%和60.26%;而ACCO1和PR1基因表达量却分别下调了24.81%和48.18%;LOX基因表达量没有显著的变化。JK103锦苗标靶样本中CAT、LOX、PAL、XTH6相对表达水平相比对照也分别上调了43.10%、51.91%、104.54%和42.36%,其余基因与对照无显著差异。
在‘锦苗标靶’处理48 h后,JK103和LD5009中7个抗性基因的相对表达量比对照均表现出显著上调的趋势,LD5009锦苗标靶比LD5009CK的7个抗性基因分别上调了1 386.48%、1 194.69%、1 291.96%、3 279.22%、7 495.45%、6 295.50%和5 007.25%;JK103锦苗标靶相对于JK103CK呈现上调趋势,总体上调幅度低于LD5009锦苗标靶。
在锦苗标靶处理72 h后,除了LOX基因在LD5009锦苗标靶中的相对表达量呈现上调趋势外,其他供试的抗性基因在LD5009锦苗标靶中均下调。在JK103锦苗标靶中,除了CAT和ACCO1基因呈现下降趋势外,其余基因的表达量与对照相比几乎没有发生变化。
3 讨 论
向日葵列当是中国向日葵产区的主要草害之一,目前国内采用的主要防治方法尚不能有效抑制列当种子的萌发和寄生,挖掘、筛选抗列当的向日葵种质资源是培育抗性品种的基础[18],同时明确向日葵和列当的互作机理,加快寻找防控向日葵列当的新措施成为当务之急。诱抗剂通过激发植物本身的防御系统来抵抗病原物的袭击,已在其他植物的互作过程中效果显著,因此,诱抗剂具有较传统的防控向日葵列当措施更大的潜力和挖掘空间。
本试验通过‘锦苗标靶’诱抗剂来诱导向日葵产生抗性抵御列当侵染,以减轻向日葵列当的危害。结果表明:‘锦苗标靶’对向日葵列当的寄生有显著的抑制效果,在向日葵列当寄生前(瘤结未形成)施用,仅有一小部分列当可以正常寄生在向日葵根系并形成瘤结,然而绝大部分列当因无法建立寄生关系而死亡。诱抗剂处理抑制了列当对向日葵根系的寄生,从而减少了列当在向日葵根系上的寄生数量。本结果与柳慧卿等[19]研究结果一致。
本试验中列当生物量测定结果显示,施用‘锦苗标靶’的效果在JK103的各项生长指标均最为显著,LD5009在施用外源添加剂的情况下能达到与JK103相同的抑制效果,这与王建蘇[20]的研究结果相似,预示着种植感列当但是商品性好的向日葵品种结合施用诱抗剂,可以整合在向日葵列当综合防控技术体系中。
‘锦苗标靶’处理后24 h后,2个向日葵品种中的ROS迅速达到峰值,为避免向日葵细胞受ROS毒害作用,ROS清除酶的活性也随之被诱导升高,就4种ROS清除酶活性而言,JK103被诱导的程度高于LD5009。在列当侵染的过程中,这些ROS清除酶都扮演着重要的角色。这与张默靖等[21]研究结果类似,不同抗性向日葵品种在苗期ROS清除酶均呈现先升高后下降的趋势。此外,野豌豆抗病品种Popany感染O.aegyptiaca后过氧化物酶活性增加2倍,且发生时间在接种后24~72 h[22];在接种向日葵列当24 d后,抗病品种‘同辉31号’根系的POD、CAT和SOD活性分别是感病品种‘关尔一号’的1.66、1.66、2.04倍[23]。本研究结果和上述研究结果非常一致。
本研究发现诱抗剂可以促进向日葵根系细胞中胼胝质的沉积量增加,而胼胝质沉积能够在结构水平上抵御列当对寄主根系的侵染。植物细胞的栓化和木质化常常与ROS形成有关[24],胼胝质在质膜和细胞壁间胞间连丝大量沉积,对列当与向日葵维管束建立联系起到了阻止作用。Sira等[25]在抗病品种HE-39999中检测到胼胝质积累以及细胞壁加厚等现象,胼胝质沉积与POD和H2O2的活性有着紧密的联系[26]。在抗性互作过程中,ROS的解毒过程被强化,表明列当的侵染可能使向日葵体内发生氧化迸发[27],从而有利于向日葵抗性的建立。
采用qRT-PCR分析了7个基因的表达量。与清水对照组相比,施用诱抗剂使LOX(JA的响应基因)和ACCO1(ETH的响应基因)以及PAL(苯丙氨酸的响应基因)和PR1(SA的响应基因)表达量显著上调,表明施用‘锦苗标靶’后SA和JA信号路径均参与了诱导向日葵抗性的建立过程。而Sendon等[28]发现,SA和JA在诱导植物自身防御反应抵御病原物的过程中发挥着拮抗作用。但也有报道拟南芥在抵抗O.ramosa侵染时JA和ETH等合成路径被激活,且诱导lox1、lox2和pal1上调表达,但SA路径未被激活[29];而三叶草对O.minor的抗性反应是通过SA而非JA途径[30]。此外,也有研究表明,番茄与P.ramosa互作过程中,JA、SA以及ABA途径的相关基因表达量显著上升,这些防御激素协同参与调控寄主的防御反应[31];壳寡糖诱导拟南芥突变体植株中SA和JA途径相关基因的表达量较病菌侵染组均明显升高[32]。因此,ETH、JA和SA在调节寄主对胁迫响应过程中可能存在相互协同或者相互拮抗的作用。本研究中向日葵被寄生时,JA、SA和ETH路径的基因表达量均上调,这可能是列当在侵染向日葵的过程中引起寄主多种防御激素协同作用的结果。而向日葵抗性品种PHS1102在被列当寄生后,相对于其他抗性品种抗性机制被激活的较晚一些[33],本试验JK103的抗性基因相对表达量在检测时间内上调表达较低的原因可能与抗性激活时间较晚有关。
本研究从生理生化和结构抗性等方面探究了新型诱抗剂‘锦苗标靶’对不同向日葵品种的诱抗作用,同时,抵抗列当寄生是向日葵自身的动态防御过程,抗性机制非常的复杂。后续,还需对‘锦苗标靶’抑制向日葵列当寄生的田间高效施用体系进行进一步的完善和细化,通过细胞生物学和分子实验阐明‘锦苗标靶’诱导向日葵抗性建立的机制,绘制出其诱导向日葵抗性建立的信号图谱。
