茎用莴苣2个WRKYⅢ亚族转录因子基因的克隆与表达
2022-11-26吴庆莲伊文一焦体坤胡梦琪
杜 萍,吴庆莲,伊文一,焦体坤,胡梦琪,黄 莹
(临沂大学 农林科学学院,山东临沂 276000)
茎用莴苣(LactucasativaL.)是一年生或二年生菊科莴苣属草本植物,主要以肉质嫩茎作为蔬菜食用,其适应环境能力强,可在春秋两季或越冬栽培,是中国一种重要的经济作物[1]。莴苣肉质茎含有丰富的糖类、膳食纤维、铁、钾、磷、钙、钠、叶酸、维生素等营养成分,是人们日常饮食中必不可少的蔬菜作物之一[2]。目前对于莴苣的研究主要集中在叶用莴苣(生菜)上,对茎用莴苣生长发育以及响应逆境的研究较少,而这些因素会严重影响茎用莴苣的生长发育,进而影响茎用莴苣的产量和品质。
植物在整个生命周期中会遇到各种非生物和生物胁迫,这些胁迫可以影响植物的生长发育甚至改变植物物种的分布[3]。高等植物不能通过移动来逃避各种不利环境因素,因此为了抵抗逆境胁迫,植物采取了一系列复杂的响应机制[4]。许多胁迫相关基因包括转录因子可直接保护植物免受胁迫,或通过诱导/抑制下游靶基因进行调控[5]。WRKY转录因子是植物中一大类调控蛋白家族,含有由60个氨基酸组成的保守结构域,可结合各种胁迫相关基因启动子区域的W-box顺式元件(TTGACC/T),从而调节这些基因的表达,进而参与植物对各种胁迫的响应[6-8]。基于WRKY保守域的数量和锌指基序的结构,可将WRKY家族分为3个亚族Ⅰ、Ⅱ、Ⅲ,其中WRKYⅡ亚族可以进一步分为Ⅱa、Ⅱb、Ⅱc、Ⅱd和Ⅱe[9-10]。与WRKYⅠ和WRKYⅡ相比,WRKYⅢ亚族含有C2HC锌指结构(C-X7-C-X23-H-X1-C),同时在植物进化过程中,WRKYⅢ亚族被认为是3个亚族中适应性最强、最先进的亚族[11]。
研究表明,WRKY蛋白在生物胁迫(如害虫、病原感染)、非生物胁迫(如干旱、盐、低温、高温、活性氧等)、激素和生长发育调控中发挥重要作用[11-13]。目前已在多种植物中克隆得到了WRKY转录因子[14-18],如拟南芥(Arabidopsisthaliana)[14]、黄瓜(Cucumissativus)[15]、番茄(Solanumlycopersicum)[16]、西瓜(Cucumismelo)[17]、岷江百合(LiliumregaleWilson)[18]等。同样WRKYⅢ亚族转录因子也在多种植物中得到鉴定[19-21],如甘蔗(Saccharumofficinarum)[11]、棉花(Gossypiumhirsutum)[19]、兰花(Cymbidiumgoeringii)[20]、小麦(Triticumaestivum)[21]等,但茎用莴苣中的有关WRKYⅢ亚族转录因子的报道还很少。
本研究选取茎用莴苣品种‘永安红’为实验材料,克隆了2个WRKYⅢ亚族转录因子基因LsWRKY08和LsWRKY37,对其进行了较为详尽的生物信息学分析,包括氨基酸理化性质、疏水性/亲水性、进化树构建、序列比对等,还通过实时定量PCR技术(qRT-PCR)对2个基因在茎用莴苣不同组织、不同激素、不同非生物胁迫以及茎不同膨大时期的表达进行了研究,以初步分析WRKYⅢ亚族转录因子在茎用莴苣生长发育以及逆境胁迫中的作用,为提高茎用莴苣的抗性提供基础。
1 材料和方法
1.1 植物材料
将茎用莴苣品种‘永安红’种子种植于穴盘中,种植所用基质为泥炭(丹麦品氏托普pindstrup)和蛭石按1∶1(体积比,V/V)混合而成,放于人工气候室中(22 ℃/18 ℃各12 h)。在长至4片真叶后,分别进行低温(4 ℃)、高温(37 ℃)、盐(0.2 mol/L NaCl)、干旱(20% PEG6000)处理幼苗以模拟不同的非生物胁迫;分别用水杨酸(5 mmol/L SA)、脱落酸(75 μmol/L ABA)和赤霉素(50 μmol/L GA)进行喷施,对照组喷施蒸馏水;在处理0、12、24、48 h后,分别取以上处理的叶片样品冻于-80 ℃冰箱中,用于后续RNA的提取。取不同膨大时期(肉质茎直径长1、2、3和4 cm)的莴苣茎组织冻于-80 ℃冰箱,以分析LsWRKY08和LsWRKY37在茎不同膨大时期的表达模式。将以上不同处理的样品根据RNA simple Total RNA Kit试剂盒(北京天根公司)说明书分别提取总RNA,并用PrimeScript RT readent Kit(大连TaKaRa公司)将提取的总RNA反转录成cDNA,用于荧光定量PCR。
1.2 方 法
1.2.1 WRKYⅢ亚族转录因子基因的克隆及序列分析根据莴苣的基因组数据库和本实验室的转录组数据,得到2个茎用莴苣WRKYⅢ亚族转录因子基因LsWRKY08和LsWRKY37序列。基因克隆所用的特异性引物见表1。以茎用莴苣的cDNA为模板进行PCR特异性扩增,反应条件为94 ℃预变性5 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸20 s,共35个循环进行扩增,72 ℃延伸10 min。反应产物经1.2%琼脂糖凝胶电泳回收后,连接pMD19-T载体并转化到大肠杆菌DH5α,经PCR鉴定后送公司测序。

表1 所用引物
利用NCBI在线网站筛选同源性较高的其他物种的WRKY转录因子,并利用DNAMAN进行序列比对,利用MEGA 7.0构建系统发育树[22]。利用ExPASY网站(http://www.expasy.org)分析转录因子氨基酸组成成分及理化性质[23]。使用DNAMAN软件进行氨基酸亲水性与疏水性分析。使用STRING软件进行互作网络分析[24]。利用PlantCARE在线网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析启动子存在的顺式作用元件。
1.2.2 实时荧光定量PCR荧光定量PCR(qRT-PCR)采用SYBR PremixExTaq试剂盒(大连TaKaRa公司)和罗氏PCR仪Roche LightCycler 96按照操作说明进行。以茎用莴苣LsTIP41(Lsat_1_v5_gn_5_116421)基因为内参基因,用2-ΔΔCT法计算目的基因的相对表达量。用于qRT-PCR的基因特异性引物见表1。利用SPSS16.0进行数据的差异显著分析。
2 结果与分析
2.1 WRKYⅢ亚族转录因子基因的克隆及序列分析
以茎用莴苣‘永安红’品种的cDNA为模板进行克隆,得到2个约1 000 bp左右的特异性条带,大小与预期条带大小一致(图1)。序列比对显示,克隆得到的2个WRKYⅢ亚族的基因LsWRKY08和LsWRKY37分别包含945和930 bp的开放阅读框,分别编码314和309个氨基酸残基(图2)。利用DNAMAN软件对LsWRKY08和LsWRKY37进行亲水性和疏水性分析,结果发现,这2个转录因子均属于亲水性蛋白,其中LsWRKY08中第4位的天冬酰胺(Asn)以及LsWRKY37中第96位的赖氨酸(Lys)、97位的赖氨酸(Lys)、98位的精氨酸(Arg)亲水性最高(图3)。
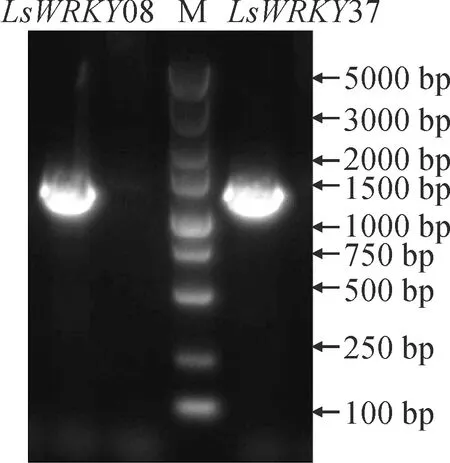
M. DL2000

*表示终止密码子

图3 LsWRKY08和LsWRKY37转录因子亲水性和疏水性分析
2.2 WRKYⅢ转录因子序列比对以及理化性质分析
利用NCBI网站对克隆得到的2个WRKYⅢ亚族转录因子进行保守结构域分析,结果表明,LsWRKY08和LsWRKY37转录因子均具有WRKY保守结构域(图4,A)。通过Blast同源检索发现,同属于菊科的刺菜蓟(Cynaracardunculus)、向日葵(Helianthusannuus)、除虫菊(Tanaceiumcinerariifolium)等与莴苣LsWRKY08和LsWRKY37转录因子的相似程度较高,序列比对表明,以上物种的WRKY转录因子均有一个由60个氨基酸组成的高度保守的WRKY结构域(图4,B)。

CcWRKY70. 刺菜蓟;HaWRKY. 向日葵;EcWRKY70. 加拿大飞蓬;MmWRKY. 薇甘菊;AaWRKY54. 青蒿;TcWRKY53.除虫菊;LsWRKY. 根柳状莴苣;EbWRKY. 熊胆草; SiWRKY53. 芝麻;VdWRKY. 常绿越橘; SsWRKY41. 一串红;图5同
利用ExPASY在线网站对上述植物的WRKYⅢ亚族转录因子进行理化性质分析,如表2所示,各个植物WRKYⅢ亚族转录因子的氨基酸残基数在287~356之间,理论等电点在5.30~6.63之间;相对分子质量在32.222~78.198 kD之间,其中LsWRKY08和LsWRKY37转录因子的相对分子质量较大,分别为78.198和77.303 kD。碱性氨基酸的比例稍高于酸性氨基酸的比例,除部分物种的WRKY转录因子外(常绿越橘、一串红),差异不突出,因此以上物种的WRKYⅢ亚族转录因子既有酸性蛋白又有碱性蛋白。脂肪族氨基酸所占比例明显高于芳香族氨基酸所占比例,蛋白质可溶性预测中主要平均疏水特性指数(GRAVY)在-0.469~-0.887之间。

表2 不同物种WRKYⅢ亚族转录因子氨基酸理化性质分析
2.3 WRKYⅢ亚族转录因子进化分析
为明确茎用莴苣LsWRKY08和LsWRKY37与其他物种的亲缘关系,对不同物种的WRKYⅢ亚族转录因子进行系统发育树分析,如图5所示,茎用莴苣LsWRKY08与同属于莴苣属的根柳状莴苣LsWRKY的亲缘关系最近,与同属于菊科的刺菜蓟CcWRKY70、向日葵HaWRKY、加拿大飞蓬EcWRKY70等的亲缘关系也比较近;同样茎用莴苣LsWRKY37与同属于菊科的除虫菊TcWRKY53、熊胆草EbWRKY的亲缘关系较近,而与唇形科的一串红SsWRKY41、杜鹃花科的常绿越橘VdWRKY、胡麻科的芝麻SiWRKY53等的亲缘关系较远。

图5 不同物种WRKYⅢ亚族转录因子系统进化树
2.4 WRKYⅢ亚族转录因子基因在莴苣不同组织及茎不同膨大期中的表达模式
qRT-PCR检测结果(图6)显示,LsWRKY08在叶中表达量最高,其表达量是根和茎中的6倍;LsWRKY37在根中表达量相对较高,在茎和叶中的表达量相对较低。

不同小写字母代表同一基因0.05水平差异显著性,图7同
对茎用莴苣茎不同膨大时期的转录组数据分析发现,LsWRKY08和LsWRKY37的表达量在茎膨大时期存在差异。利用qRT-PCR对LsWRKY08和LsWRKY37在茎不同膨大期中(1、2、3 和4 cm)的表达模式检测结果(图7)表明,LsWRKY08的表达量在茎直径为1 cm时最高,随着粗度的增加,茎中的表达量逐渐下降,而LsWRKY37的表达量在茎膨大过程中表达量增加,在粗度为3 cm时表达量达到最高水平,其表达量与1 cm相比,增加了近17倍。以上结果表明,LsWRKY08在茎用莴苣茎膨大过程中可能起着负调控的作用,而LsWRKY37在茎用莴苣茎膨大过程中可能发挥着正调控的作用。

图7 茎用莴苣2个WRKYⅢ亚族转录因子基因在茎膨大时期的表达模式
2.5 WRKYⅢ亚族转录因子基因在非生物胁迫中的表达模式
为初步探究WRKYⅢ亚族转录因子在非生物胁迫中的功能,利用qRT-PCR分析了LsWRKY08和LsWRKY37基因在不同胁迫中的表达水平。
结果(图8)表明:与对照相比,干旱处理过程中LsWRKY08基因表达呈波浪状变化。在干旱处理12 h后,LsWRKY08表达量是对照的3倍,处理24 h,表达水平降低;处理48 h表达水平是对照的9倍左右。干旱处理12和24 h,LsWRKY37基因表达与对照相比没有明显差异,48 h后,表达水平增加,其表达量是对照的近10倍。

不同小写字母代表同一时间不同处理0.05水平差异显著性,图9同
在NaCl处理12和48 h后LsWRKY08的表达水平与对照相比没有明显变化,而处理24 h表达水平是对照的6倍。LsWRKY37在NaCl处理24和48 h后的表达水平与对照相比明显降低。
与对照相比,高温处理不同时间段的LsWRKY08基因的表达水平均明显增加,高温处理12、24和48 h后表达量均是对照的8倍。与对照相比,LsWRKY37基因的表达水平在24 h达到最高,而在处理的其他时间段,其表达水平与对照相比均降低。
与对照相比,4 ℃低温处理12 h后,LsWRKY08和LsWRKY37的表达量均增加,其表达量分别是对照的7倍和8倍。随后,LsWRKY37的表达水平逐渐降低,但均高于对照;LsWRKY08的表达水平在不同处理时间段均比对照组要高。
2.6 WRKYⅢ亚族转录因子基因在不同激素处理下的表达模式
本研究分析了2个茎用莴苣WRKYⅢ转录因子基因LsWRKY08和LsWRKY37在SA、ABA、GA处理下的表达模式。如图9所示,LsWRKY08基因在GA和SA处理不同时间段的表达量均比对照高;对于ABA处理,该基因的表达水平在处理12和48 h后比对照组增加,而处理24 h后表达量比对照要低。LsWRKY37基因在GA和ABA处理24 h表达量与对照相比明显下降;而在SA处理24和48 h后表达量均比对照组要高。

图9 WRKYⅢ转录因子基因在不同激素处理下的表达模式
2.7 WRKYⅢ转录因子的互作网络分析
以模式植物拟南芥为参考,利用STRING在线网站分析了莴苣2个WRKYⅢ转录因子LsWRKY08和LsWRKY37的互作网络,以期探究其可能存在的调控机制。如图10所示,WRKY70(LsWRKY08)和WRKY41(LsWRKY37)与多个蛋白存在着相互作用。LsWRKY08与植物防御相关蛋白PDF1.2、NPR1,NIMIN蛋白(NIMIN1、NIMIN2),钙调素结合蛋白SARD1,Sigma因子结合蛋白SIB1存在互作; LsWRKY08还与其他转录因子存在着相互作用,如WRKY转录因子(WRKY33、WRKY40、WRKY51、WRKY54),bZIP(AHBP-1B)。LsWRKY37与WRKY40、WRKY51等转录因子存在着相互作用。

图10 WRKYⅢ转录因子的互作网络分析
2.8 WRKYⅢ亚族转录因子启动子分析
为探究莴苣WRKYⅢ亚族转录因子基因LsWRKY08和LsWRKY37可能参与的调控网络,本研究利用PlantCARE网站分析了这2个转录因子起始密码子ATG上游2 000 bp的启动子序列。如图11所示,鉴定到多个与逆境胁迫、激素响应以及生长发育相关的顺式作用元件。LsWRKY08启动子中含有多个与植物激素相关的顺式作用元件,如生长素、MeJA、ABA、SA等;除此之外,多个MYB、ERE转录因子结合位点以及与植物生长发育相关的顺式作用元件,比如胚乳发育存在于LsWRKY08启动子中。LsWRKY37启动子含有多个转录因子结合位点(MYB转录因子结合位点、MYC结合位点、ERE结合位点),激素响应元件(ABA、SA、MeJA)以及W-box元件。

图11 WRKYⅢ亚族转录因子LsWRKY08和LsWRKY37启动子顺式作用元件分析
3 讨 论
WRKY转录因子是植物中一个庞大的调控蛋白家族。目前,越来越多的证据表明WRKYⅢ蛋白调控盐、干旱、高温、低温等多种非生物胁迫反应。例如,在拟南芥中过表达ZmWRKY33可诱导RD29的表达从而增强转基因植物的耐盐性[25]。小麦TaWRKY75-A基因可通过参与JA信号途径及其他代谢途径增强对干旱及盐胁迫的抗性[9]。同时,小麦TaWRKYⅢ-A37基因可被PEG、H2O2和ABA胁迫显著诱导[21]。玉米WRKY40在水稻中的异源表达增强了转基因植株的抗旱性[26]。WRKY转录因子不仅参与生物和非生物胁迫过程中的调控,在激素调控过程中也发挥着不可替代的作用。有研究显示,WRKY转录因子在ABA信号转导途径中可发挥激活或抑制的作用。AtWRKY39能够参与SA和JA信号的激活过程,从而参与高温胁迫[27]。因此,WRKY在激素信号转导途径中以及各种非生物胁迫条件下发挥着多重调节的作用。本研究分析了LsWRKY08和LsWRKY37基因在不同非生物胁迫、不同激素、不同植物组织以及莴苣茎不同膨大时期的表达模式。结果表明,LsWRKY08和LsWRKY37能响应不同非生物胁迫以及激素处理,但2个基因之间表达模式存在差异。由此可见,同一亚族的转录因子基因功能可能存在差异,但其对于不同非生物胁迫的具体作用机制有待进一步研究。
研究表明,WRKY转录因子存在着自我调节和交叉调节。WRKY转录因子可通过结合下游靶基因启动子区的W-box元件调控基因表达。例如GhWRKY34可通过调节SOS1和SOS2基因的表达从而增强转基因植株抵抗盐胁迫的能力,AtSOS2和AtABF4的启动子区域分别含有4个W-box顺式元件和1个W-box顺式元件,因此GhWRKY34可能与AtSOS2和AtABF4启动子中的W-box顺式元件结合来响应盐胁迫[28]。高粱SbWRKY50同样通过直接结合SOS1和HKT1的启动子参与盐胁迫[29]。本研究鉴定了茎用莴苣中2个WRKYⅢ基因LsWRKY08和LsWRKY37启动子区的顺式作用元件,其中LsWRKY37启动子含有W-box元件,表明LsWRKY37可能与其他WRKY转录因子之间存在自我调节和交叉调节。
WRKY转录因子还可以通过与其他蛋白相互作用来调节各种生物学过程。作为植物特异转录调节因子,VQ蛋白(含有VQ基序FxxhVQxhTG)可通过与WRKY蛋白相互作用从而参与植物-生长发育或植物-逆境响应。在响应灰霉病菌侵染过程中,VQ蛋白SIB1、SIB2可作为WRKY33的转录激活剂[30]。VQ9蛋白可与WRKY8互作来调控植物响应盐胁迫过程[31]。本研究发现,LsWRKY08和LsWRKY37可与植物防御相关蛋白以及其他转录因子存在互作,以上结果表明LsWRKY08和LsWRKY37转录因子可能通过参与不同的激素信号途径,或者与其他蛋白相互作用以及转录因子之间的自我调节和交叉调节来等途径来响应非生物胁迫,但是具体的调控机制仍需进一步研究。
综上所述,茎用莴苣2个WRKYⅢ亚族转录因子LsWRKY08和LsWRKY37在各种非生物胁迫,植物激素处理以及茎膨大过程中可能发挥着作用,而且不同转录因子之间的调控作用机制是复杂的而且存在差异的,因此对莴苣生长发育或逆境调控的作用机制也是不同的。本研究也为茎用莴苣抗逆基因的挖掘和品种改良等方面提供了重要的参考依据。
