妊娠期糖尿病不同胰岛素抵抗下的血脂特征
2022-11-26王景欣
王景欣,米 阳
(1.陕西中医药大学,陕西 咸阳 712000;2.西北妇女儿童医院产二科,陕西 西安 710061)
妊娠期糖尿病(gestational diabetes mellitus,GDM)定义为妊娠期间诊断的糖尿病,但并不是显性的,其特点是妊娠前糖代谢正常而妊娠期才出现异常糖代谢[1]。GDM患病率呈逐年增长趋势,2020年对中国GDM患病率进行的荟萃分析显示其高达14.8%,可造成许多不良妊娠结局[2]。胰岛素抵抗(insulin resistance,IR)被认为是胰岛素受体激活通道下游缺陷所致[3],胰岛素在机体内不能有效促进周围组织摄取葡萄糖及抑制肝糖原分解和糖异生等过程,从而造成高血糖状态[4]。长久以来,GDM妇女的血脂问题已经被许多学者研究,热点多为孕期血脂变化及与糖耐量试验正常妇女血脂的比较,很少将血脂与胰岛素抵抗联系。目前国际上对于GDM的异质性研究成为主流,为精确医学提供了一种可能。本研究选择使用稳态模型2(homeostasis model assessment,HOMA2)计算胰岛素敏感指数(insulin sensitivity index,ISI)作为IR的参数,并根据ISI将GDM分为两种不同的亚型,探讨基于此模型不同胰岛素抵抗的GDM患者早、中、晚期的血脂特征。
1 资料与方法
1.1 研究对象
本研究为回顾性分析,收集2020年1月1日至2020年12月31日于西北妇女儿童医院产科收治的住院患者相关资料。研究共纳入GDM患者84例和糖耐量试验正常者100例,分别记为GDM组和正常妊娠组。纳入标准:①GDM诊断采用美国糖尿病协会标准,妊娠24~28周期间进行75g口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),达到或超过以下任意一个数值后定义为妊娠期糖尿病:空腹血糖≥5.1mmol/L;餐后1h血糖≥10.0mmol/L;餐后2h血糖≥8.5mmol/L[5-7];②有早、中、晚期血脂及OGTT结果;③单胎妊娠,怀孕至36周以后,有完整的医疗记录和明确的孕周[8]。④参加本院GDM一日教育门诊,进行运动和饮食控制。排除标准:①合并甲状腺疾病、高脂血症、糖尿病、肝功能异常、心血管疾病、肾脏疾病等;②孕前体质量指数(body mass index,BMI)≥24kg/m2;③合并妊娠期高血压、子痫、妊娠期肝内胆汁郁积症、前置胎盘等产科疾病。排除上述因素以消除其对脂质代谢的影响[7,9]。
1.2 研究方法
1.2.1 血脂、空腹胰岛素、空腹血清C肽的采集
受试者禁食≥8小时,检测总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL)。血脂采集时间:孕早期≤14周,孕中期为24~32周,孕晚期≥32周。于妊娠24~28周期间,隔夜禁食12小时后,口服75g葡萄糖,检测空腹血糖(fasting blood glucose,FBG)、空腹血清C肽、空腹血清胰岛素(fasting serum lisulin,FINS)等指标。
1.2.2 胰岛素敏感指数的计算
IR不能错误理解为病理状态,正常人在机体能量过剩等状况下也可出现。妊娠会伴随着进行性IR,从妊娠中期直到妊娠晚期,IR的程度接近于2型糖尿病的IR程度[10]。在妊娠过程中,IR可以通过胰岛素分泌增加来改善,故绝大部分孕妇的糖耐量结果仍然正常,但一些孕妇分泌的胰岛素不足以弥补胰岛素抵抗而导致GDM[11]。目前评价ISI的方法主要有胰岛素葡萄糖钳夹技术、胰岛素抑制实验、稳态模型评估、定量胰岛素敏感性检测、李光伟指数、口服葡萄糖胰岛素敏感指数。胰岛素葡萄糖钳夹技术是评价胰岛功能的金标准,但胰岛素葡萄糖钳夹技术、胰岛素抑制实验、示踪剂检测等方法存在检测费用昂贵、抽血量多、病人难以配合等问题。综合考虑以上原因,本研究选择使用HOMA2来计算ISI指数[12-13]。1998年Matthews等人将HOMA模型与基于MS-DOS的计算机程式结合称为HOMA2,HOMA2已可用计算机软件迅速算出,该软件由牛津大学糖尿病试验中心提供,可到www.OCDEM.ox.ac.uk网址免费下载。
1.3 统计学方法

2 结果
2.1 三组孕妇基本妊娠特征的比较
为对GDM患者进一步分组,我们使用HOMA2模型计算了397例正常妊娠妇女的ISI,范围为4.90%~24.80%。以第25百分位数(8.20%)为临界值,将84例GDM患者分为两组:低于8.20%为胰岛素敏感缺陷组(n=32),高于8.20%则为胰岛素敏感组(n=52)。三组孕妇在孕前BMI、FBG、餐后1h血糖、餐后2h血糖、空腹血清C肽、FINS、HOMA2 %B、HOMA2 %S、HOMA2 IR基本妊娠特征间的差异有统计学意义(F/H值分别为7.758、66.169、56.862、39.636、62.065、43.466、47.494、64.869和64.869,P<0.05),见表1。

表1 三组孕妇基本妊娠特征的比较Table 1 Comparison of basic characteristics among three
2.2 三组孕妇妊娠早、中、晚期血脂指标的比较
三组孕妇妊娠早、中、晚期TG水平的差异均有统计学意义(H值分别为21.580、13.287和10.914,P<0.05),其中胰岛素敏感缺陷组的TG水平在三个时期均高于胰岛素敏感组和正常妊娠组。三组孕妇在妊娠中、晚期的LDL-C水平差异有统计学意义(H值分别为11.700和12.000,P<0.05),其中胰岛素敏感缺陷组的LDL-C水平在妊娠中期低于正常妊娠组,在妊娠晚期低于胰岛素敏感组和正常妊娠组。三组孕妇妊娠早、中、晚期TC水平(H值分别为1.027、5.667和5.323,P>0.05)和HDL-C水平(H值分别为2.957、0.731和3.820,P>0.05)的差异均无统计学意义,详见表2和图1。

表2 三组孕妇妊娠早、中、晚期血脂指标比较[mmol/L,M(Q1,Q3)]Table 2 Comparison of serum lipid indexes in the first,second and third trimester of pregnancy among three groups[mmol/L,M(Q1,Q3)]

指标GDM胰岛素敏感缺陷组(n=32)GDM胰岛素敏感组(n=52)正常妊娠组(n=100)HP HDL-C1.53(1.40,1.68)1.65(1.40,1.92)1.62(1.48,1.86)2.9570.228 LDL-C2.37(2.08,2.79)2.36(2.11,2.59)2.30(1.93,2.68)1.4910.474妊娠中期 TC5.30(4.63,6.19)5.53(5.11,6.00)5.77(5.19,6.52)5.6670.059 TG2.81(2.38,3.09)2.31(1.85,2.68)∗∗2.26(1.77,2.87)∗∗13.2870.001 HDL-C1.83(1.65,1.99)1.86(1.66,2.12)1.89(1.64,2.18)0.7310.694 LDL-C2.73(2.15,3.14)2.87(2.61,3.42)3.19(2.70,3.81)∗∗11.7000.003妊娠晚期 TC5.69(4.61,6.62)6.09(5.22,6.66)6.16(5.48,6.89)5.3230.070 TG3.82(3.17,5.12)3.06(2.48,3.64)∗3.14(2.42,3.71)∗∗10.9140.004 HDL-C1.71(1.50,2.00)1.88(1.58,2.10)1.86(1.63,2.17)3.8200.148 LDL-C2.74(2.05,3.25)3.27(2.72,3.66)∗3.29(2.77,3.67)∗12.0000.002
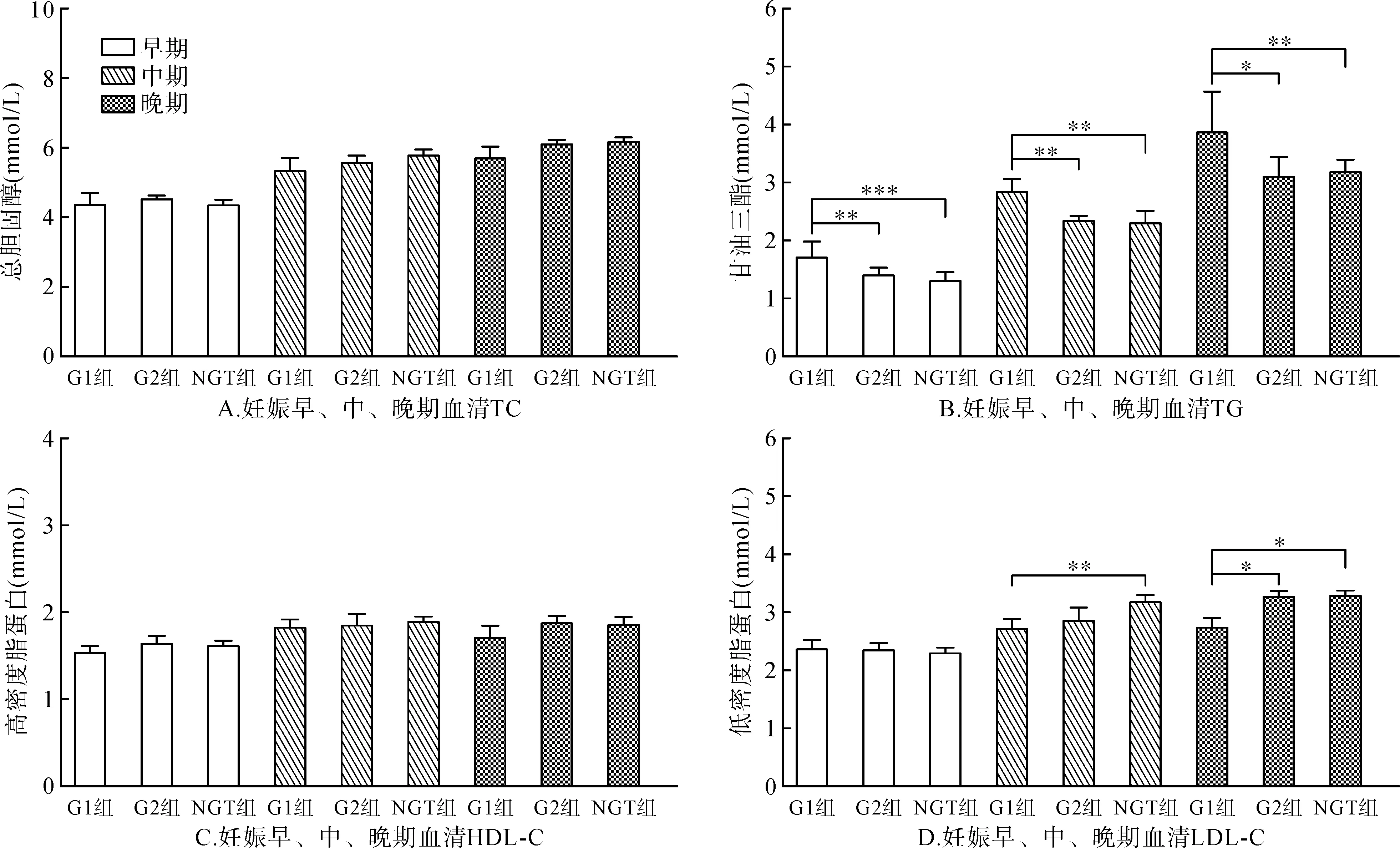
注:G1组:胰岛素敏感缺陷组,G2组:胰岛素敏感组,NGT组:正常妊娠组;与GDM胰岛素敏感缺陷组比较,*P<0.05,**P<0.01,***P<0.001图1 三组孕妇妊娠早、中、晚期的血脂指标水平Fig.1 Serum lipid index levels in the first,second and third trimester of pregnancy in three groups
3 讨论
3.1 不同胰岛素抵抗下GDM患者的血脂不同
肝脏、肌肉及脂肪组织等作为胰岛素调节血糖重要的靶器官,其敏感性低于正常水平时可造成胰岛素抵抗[14]。胰岛素抵抗是GDM发病原因之一,本研究入组GDM患者中胰岛素敏感缺陷者占38.1%,胰岛素敏感者占61.9%;比较各组孕妇的血脂水平发现,GDM组与正常妊娠孕妇的血脂存在显著性差异,而不同胰岛素敏感性的GDM患者血脂谱也存在差异;其中胰岛素抵抗最严重的敏感缺陷组与另两组的血脂差异最为明显,其TG较高而LDL较低;三组孕妇TC和HDL-C水平无明显差异。Ryckman等[15]对GDM患者血脂进行荟萃分析发现,与正常妊娠妇女相比,GDM组的TG在妊娠早、中、晚期升高,HDL在妊娠中、晚期显著降低,而LDL和TC未观察到异常。Cibickova等[16]和Chen等[17]的研究显示,在妊娠晚期,GDM妇女TG较高,LDL浓度低于糖耐量正常的妇女组,但两组的TC和HDL水平相似,与本研究结果较一致。IR可导致抑制脂肪分解功能受损,参与糖脂代谢等关键酶的活性降低[18],游离脂肪酸(free fatty acid,FFA)进入循环的量增加,增加的FFA可进一步减弱胰岛素信号,从而进一步加重胰岛素抵抗[19]。FFA增加还可导致肝脏的脂肪酸供应增加,刺激TG的合成。IR可降低脂蛋白脂肪酶活性,也在一定程度上引起TG的升高[20]。
3.2 不同胰岛素抵抗下GDM患者的妊娠特征不同
有多篇论文指出,较高的胰岛素抵抗和剖宫产率增加、早产、新生儿体重、孕前体重指数高度相关[21-22]。本研究显示,三组孕妇在孕前BMI、FBG、餐后1h血糖、餐后2h血糖、空腹血清C肽、FINS、HOMA2 %B、HOMA2 %S、HOMA2 IR间存在差异,而分娩孕周、新生儿出生体重、母体孕期体重增加方面无显著性差异。本研究发现,GDM敏感缺陷组孕前BMI高于正常妊娠组,Shao等人[7]的研究表明孕前BMI与GDM风险呈正相关。孕前BMI较高的病人在怀孕后更应该控制饮食,遵从医生的饮食与运动指导,对其健康进行严密的监测[5]。本研究中胰岛素敏感缺陷组的空腹血清C肽、FINS高于其他两组,表明胰岛素抵抗严重的GDM有更不利的代谢特征。
3.3 研究的优点与局限性
本研究优点是评价入组病人的ISI时使用HOMA2模型计算,并根据正常妊娠妇女的ISI第25百分位数为临界值将GDM病人分为两个亚组进行探讨。HOMA2在HOMA1的基础上更多考虑到了当血糖>10mmol/L时胰岛素分泌并非呈线性增加等综合因素,使计算出的指数更接近于使用高胰岛素—正葡萄糖钳夹技术测得的ISI指数。但本研究也有一定局限性,入组样本量较少,且研究对象主要集中在西安地区,缺乏代表性。
综上所述,不同胰岛素敏感性的GDM患者血脂水平存在差异,胰岛素敏感缺陷者的TG较高而LDL较低。IR与血脂异常关系密切,但二者之间的影响机制及因果关系尚不清楚;持续存在的IR是否为GDM患者发展为2型糖尿病的机制之一,尚待进一步研究。
