血浆置换+双重血浆分子吸附系统联合夜间营养干预在老年肝衰竭病人中的疗效观察
2022-11-26朱正云杨柳青张婷婷刘丹凤张岚许凤琴
朱正云 杨柳青 张婷婷 刘丹凤 张岚 许凤琴
肝衰竭是多种因素引起的严重肝脏损害,导致合成、解毒、代谢和生物转化功能严重障碍或失代偿,出现以黄疸、凝血功能障碍、肝肾综合征、肝性脑病、腹水等为主要表现的一组临床症候群[1]。肝衰竭病人病情进展迅速,死亡率极高,治疗方法包括内科综合治疗、非生物型人工肝支持治疗以及肝移植,其中人工肝技术是目前治疗肝衰竭的常用方法[2]。血浆置换术(plasma exchange,PE)、双重血浆分子吸附技术(double plasma molecular adsorption system,DPMAS)是人工肝支持治疗中的重要方式,近年来逐渐成为治疗肝功能衰竭的重要手段[3-4]。此外,老年肝衰竭病人肝细胞合成能力不足,肝糖原储备严重下降,再加上病人食纳差等因素,老年肝衰竭病人夜间极易进入一种“饥饿状态”,出现低血糖的概率比年轻人更高,易诱发营养不良,加重病人肝功能衰竭,增加其死亡率[5]。本研究对老年肝衰竭病人采用PE+DPMAS治疗并联合夜间营养干预,可有效改善肝功能、凝血指标及营养状况,减轻老年肝衰竭病人临床主要症状群,降低并发症的发生风险,现报道如下。
1 对象与方法
1.1 研究对象 选择2019年6月至2021年11月连云港市第一人民医院收治的72例老年肝衰竭病人为研究对象,其中男44例,女28例,年龄65~85岁,平均(68.76±4.91)岁。纳入标准:(1)年龄≥65岁;(2)诊断符合《肝衰竭诊治指南(2018年版)》中肝衰竭的诊断标准[1]。排除标准:(1)活动性消化道出血、弥散性血管内凝血(DIC)及其他有显著出血倾向,如血小板极度降低者(PLT<20 ×109/L);(2)严重全身及局部感染;(3)严重心血管疾病,如冠心病、脑血管病;(4)各种原因引起的休克未纠正;(5)其他各种原因无法配合治疗。本研究已经连云港市第一人民医院医学伦理委员会论证通过(LW20220414002-01)。所有病人及家属均知情并签署知情同意书。按照随机数字表将病人分为对照组和观察组,每组各36 例,2 组病人的年龄、性别、既往病史、肝衰竭分期等基线资料差异均无统计学意义(P>0.05),具有可比性。见表1。

表1 2组一般资料比较
1.2 方法 所有病人入院后给予内科综合治疗,同时采用PE+DPMAS治疗。人工肝治疗使用健帆DX-10血液净化机和血液灌流器(型号:HA330-Ⅱ),日本进口PE-08膜型血浆分离器,博新生物科技有限公司胆红素吸附器(型号DX350)。深静脉置管使用双腔导管(导管长 20 cm,直径 11 F)于股静脉处进行穿刺置管。操作前或者操作中选用低分子肝素钠或普通肝素抗凝。治疗模式:DPMAS,血液流速为120~140 mL/min,血浆分离速度为35~42 mL/min,总治疗时间为2~3 h;在DPMAS治疗结束后,继续使用同一套膜型血浆成分分离器进行PE治疗,切换为PE治疗模式,开始治疗前及治疗结束前30 min静脉推注葡萄糖酸钙注射液1 g(溶媒选用10%葡萄糖20 mL),静脉滴注地塞米松5 mg(溶媒选用0.9%氯化钠100 mL),2种药物的作用为预防过敏,血流速度为100~120 mL/min,血浆分离速度为32~40 mL/min,置换血浆量为1800~2000 mL,总治疗时间为5~6 h。治疗时间间隔为2~4 d;治疗频次为3~6次,2组病人治疗频次中位数均为3次,治疗间隔天数中位数均为2 d,总干预时间约为1个月。在病人饮食营养方面,对照组采用常规日间营养支持,观察组在对照组基础上进行夜间加餐营养干预,具体过程如下:(1)进行营养宣教,利用移动电脑播放宣教视频进行面对面教育,每周1~2次。(2)专职营养师根据病人营养评估结果并结合《2018 ESPEN重症临床营养指南解读》开立夜间营养处方[6]。(3)医院营养作坊负责营养餐配送,责任护士做好病人饮食情况观察记录。夜间加餐食物包含能量约250 kcal,包括碳水化合物50 g、蛋白质6.5 g、脂肪7.5 g和各种维生素及矿物质等,加餐时间为21:00~22:00或睡前30 min。
1.3 评价指标 Child-Pugh评分:用于对肝硬化病人肝脏储备功能进行量化评估。营养风险筛查(nutrition risk screening,NRS-2002)评分:NRS-2002评分≥3分为病人有营养风险[7]。血液营养指标:包括血清白蛋白、前清蛋白、转铁蛋白水平。
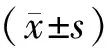
2 结果
2.1 干预前后NRS-2002评分、Child-Pugh评分比较 观察组在干预过程中NRS-2002评分、Child-Pugh评分逐渐下降(P<0.05),干预1个月后观察组NRS-2002评分、Child-Pugh评分较对照组显著下降(P<0.05)。见表2。

表2 2组干预前后NRS-2002评分、Child-Pugh评分比较分,n=36)
2.2 干预前后血液营养指标比较 观察组在干预过程中血清白蛋白、前清蛋白、转铁蛋白水平逐渐升高(P<0.05),干预1个月后观察组血清白蛋白、前清蛋白、转铁蛋白评分较对照组显著升高(P<0.05)。见表3。
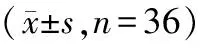
表3 2组干预前后血液营养指标比较
2.3 干预过程中并发症发生情况比较 观察组在干预过程中低血糖、低血压等并发症的合计发生率较对照组显著下降(P<0.05),见表4。
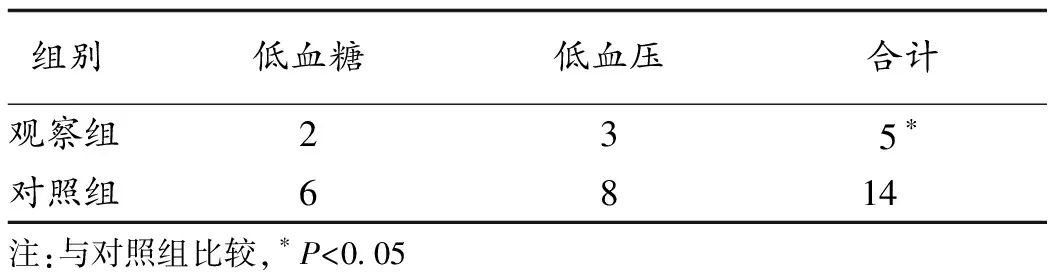
表4 2组病人并发症发生情况比较(n, n=36)
3 讨论
肝衰竭是威胁到病人生命的重要疾病,给家庭以及社会带来沉重的负担。老年病人器官老化、合并症多且免疫功能低下,患病后死亡率更高。制定合理的治疗方案对老年肝衰竭病人至关重要。PE+DPMAS干预能够明显改善肝衰竭病人肝脏储备功能,以提高病人生存率。HA330-Ⅱ血液灌流器吸附大分子颗粒毒素,如炎性介质、TNF-α、IL-6、血氨等;DX350胆红素吸附器主要吸附胆红素、胆汁酸及内毒素[8]。两种吸附柱组合应用双管齐下,能够迅速改善黄疸症状,清除体内炎症介质等有害物质,达到标本兼治的效果。PE能够直接将血浆中的病毒和毒物进行清除,同时用新鲜血浆进行补充,为机体提供了因肝脏功能障碍而合成不足的血浆蛋白、凝血因子、调理素等生物活性物质。PE、DPMAS联合应用,既能提高体内毒素清除疗效,又能改善凝血及血浆蛋白指标,且操作难度及耗材费用均不会增加,效果加倍,不良反应显著减少,为肝细胞修复和再生提供良好的环境。
本研究结果显示,观察组病人NRS-2002评分在干预后明显低于干预前(P<0.05),表明夜间营养干预可降低老年肝衰竭病人机体营养不良风险。肝脏是蛋白质、脂肪、碳水化合物三大营养物质的代谢场所,营养不良是老年肝衰竭病人不良预后的独立危险因素[9]。老年肝衰竭病人肝细胞吸收合成营养物质的能力下降,加上疾病本身引起的腹胀、恶心、呕吐等消化道症状,病人对营养物质的摄入及吸收均明显不足。早期对老年肝衰竭病人进行营养风险评估和个体化干预,已逐渐成为改善老年肝衰竭病人预后的重要治疗手段之一[5]。此外,肝衰竭病人过夜禁食后体内葡萄糖氧化率显著下降,而蛋白质和脂肪分解代谢增强,导致晚餐与早餐之间的夜间处于一种“饥饿状态”,营养不良风险较高,欧洲临床营养与代谢学会(ESPEN)指南推荐对肝病病人进行夜间加餐和少量多餐的饮食摄入模式[10]。老年肝衰竭病人夜间加餐,可提供夜间机体所需能量,减少夜间空腹时体内蛋白质和脂肪的分解,降低机体营养代谢风险。
老年肝衰竭病人普遍存在营养不良,常以蛋白性营养不良为主[11]。本研究主要观察营养干预前后蛋白水平的改变,结果显示,干预后观察组血清白蛋白、前清蛋白、转铁蛋白水平均较干预前明显改善(P<0.05)。白蛋白和前清蛋白均由肝脏合成,其水平升高反映肝脏合成能力的提升。转铁蛋白是肝脏蛋白营养状态的敏感指标,转铁蛋白上升是营养膳食治疗是否有效的判断指标之一。由此可见,PE+DPMAS联合夜间营养干预能够明显改善病人的肝功能和营养状况。此外,老年肝衰竭病人由于肝脏合成糖原功能障碍,在夜间禁食时间段极易出现低血糖症状。疾病引起的贫血、腹水及利尿剂的使用等可致有效循环血量不足,病人在行PE+DPMAS治疗初始引血阶段因体外循环容积较大[12],极易发生低血压。由表4可见,夜间营养干预可减少老年病人夜间白蛋白氧化分解,补给肝功能衰竭本身增加的能量消耗,提高机体对人工肝治疗引血阶段暂时性循环血量下降以及夜间糖原储备不足的代偿能力。
综上所述,老年肝衰竭病人应尽早实施个体化营养支持干预,把握治疗时机,并选择合适的人工肝治疗模式。在实施人工肝治疗过程中更要关注营养不良风险,及时评估营养状况,加强营养支持,提高老年肝衰竭病人人工肝治疗的成功率及总体治愈率。
