大豆球蛋白G5A3亚基加工破坏表位的初步定位
2022-11-24王一超陈慧彬李英英段宇莹孙富宇
王一超, 席 俊, 陈慧彬, 李英英, 段宇莹, 孙富宇
(河南工业大学粮油食品学院,郑州 450001)
随着生活水平的不断提高,人们对食品安全也更加重视,其中食物过敏现象颇受关注,大豆是主要食物过敏原之一,在全球过敏人口中大约有25%的患者对大豆过敏[1-3]。大豆过敏是由过敏原蛋白引起的异常的免疫反应,且其免疫原性与蛋白结构有一定关系[4,5],研究表明当抗原分子高级结构的复杂度增加,其致敏性随之增强,结构丢失和隐藏的表位也可能产生类似的影响[6]。因抗原的致敏性与其结构特征紧密关联,所以当前食品工业中常用的过敏原脱敏方法有超高压法,热处理,化学法及酶解法[7-10],同时,也有研究从遗传育种角度,借助基因工程的方法从根本上解决植物蛋白的致敏性问题[11]。
大豆球蛋白是从大豆中获取的被分隔储存的蛋白质[12-14],占11S组分的85%,所以又称为11S球蛋白,是重要的致敏原,分子质量约为350 ku,每个大豆球蛋白有6个亚基,每个亚基由酸性肽链(35~37 ku)和碱性肽链(20 ku)通过二硫键连接而成[15]。抗原表位是蛋白质抗原性的依据,目前可以采用定位并破坏抗原表位的方法来降低大豆致敏性[16,17],常用的抗原表位预测技术和抗原表位定位技术均采用信息学软件进行分析,其中,T7噬菌体展示系统[18]能够表达不同分子质量的蛋白质,稳定性高,复制周期短,能够感染大肠杆菌并形成噬菌体斑块[19],利用噬菌体表达蛋白并进行纯化,通过硫酸铵纯化的抗体[20]鉴定表达蛋白的抗原表性。本研究团队通过噬菌体表达蛋白和ELISA法确定β-conglycinin的α亚基抗原性最高的氨基酸序列,分别为380EGQ-SKR408、404ALS-EKN448[21];皮江一[22]通过将外源基因与噬菌体载体连接,在噬菌体中表达外源蛋白质并通过鉴定,定位到β-conglycinin的β亚基的致敏性氨基酸序列为378DNV-AQD400。实验室已成功预测大豆球蛋白G5亚基中酸性A3亚基的抗原表位,并成功将A3亚基的3个重叠分段的基因载体克隆完成并保存。
本实验通过完成A3亚基全长的载体克隆,并通过T7噬菌体展示技术表达A3亚基及其3个片段的蛋白[23],用间接竞争ELISA法检测目的蛋白破坏抗原表位,为后续精确定位G5亚基中A3酸性肽链的致敏表位的进一步研究提供参考。
1 材料与方法
1.1 实验材料
质粒提取试剂盒;DNA回收试剂盒;A3亚基以及3个重叠分段片段 A, B, C 的上下游引物;E. coli JM109 Competent Cells; pMDTM 18-T vector Cloning Kit;DNA Marker; Ribonuclease A;Recombinant DNase Ⅰ;T4 DNA Ligase;QuickCutTMEcoRⅠ;QuickCutTMHind Ⅲ;EX TaqTMVersion 2.0;噬菌体试剂盒。
1.2 仪器与设备
nexus GSX1 PCR仪,Tanon-2500凝胶成像系统,D3024R离心机。
1.3 实验方法
1.3.1 大豆球蛋白A3亚基氨基酸序列
通过NCBI数据库检索大豆球蛋白A3亚基的氨基酸序列:
ITSSKFNECQLNNLNALEPDHRVESEGGLIETWN- SQHPELQCAGVTVSKRTLNRNGLHLPSYSPYPQMIIV- VQGKGAIGFAFPGCPETFEKPQQQSSRRGSRSQQQLQ- DSHQKIRHFNEGDVLVIPPGVPYWTYNTGDEPVVAIS- LLDTSNFNNQLDQNPRVFYLAGNPDIEHPETMQQQQ- QQKSHGGRKQGQHQQQEEEGGSVLSGFSKHFLAQSF- NTNEDTAEKLRSPDDERKQIVTVEGGLSVISPKWQEQ- EDEDEDEDEEYEQTPSYPPRRPSHGKHEDDEDEDEE- EDQPRPDHPPQRPSRPEQQEPRGRGCQTRN。
1.3.2 大豆球蛋白A3亚基抗原表位的预测
采用DNAstar,SOPMA,DiscoTope 2.0等预测11S球蛋白G5亚基中酸性A3亚基的B细胞抗原表位。
1.3.3 A3亚基的重叠分段及引物设计
根据预测出的抗原表位,在不打断抗原表位的情况下将A3亚基进行重叠式分段,每一段序列与前段序列重叠的氨基酸残基数目为60个,使用Primer Premier 5软件检测模板中不含有 EcoR Ⅰ和 Hind Ⅲ位点,设计引物结构为5′-保护碱基-酶切位点-引物序列-3′,上游引物的限制性内切酶为EcoR Ⅰ,下游的限制性内切酶为Hind Ⅲ。
1.3.4 A3亚基的PCR扩增及其克隆载体的构建
A3亚基的3段分段基因的载体构建以由实验室完成并保存,现只需做全长基因的扩增及其克隆载体的构建。
1.3.4.1 A3亚基全长的基因扩增
根据大豆球蛋白A3亚基全长的碱基序列,用PCR扩增目的基因。
PCR反应程序:94 ℃预变性5 min;94 ℃变性60 s,57 ℃退火60 s,72 ℃延伸90 s,变性、退火和延伸这3个条件循环34次;72 ℃再延伸10 min;4 ℃保存,用2%的琼脂糖电泳检测PCR基因产物。

表1 PCR反应体系
1.3.4.2 A3基因的回收
用DNA回收试剂盒将基因收回并保存于-20 ℃备用,具体参照试剂盒的操作步骤。
1.3.4.3 连接与转化
连接体系(10 μL):pMDTM-18T 载体:1 μL,DNA:4 μL,Ligation buffer:5 μL,将此体系置于16 ℃恒温箱连接过夜。
转化:将10 μL连接产物与25 μL感受态细胞混匀,冰浴30 min,42 ℃水浴90 s,置于冰上冷却5 min后加入500 μL SOC Medium混匀,于37 ℃震荡培养1 h。将培养液在4 000 r/min下离心4 min,吸取 400 μL上清液弃之,将剩余溶液吹打混匀涂布于含Amp+(50 μg/mL)、IPTG(50 mg/mL)和X-gal(20 mg/mL)的固体培养基上,待凝固完全,在37 ℃培养箱倒置培养12~16 h,直至形成肉眼可见的蓝白斑。
1.3.4.4 白斑鉴定与基因酶切
挑取固体培养基上的单个白斑,溶解于20 μL TE中,水浴锅65 ℃加热10 min离心取上清,PCR鉴定重组质粒,再挑去白斑接种于含25 μg/mL Amp+的LB液体培养基中,37 ℃震荡培养10~12 h,7 000 r/min离心10 min取沉淀。用质粒小量提取试剂盒提取质粒(具体参照试剂盒操作步骤),并进行双酶切及PCR鉴定。

表2 PCR鉴定体系
PCR反映程序同1.3.4.1所述。

表3 双酶切鉴定体系
将该体系在37 ℃水浴锅中混匀50 min,用2%琼脂糖凝胶进行分析并且用DNA回收试剂盒将基因收回并保存于-20 ℃备用。
1.3.5 噬菌体包装及鉴定
1.3.5.1 噬菌体包装
将回收纯化后的基因与噬菌体 vector arms连接,体系见表4。

表4 噬菌体包装体系
将此体系混匀之后置于16 ℃恒温孵育12~16 h,然后在连接产物中加入5倍体积的T7包装提取物并混匀,置于22 ℃恒温孵育2 h,加入9倍体积的LB液体培养基终止反应。
1.3.5.2 重组噬菌体的滴度测定
将大肠杆菌BLT5615加入8 mL 含有Carb+和IPTG的M9LB液体培养基中,37 ℃震荡培养至OD600=0.6~0.8。用LB培养基对重组噬菌体进行103、104、105倍的梯度稀释,取不同稀释度重组噬菌体100 μL与5 mL预热的Top agarose和250 μL BLT5615混合均匀铺在含Carb+的固体培养基上,静置30 min,在37 ℃培养箱倒置培养4 h后观察噬菌斑,计算噬菌斑滴度(PFV)。
式中:X为噬菌斑数目;Y为对应的噬菌体稀释倍数。
1.3.5.3 重组噬菌体的PCR鉴定
挑选一个噬菌斑溶解于30 μL TE中[21],65 ℃加热10 min,12 000 r/min离心1 min取上清,做PCR鉴定。

表5 PCR鉴定体系
重组噬菌体PCR体系:80 ℃预变性5 min;94 ℃变性50 s,55 ℃退火1 min,72 ℃延伸1 min,变性、退火和延伸这3个条件进行35个循环;再延伸6 min;4 ℃保存。2%琼脂糖凝胶电泳检测基因片段。
1.3.6 重组噬菌体的扩大培养与保存
将BLT5615接种于8 mL含carb+的LB液体培养基,37 ℃培养过夜,将1 mL培养过夜的菌液加入46 mL含carb+和IPTG的M9LB中诱导培养至OD600=0.6~0.8,取10 μL的重组噬菌体接种于菌液中,37 ℃培养至菌液澄清为止,期间大约4 h,然后将噬菌体裂解物于4 ℃,8 000 r/min离心10 min,取1 mL上清液以噬菌体:氯仿=15∶1的比例加入37 μL氯仿置于-80 ℃保存。
1.3.7 重组噬菌体的纯化
室温下向噬菌体的裂解物中加入固体PEG8000至终浓度为10%,以及终浓度为1 mol/L的NaCl,缓慢搅拌至溶解完全,冰浴1 h以上或者4 ℃过夜用以沉淀噬菌体颗粒,将冰浴后的溶液缓慢置于离心机,4 ℃,10 000 r/min离心10 min收集噬菌体颗粒。取500 μL无菌SM溶液重悬噬菌体颗粒,缓慢转移至离心管,22 ℃孵育1 h后加入625 μL氯仿抽提悬浊液中残留的细胞碎片和PEG8000,轻轻震荡30 s后,4 ℃,5 000~6 000 r/min离心10 min分离水相,水相即为纯化富集的噬菌体。
1.3.8 大豆球蛋白兔源多抗效价测定
经硫酸铵纯化后的浓度为32.587 mg/mL的大豆球蛋白兔抗由实验室姚利利制备[22]。
用CBS溶液将重组噬菌体蛋白溶液稀释至50 μg/mL,包被于96孔的ELISA板,每孔加入100 μL,设置3组平行,同时设置阴性和空白对照(包被用CBS),放置4 ℃过夜;方法参考文献[21]。
1.3.9 加工破坏抗原表位特异性抗体的制备
参考文献[22]中热加工处理大豆球蛋白抗原最佳条件为蛋白浓度10 mg/mL、110 ℃、50 min;超高压联合热加工处理[24]抗原最佳条件为10 mg/mL,先超高压400 MPa加工15 min,然后130 ℃热处理20 min,抗原抑制率由87%降至37%。
将处理后的抗原与经过400倍稀释的兔抗分别加1 mL混匀,37 ℃孵育2 h之后,6 000 r/min离心1 min取上清,上清即为热处理和超高压联合热加工处理破坏抗原表位特异性抗体。
1.3.10 重组噬菌体的抗原性检测
取用CBS溶液将噬菌体表达出来的蛋白溶液稀释至50 μg/mL,然后包被96孔的ELISA板,每孔加入100 μL,同时设置阴性对照和空白对照(包被用CBS),4 ℃过夜,拍板方法参考文献[21]。
2 结果与讨论
2.1 大豆球蛋白A3亚基的抗原表位预测
采用生物学信息软件预测出A3亚基的主要线性表位区域为:90FEK-LQD109,169PDI171,174PETMQQ179,181QQQ-EEE200,230PDDERK235,249PKW251。
2.2 大豆球蛋白A3亚基的重叠分段(划线部分为重叠片段)
第1段(1 ~ 140AA):
ITSSKFNECQLNNLNALEPDHRVESEGGLIETWN- SQHPELQCAGVTVSKRTLNRNGLHLPSYSPYPQMIIVV- QGKGAIGFAFPGCPETFEKPQQQSSRRGSRSQQQLQD- SHQKIRHFNEGDVLVIPPGVPYWTYNTGDEP
第2段(81 ~230AA):
保密性是无线通信网络信息安全防护的主要方式。无线通信网络系统的保密性业务主要包括语音与数据保密性、用户身份与位置保密、用户和网络间信息保密性等。采用保密性方式之后,除了信息的参与者之外,其他人即使截获了信息也不能破解其中的含义。
AFPGCPETFEKPQQQSSRRGSRSQQQLQDSHQKI- RHFNEGDVLVIPPGVPYWTYNTGDEPVVAISLLDTSN- FNNQLDQNPRVFYLAGNPDIEHPETMQQQQQQKSHG- GRKQGQHQQQEEEGGSVLSGFSKHFLAQSFNTNEDT- AEKLRSP
第3段(171 ~320AA):
IEHPETMQQQQQQKSHGGRKQGQHQQQEEEGG- SVLSGFSKHFLAQSFNTNEDTAEKLRSPDDERKQIVTV- EGGLSVISPKWQEQEDEDEDEDEEYEQTPSYPPRRPS- HGKHEDDEDEDEEEDQPRPDHPPQRPSRPEQQEPRG- RGCQTRN
2.3 A3亚基分段引物的设计
大豆球蛋白A3亚基基因分段引物设计如表6所示。

表6 大豆球蛋白A3亚基基因分段引物
2.4 A3亚基的PCR扩增及其克隆载体的构建
2.4.1 A3亚基全长的基因扩增
以上海生工合成的载体质粒为模板,采用PCR技术得到A3基因,经2%琼脂糖凝胶电泳,结果如图1所示,观察到的目的条带与预期片段大小相符,且没有非特异性扩增,说明引物的特异性好。

注:M为DNA Marker Ⅲ;A3为全长。余同。图1 总长PCR扩增
2.4.2 重组质粒的PCR鉴定和酶切鉴定
构建基因克隆并成功的转化到E.coli JM109 Competent Cells中,挑取白色菌落用TE加热溶解并以此为模板进行PCR扩增,经2%琼脂糖凝胶电泳检测结果如图2所示,观察发现A3片段的长度与目的条带相符,说明重组质粒构建成功。
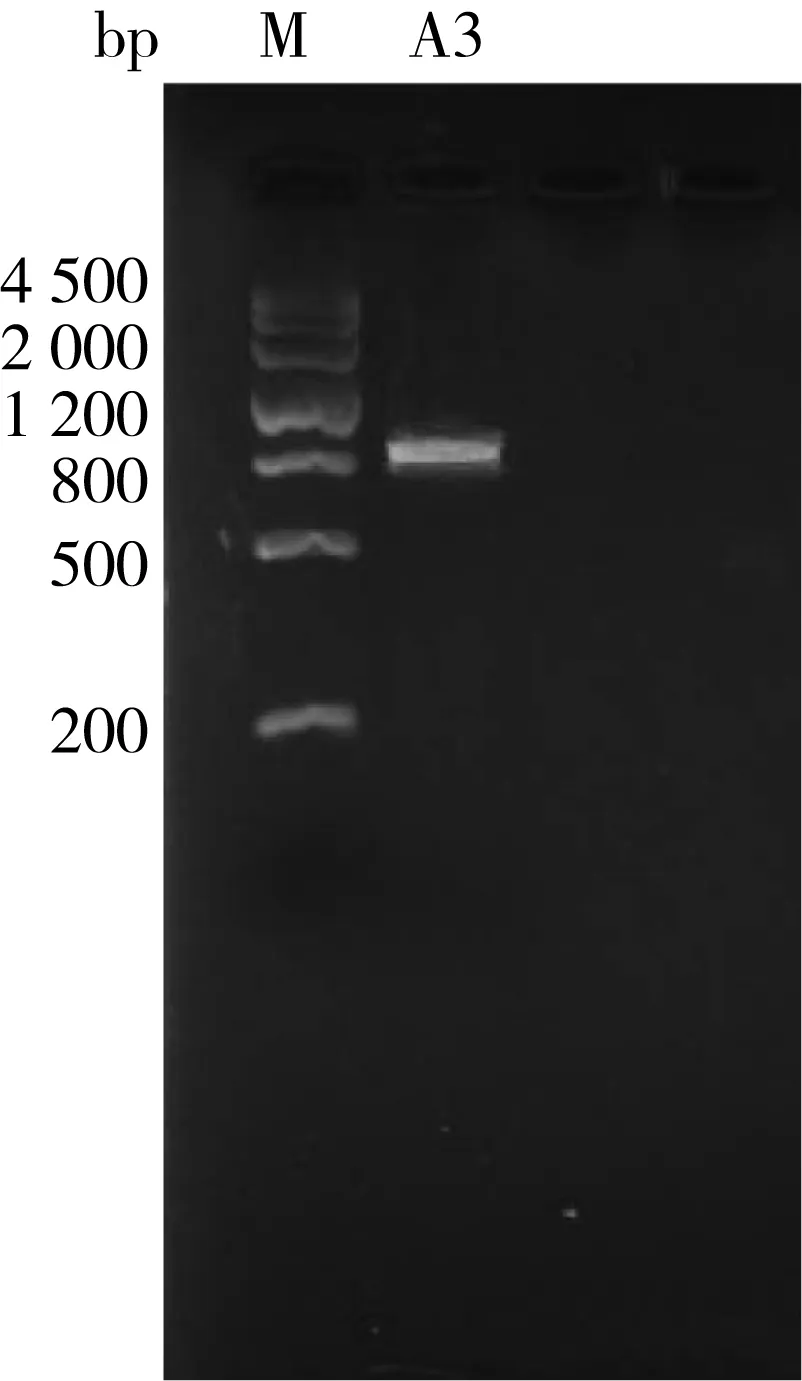
图2 重组质粒的PCR鉴定
将挑取的白色菌落进行扩大培养,提取质粒后进行双酶切鉴定,结果如图3所示,上方条带为细菌的环状质粒,经过酶切后,环状质粒的长度与pMD18-vector 载体的长度相当且大于目的条带,下方条带大小为960 bp,与目的条带大小相符,验证了酶切成功。

图3 重组质粒的酶切鉴定
2.5 噬菌体包装与鉴定
2.5.1 噬菌斑滴度测定
A3全长及其分段基因经酶切后与T7 vertor arms进行连接,加入包装提取物并转入大肠杆菌BLT5615,4 h后形成噬菌斑,如图4所示,通过计算得到A3基因及其A片段、B片段、C片段的重组噬菌体滴度分别为:6×106、1×106、5×105、1×105pfu。
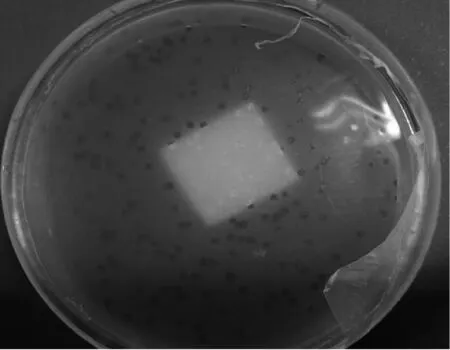
图4 重组噬菌体噬菌斑
2.5.2 重组噬菌体的PCR鉴定
挑选噬菌斑用TE溶解,65 ℃加热10 min,进行PCR扩增,用2%琼脂糖电泳得到的结果如图5所示,电泳条带与目的条带大小相一致。
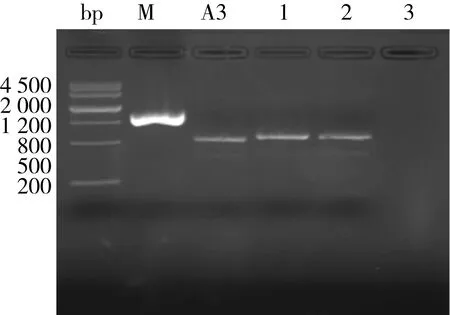
注:1~3分别为片段A、片段B、片段C。图5 重组噬菌体的PCR鉴定
2.6 加工破坏抗原表位的抗原性检测
2.6.1 大豆球蛋白兔抗效价的测定
不同稀释倍数的抗体与抗原反应的吸光度值如图6所示,随着稀释倍数的增加,OD450值逐渐降低,A3亚基的3个片段抗原性最高的是片段1、片段2和片段3的抗原性相差不大。
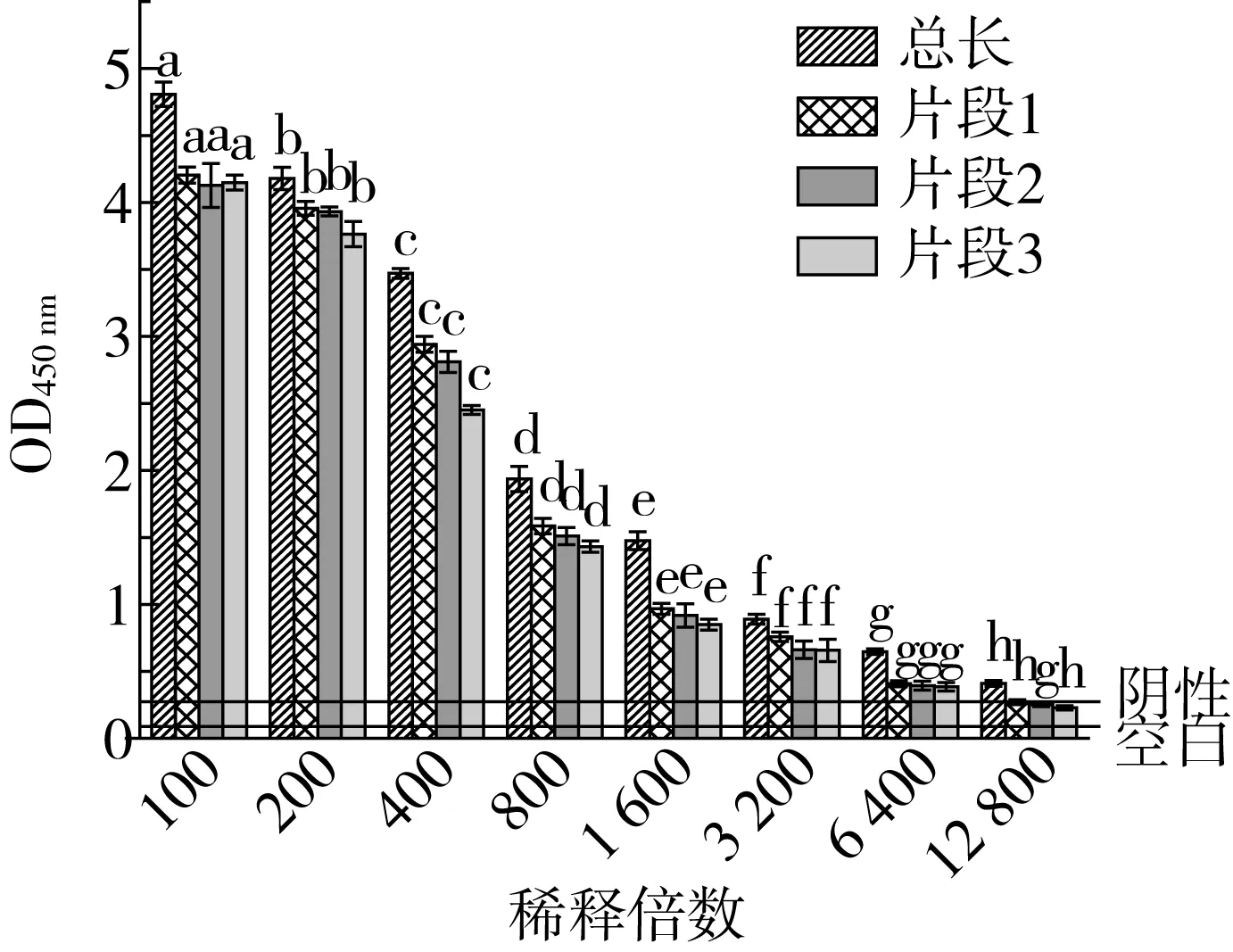
注:a-h为:差异性分析。图6 大豆球蛋白兔抗效价测定
OD450值为1~1.5时,抗体能跟抗原有效结合,因此在1~1.5区间内取抗体的最佳稀释倍数,如果OD450>2或者OD450<1时,会超出抗原抗体的线性结合范围,导致测得的数据不准确,影响实验结果,而且低稀释倍数在制作热吸收抗体时需添加浓度过高的大豆球蛋白,蛋白会过多聚集形成网状膜,使得抗原抗体不能完全反映,影响热吸收抗体与目的蛋白结合。因此,兔抗经过800倍稀释时的效果最好。
2.6.2 加工破坏抗原区域的ELISA鉴定
间接竞争ELISA结果如图7所示,片段1的抗原性最高,片段2和片段3的抗原性相差不大,片段上的表位越多就会结合更多的抗体,结果显示的抗原性就高。从加工方式来看,不同的加工方法对蛋白的破坏程度也有一定差异,加工破坏的程度高,则抗体与破坏后的蛋白结合的表位变少,热吸收抗体会与包被的目的蛋白上的表位结合,HRP会标记结合目的蛋白的抗体,并与TMB发生显色反映,结果显示OD450值越高,抗原性就越强,反之则低。图7显示,超高压联合热处理的方法对蛋白的破坏程度显著,其中对片段1的破坏最强,说明此处理方法使大豆球蛋白二级结构中的α-螺旋和β-折叠的含量降低,使得抗原表位减少;热处理单独作用的效果不显著,蛋白本身的热稳定性高,而且在热处理过程中,改变了蛋白质的空间结构,在破坏抗原表位的同时,会造成新的无规则卷曲,有可能出现新的抗原位点。因此,片段1的抗原性最强,且超高压联合热处理的方法对于片段1的破坏效果最显著,下一步主要研究对于片段一的分段表达及被破坏抗原区域定位。
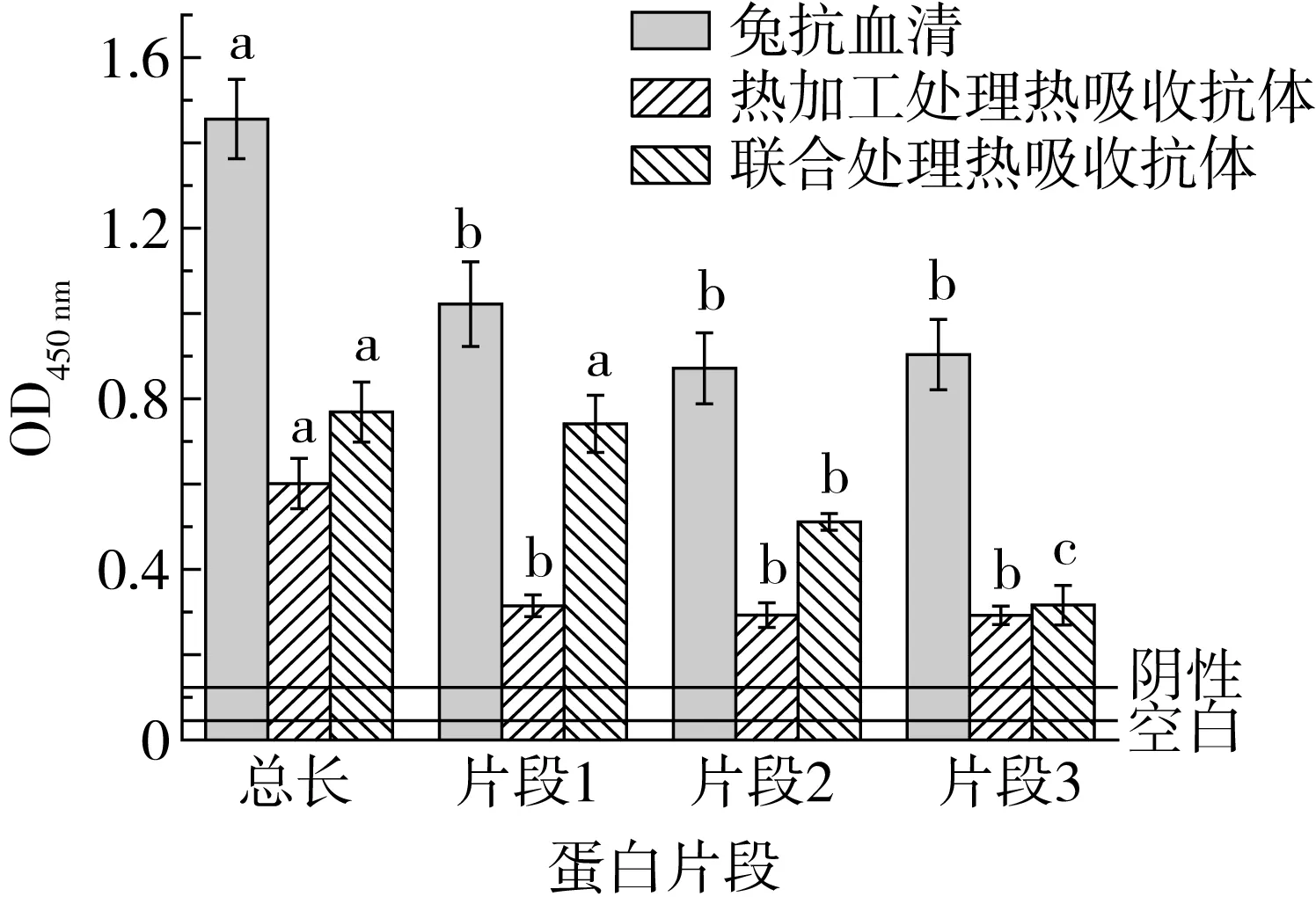
注:字母表示差异显著。图7 间接竞争ELISA结果
3 结论
本实验结果显示,抗体与片段1结合最多,其抗原性最高,从加工破坏方式来看,超高压联合热处理的方法对蛋白的破坏显著性高,大大降低了蛋白中的致敏位点,而热处理单独作用的效果不显著,可能是因为在加热过程中没有破坏掉隐蔽的位点或者又形成了新的无规则卷曲,2种方法都对片段1的破坏最强。
本研究通过成功构建表达载体并定位加工破坏最显著的抗原片段,实验中用到的载体试剂盒和噬菌体试剂盒的连接转化效率高,操作简便,能有效表达出目的蛋白,后续可进一步研究精确定位抗原表位,探究大豆球蛋白致敏性的分子机理等。
