适用于甲壳动物细胞的缓冲液配方优化
2022-11-24朱坤,李钫,杨丰
朱 坤,李 钫,杨 丰
(自然资源部第三海洋研究所、海洋生物遗传资源重点实验室,福建 厦门 361005)
在对螯虾、对虾等甲壳动物细胞的研究中,研究人员广泛采用了适用于哺乳动物细胞或者昆虫细胞的各类缓冲液。例如,在研究血细胞凋亡时使用的各类细胞凋亡试剂盒[1-2],血细胞体外吞噬时[3-6]以及血细胞分类时[7-9]使用的磷酸盐缓冲液(PBS)等。除此之外,在甲壳动物细胞培养中也经常采用哺乳动物细胞或昆虫细胞的培养液,例如Leibovitz’s L-15[10-13]、Medium-199[14-15]、Grace’s 昆虫细胞培养基[16-17]、Mitsuhashi and Maramorosch 昆虫细胞培养基[18]等。但是甲壳动物的渗透压与哺乳动物、昆虫等物种的渗透压不同,而且会根据生活环境不同而变化,同时渗透压对于甲壳动物具有十分重要的生理作用,它的调节能使甲壳动物很好地适应各种水生环境,维持正常的生命活动[19-22],因此直接沿用哺乳动物等物种的缓冲液配方是不合适的。
除了上述溶液之外,在甲壳动物细胞研究中最常用的缓冲液还有抗凝剂。抗凝剂是一种能够阻止血液凝固的缓冲液,它在进行甲壳动物血细胞等相关研究时是必不可少的[23-24]。一般甲壳动物应用较为广泛的抗凝剂配方为0.45 mol/L NaCl,0.1 mol/L葡萄糖,30 mmol/L柠檬酸钠,26 mmol/L柠檬酸,10 mmol/L EDTA[25],其中的柠檬酸钠、ETDA为主要的抗凝成分,通过螯合血淋巴中的Ca2+达到抗凝目的[24],随后相关的抗凝剂基本上都是在此基础上发展而来,如中华绒螯蟹(Eriocheirsinensis)[26]、克氏原螯虾(Procambarusclarkii)[27]、斑节对虾(Penaeusmonodon)[28]等。但是,不同的甲壳动物的渗透压也是不同的,它会随着物种的差异、环境的改变而变化[19],所以直接使用同一种抗凝剂配方也可能存在问题。
我们在实验中发现,使用常规PBS作为缓冲液来处理螯虾和对虾的血细胞,会造成细胞死亡率偏高、细胞状态不好的现象。而这可能就是由于缓冲液渗透压与体液渗透压不一致引起的高渗或低渗对细胞造成的影响。
本研究以红螯螯虾(Cheraxquadricarinatus)、克氏原螯虾、凡纳滨对虾(Litopenaeusvannamei)3种实验室常用的实验动物为研究对象,优化相应的缓冲液配方。旨在通过改变NaCl的浓度来调整抗凝剂等缓冲液的渗透压,使其与体液渗透压近似,从而减缓外部环境对细胞的刺激,维持细胞正常的生理状态,降低其死亡率。而结果表明优化后的缓冲液能有效保持细胞的活性,更有利于细胞培养、核酸蛋白抽提等一系列后续实验操作。
1 材料与方法
1.1 实验动物与材料
红螯螯虾购于广东省汕头市,凡纳滨对虾、克氏原螯虾购于厦门市第八市场,购买后暂养1周直至稳定,期间每隔1 d换水喂食。Propidium Iodide(PI)购买于生工生物工程有限公司,其余药品均为国产分析纯。
1.2 渗透压测量
选取健康的红螯螯虾、克氏原螯虾、凡纳滨对虾各5只,用75%酒精擦拭消毒。用1 mL注射器从腹部第一节进针,抽取500 μL血淋巴于1.5 mL离心管中,4 ℃过夜。随后4 ℃,7 500 r/min离心20 min,吸取清液(即血清)。血清制备完成之后,用冰点渗透压仪(Löser,OM806)分别测试红螯螯虾、克氏原螯虾、凡纳滨对虾血清的渗透压。同时一并测量本实验室目前使用的抗凝剂(140 mmol/L NaCl,100 mmol/L葡萄糖,30 mmol/L柠檬酸,26 mmol/L柠檬酸钠,10 mmol/L EDTA,pH 5.8)和PBS(140 mmol/L NaCl,10 mmol/L Na2HPO4,1.8 mmol/L KH2PO4,2.7 mmol/L KCl)的渗透压。
1.3 缓冲液配制
分别计算血清与目前使用的抗凝剂、PBS的渗透压差值,以NaCl做为改变缓冲液渗透压的溶质。根据公式:
(1)
(2)
式(1)至(2)中:ΔΠ为毫渗透压摩尔浓度差值(mOsmol/kg);Δm为溶质质量差值(g);M为摩尔质量(g/mol);a为溶质的离子数;Δc为溶质浓度差值(mmol/L);V为溶液体积(L)。
计算出理论上缓冲液渗透压与血清渗透压相等情况下所需要NaCl的浓度差值Δc,进而算出配制所需要的NaCl浓度;并根据这个理论值,设置NaCl浓度梯度。缓冲液的其他成分不变,依据设置好的NaCl浓度梯度,配制具有不同渗透压的抗凝剂以及PBS缓冲液。此时,设含140 mmol/L NaCl的抗凝剂和含140 mmol/L NaCl的PBS分别为未优化组。
1.4 血细胞死亡率统计
选取健康的红螯螯虾、克氏原螯虾、凡纳滨对虾,用1 mL注射器抽取250 μL“1.3”中配制的具有不同渗透压的抗凝剂后,抽取血淋巴(抗凝剂与血淋巴的体积比为1∶1)待用。样品分别室温放置15、30 min,然后加入PI至终浓度为5 μg/mL,室温染色2 min。随后用直径70 μm的滤网过滤染色的血淋巴,滤出液用流式细胞仪(BD FASC Calibur)分析血细胞在抗凝剂中的死亡率。
如上所述,抽取血淋巴(使用对应的最优抗凝剂,抗凝剂和血淋巴体积比为1∶1),2 000 r/min水平离心3 min,去上清液,然后用“1.3”中配制的具有不同渗透压的PBS缓冲液重悬,孵育一段时间后用流式细胞仪测定血细胞在PBS中的死亡率。同时,以上实验均使用荧光显微镜(Leica)观察血细胞的PI染色结果。
1.5 数据处理
所有血细胞死亡率数据均以平均数±标准差(n=5)表示,并使用Origin软件进行单因素方差分析(ANOVA)。P<0.05时表示具有差异显著,用星号“*”表示(“*”表示P<0.05,“**”表示P<0.01,“***”表示P<0.001)。
2 结果与讨论
2.1 甲壳动物血清及常用缓冲液渗透压的测定
本研究首先测定了红螯螯虾、克氏原螯虾,与饲养在盐度30海水中的凡纳滨对虾的血清渗透压,以及目前本实验室正在使用的抗凝剂、PBS的渗透压。结果如表1所示,红螯螯虾、克氏原螯虾、凡纳滨对虾的血清渗透压分别为(409±12)、(465±8)、(704±15) mOsmol/kg。而抗凝剂以及PBS的渗透压则分别为(489±12)、(288±2) mOsmol/kg。
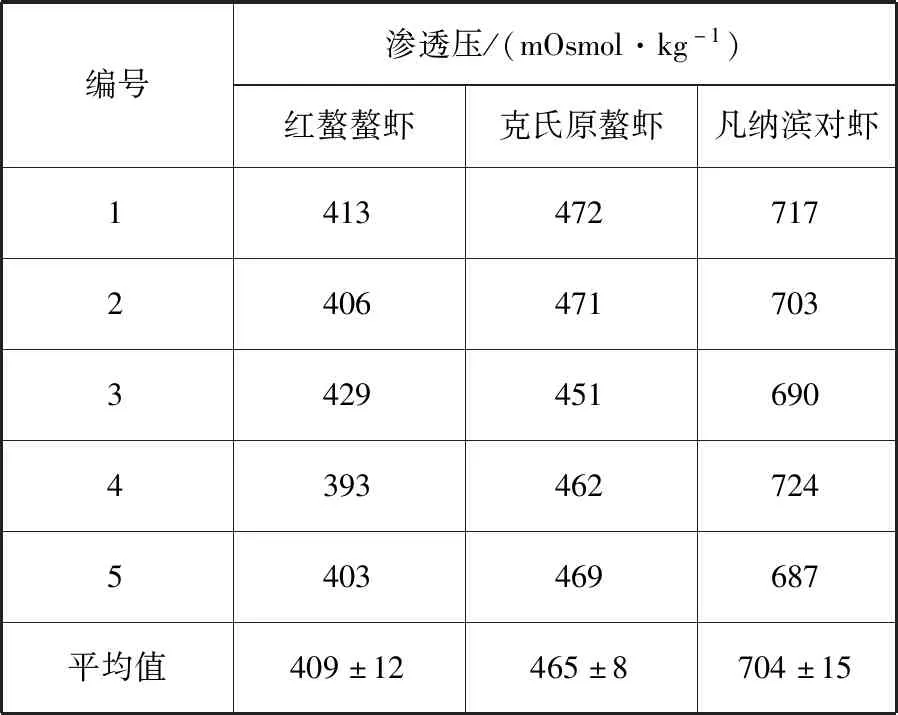
表1 红螯螯虾、克氏原螯虾和凡纳滨对虾的血清渗透压值Tab.1 Serum osmolality of C. quadricarinatus, P. clarkii and L. vannamei
2.2 缓冲液渗透压的调整
由于在抗凝剂和PBS中,NaCl均为调节渗透压的主要成分,因此我们通过改变NaCl的浓度来调节缓冲液渗透压使之与血清渗透压保持基本一致。根据“1.3”方法配置缓冲液,并测定新配制好的缓冲液的渗透压值,最终结果如表2所示,对于红螯螯虾,含70 mmol/L NaCl的抗凝剂及含200 mmol/L NaCl的PBS的渗透压值与其血清渗透压值近似,分别为(411±5)、(411±12) mOsmol/kg;对于克氏原螯虾,含100 mmol/L NaCl的抗凝剂以及含230 mmol/L NaCl的PBS的渗透压值与其血清渗透压值近似,分别为(468±3)、(460±1) mOsmol/kg;而对于凡纳滨对虾,则是含220 mmol/L NaCl的抗凝剂以及含360 mmol/L NaCl的PBS的渗透压值与其血清渗透压值近似,分别为(704±4)、(701±1)mOsmol/kg。

表2 各物种改进后缓冲液渗透压值Tab.2 Optimized buffer osmolality for C. quadricarinatus,P. clarkii and L. vannamei
2.3 缓冲液对血细胞存活情况的影响
研究进一步分析了血细胞在不同渗透压的缓冲液中的存活情况,评估不同渗透压缓冲液对细胞的影响。一般来说,进行甲壳动物细胞的体外实验时,时间通常不会太长,因此将血细胞在缓冲液中的时间设置为15、30 min。其中,抗凝剂的测定实验直接用预装了抗凝剂的注射器抽取血淋巴(抗凝剂与血淋巴的体积比为1∶1)并混匀,分别室温静置15、30 min,随后进行PI染色并测试死亡率。PBS的测定实验在确定最优抗凝剂配方之后,抽取血淋巴,按体积比1∶1与该抗凝剂混合,立即离心,用PBS重悬细胞,同样室温静置15、30 min后测定细胞死亡率。
首先,可以发现无论是红螯螯虾、克氏原螯虾还是凡纳滨对虾,抗凝剂对其血细胞的影响都不会随渗透压的改变而有明显的变化(图1至图6)。在红螯螯虾中,抗凝剂优化前后的血细胞死亡率基本都维持在0.5%(静置15 min)和1.0%(静置30 min)左右,优化前后没有显著性差异[P>0.05,图1(a)、(b),图2(a)]。而在克氏原螯虾中,其血细胞在未优化的抗凝剂中以及含100 mmol/L NaCl的抗凝剂中的死亡率均分别为0.5%(静置15 min)和1.0%(静置30 min)左右。虽然与未优化的抗凝剂和含100 mmol/L NaCl的抗凝剂中的死亡率相比,它在含110、120 mmol/L NaCl的抗凝剂时的死亡率较高,但是优化前后并没有显著性差异[P>0.05,图3(a)、(b),图4(a)]。最后,在凡纳滨对虾中,抗凝剂优化前后的血细胞死亡率则基本都维持在0.8%(静置15 min)和1.5%(静置30 min)左右,优化前后同样没有显著性差异[P>0.05,图5(a)、(b),图6(a)]。因此,我们认为抗凝剂的渗透压对于血细胞的影响并不显著。
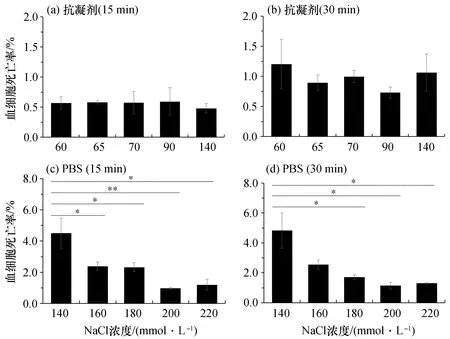
图1 红螯螯虾血细胞死亡率Fig.1 Mortality rate of haemocyte from C. quadricarinatus(a)与(b)分别在具有不同渗透压值的抗凝剂中15、30min时的死亡率;(c)与(d)分别为在具有不同渗透压值的PBS中15、30 min时的死亡率。死亡率表示为平均值±标准差,n=5,同时进行单因素方差分析,“*”表示具有显著性差异(P<0.05),下同。
而PBS的渗透压变化则能显著影响血细胞的存活状态。无论是红螯螯虾、克氏原螯虾还是凡纳滨对虾,它们的血细胞在未优化的PBS中的死亡率均达到最高,静置15 min时,红螯螯虾、克氏原螯虾、凡纳滨对虾血细胞的死亡率分别为4.5%[图1(c)]、2.2%[图3(c)]、10.0%[图5(c)],静置30 min时,则分别上升到4.8%[图1(d)]、2.8%[图3(d)]、21.2%[图5(d)]。在红螯螯虾中,血细胞死亡率在含200 mmol/L NaCl的PBS中达到最低,静置15 min时为1.0%,与未优化的PBS相比具有显著性差异[P<0.01,图1(c)],静置30 min时为1.1%,也具有显著性差异 [P<0.05,图1(d)]。在

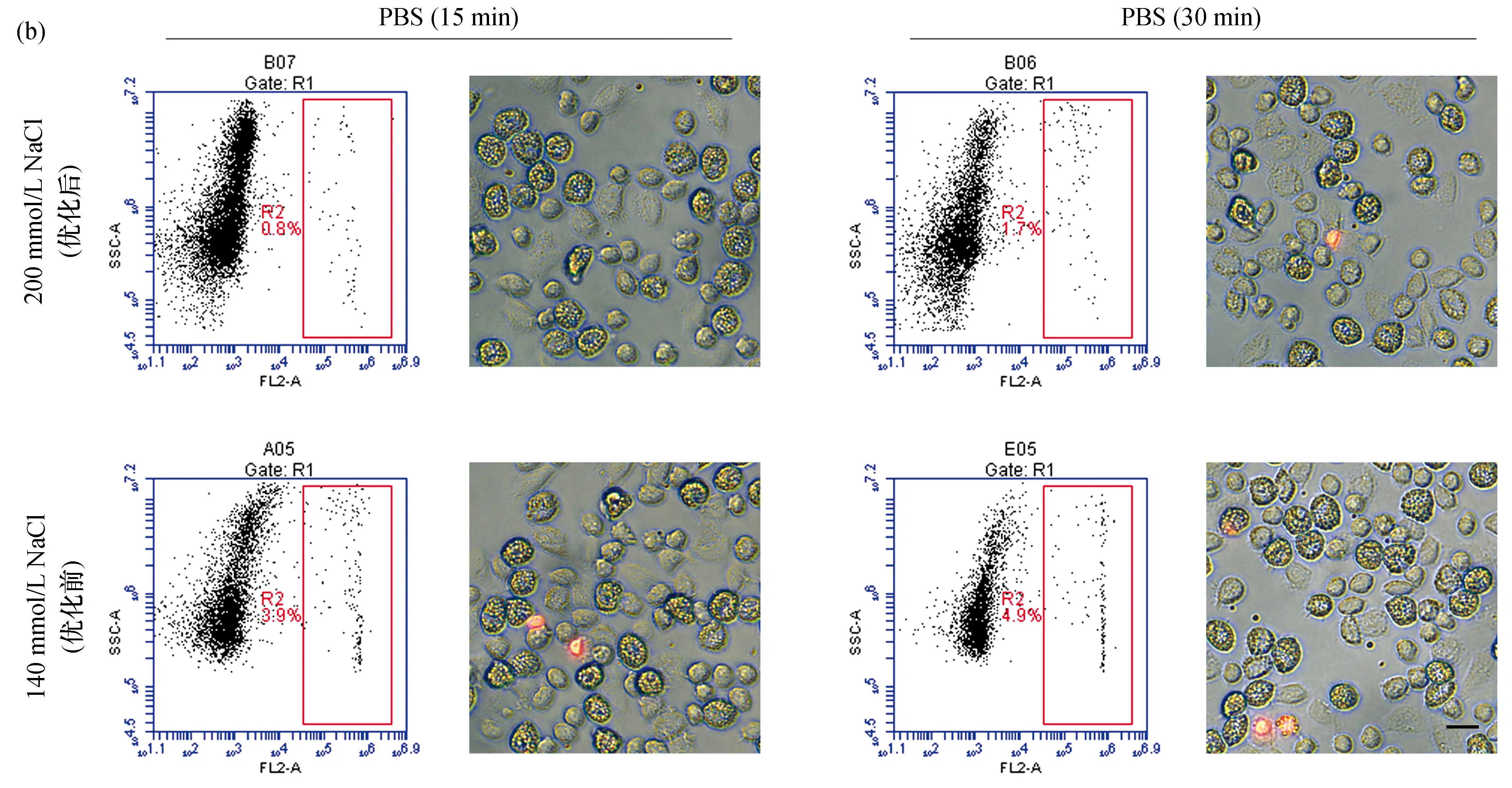
图2 红螯螯虾血细胞在优化前后的抗凝剂与PBS中死亡率的流式细胞仪检测与荧光显微镜观察结果Fig.2 Mortality rates of haemocyte from C. quadricarinatus observed with flow cytometry and fluorescence microscope in anticoagulant and PBS before and after optimization(a)和(b)分别表示血细胞在优化前后抗凝剂和PBS中15、30 min时的死亡率;流式分析散点图中,纵坐标表示颗粒度,横坐标表示荧光强度,红色矩形R2区域表示分布的死亡血细胞;镜检图中,死亡血细胞经PI染色呈红色,Bar=10 μm,下同。
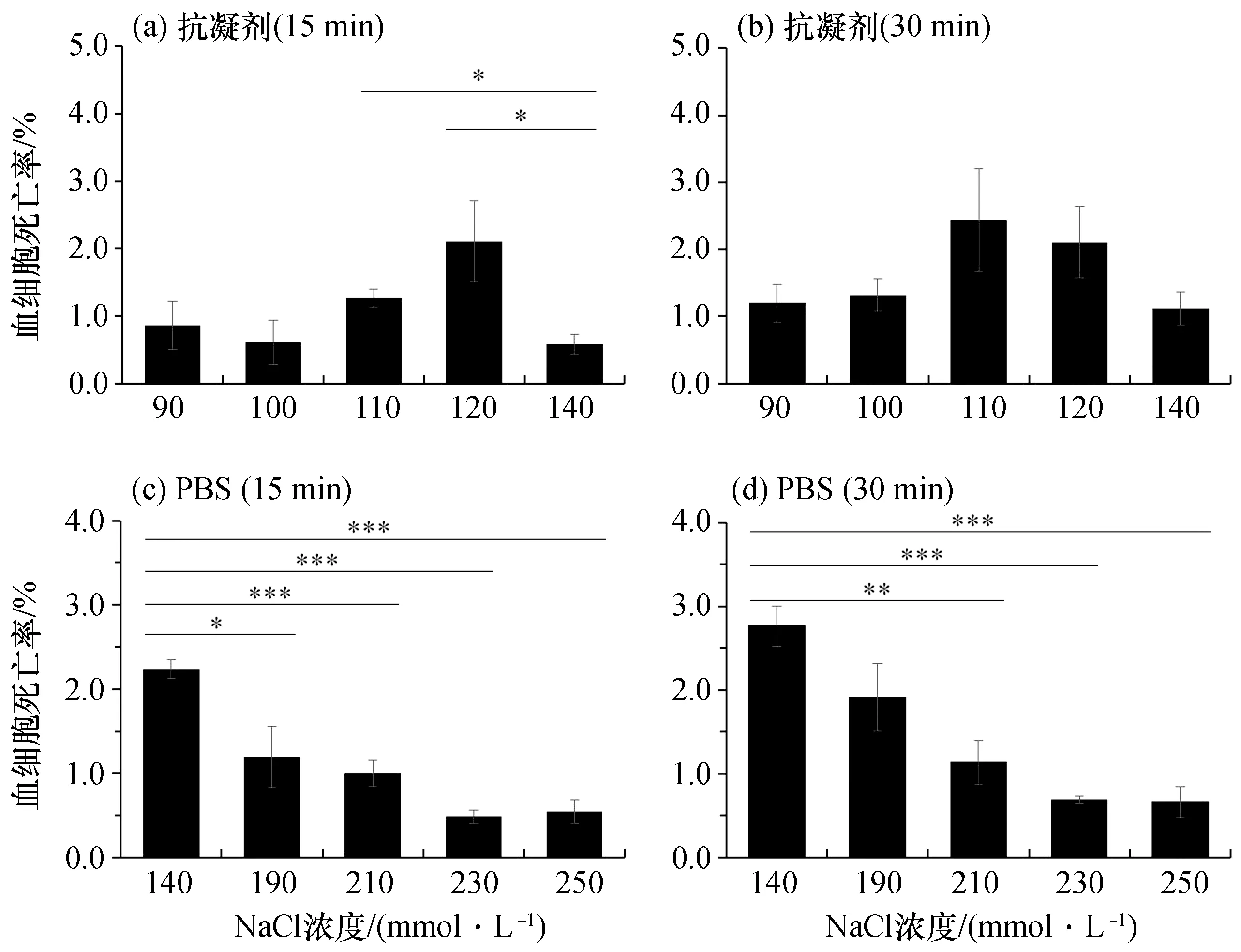
图3 克氏原螯虾血细胞死亡率Fig.3 Mortality rate of haemocyte from P. clarkii
克氏原螯虾中,血细胞死亡率在含230 mmol/L NaCl的PBS中达到最低,静置15、30 min时分别为0.5%、0.7%,与未优化的PBS相比均具有显著性差异[P<0.001,图3(c)、(d)]。而在凡纳滨对虾中,血细胞死亡率则在含360 mmol/L NaCl的PBS中达到最低,静置15、30 min时分别为1.2%、2.1%,其与未优化的PBS相比同样均具有显著性差异[P<0.001,图5(c)、(d)]。同时,荧光显微镜观察结果也与以上结果基本保持一致[图2(b)、图4(b)、图6(b)]。

图4 克氏原螯虾血细胞在优化前后的抗凝剂与PBS中死亡率的流式细胞仪检测与荧光显微镜观察结果Fig.4 Mortality rates of haemocyte from P. clarkii observed with flow cytometry and fluorescence microscope in anticoagulant and PBS before and after optimization
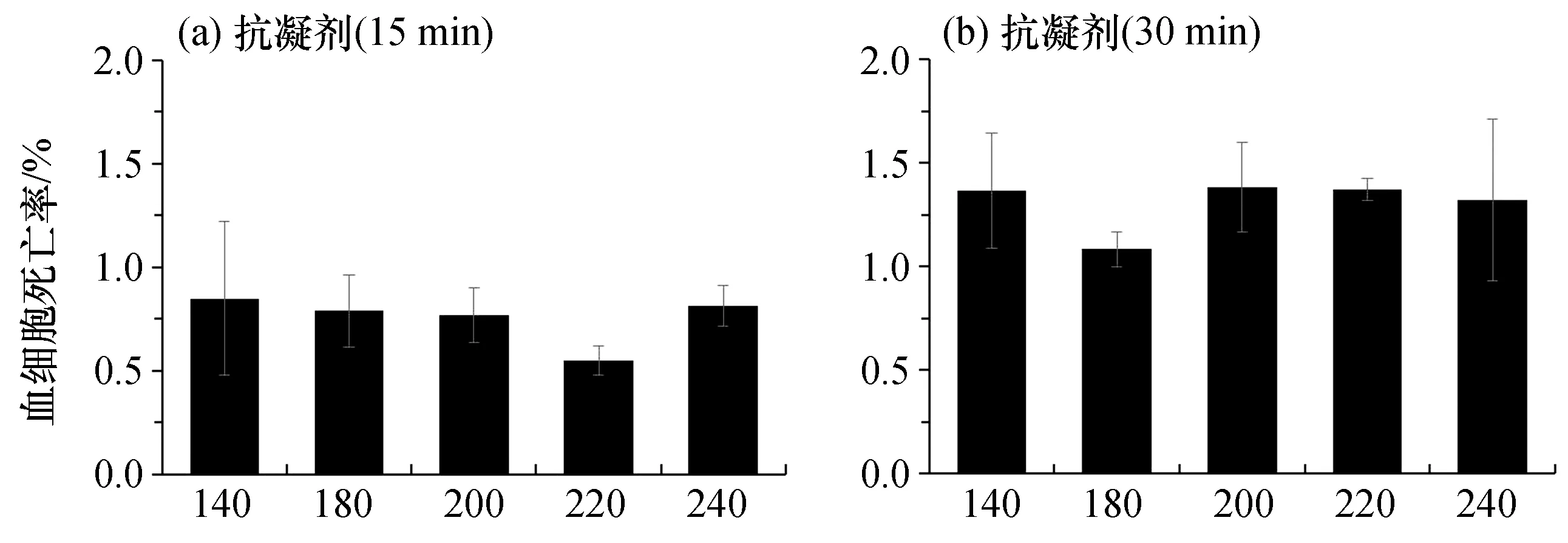
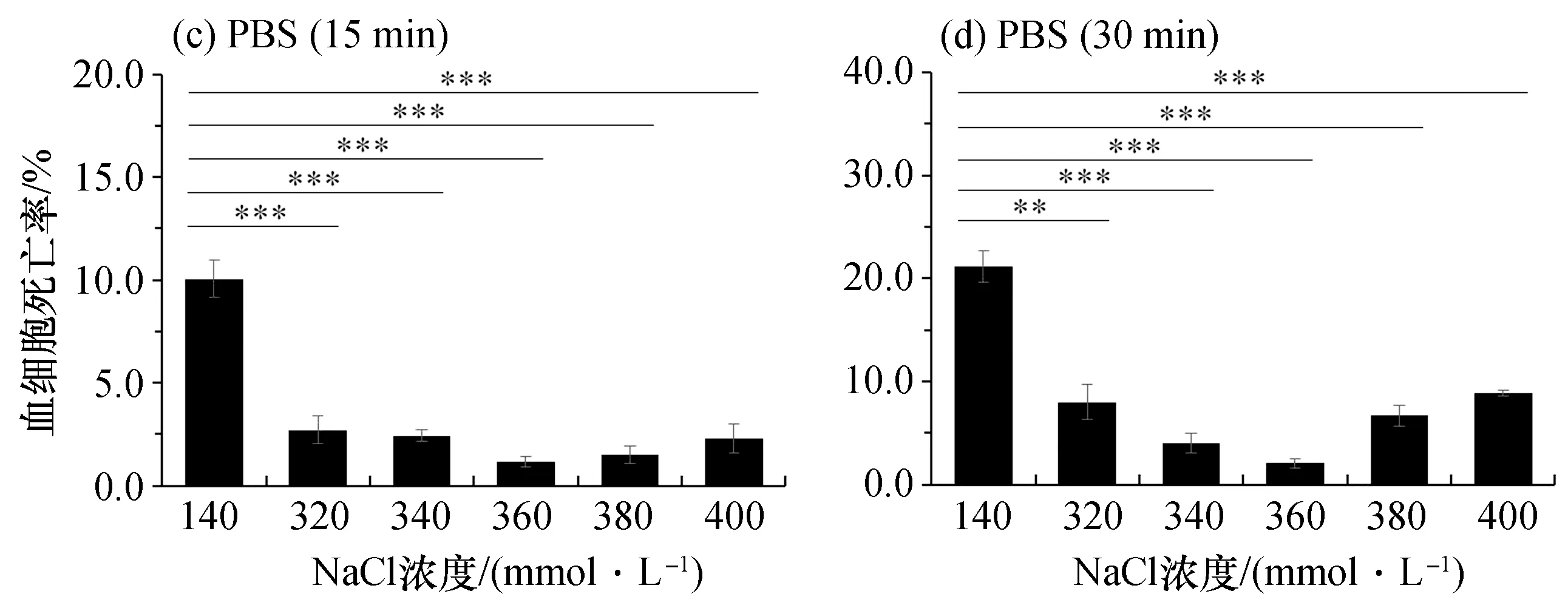
图5 凡纳滨对虾血细胞死亡率Fig.5 Mortality rates of haemocyte from L. vannamei
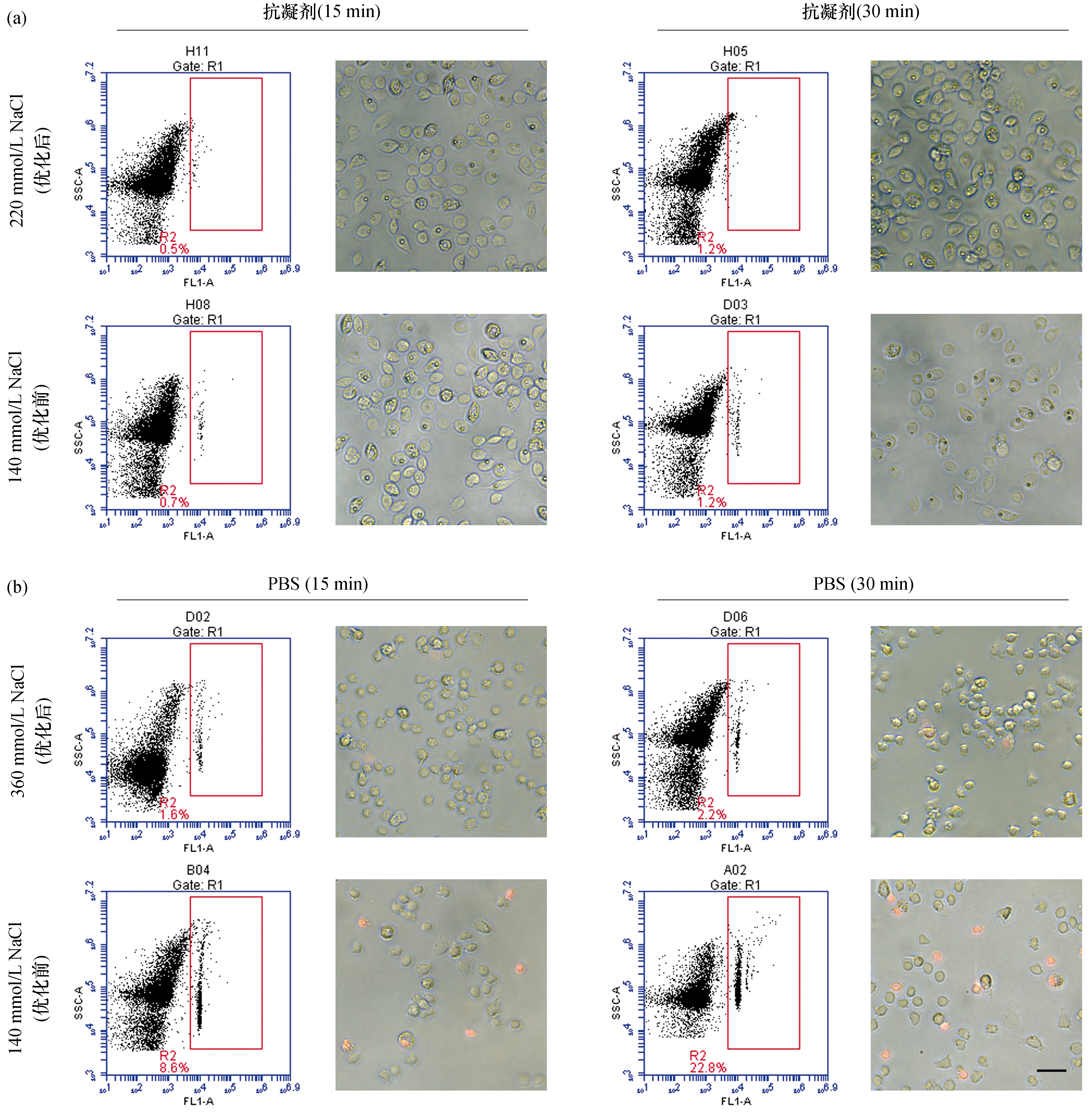
图6 凡纳滨对虾血细胞在优化前后的抗凝剂与PBS中死亡率的流式细胞仪检测与荧光显微镜观察结果Fig.6 Mortality rates of haemocyte from L. vannamei observed with flow cytometry and fluorescence microscope in anticoagulant and PBS before and after optimization
2.4 确定缓冲液配方
最终确定红螯螯虾抗凝剂(Cq-抗凝剂)中NaCl的浓度取70 mmol/L,PBS(Cq-PBS)中NaCl的浓度取200 mmol/L;克氏原螯虾抗凝剂(Pc-抗凝剂)中NaCl的浓度取100 mmol/L,PBS(Pc-PBS)中NaCl的浓度取230 mmol/L;盐度30时,凡纳滨对虾抗凝剂(Lv-抗凝剂)中NaCl的浓度取220 mmol/L,PBS(Lv-PBS)中NaCl的浓度取360 mmol/L(表3)。
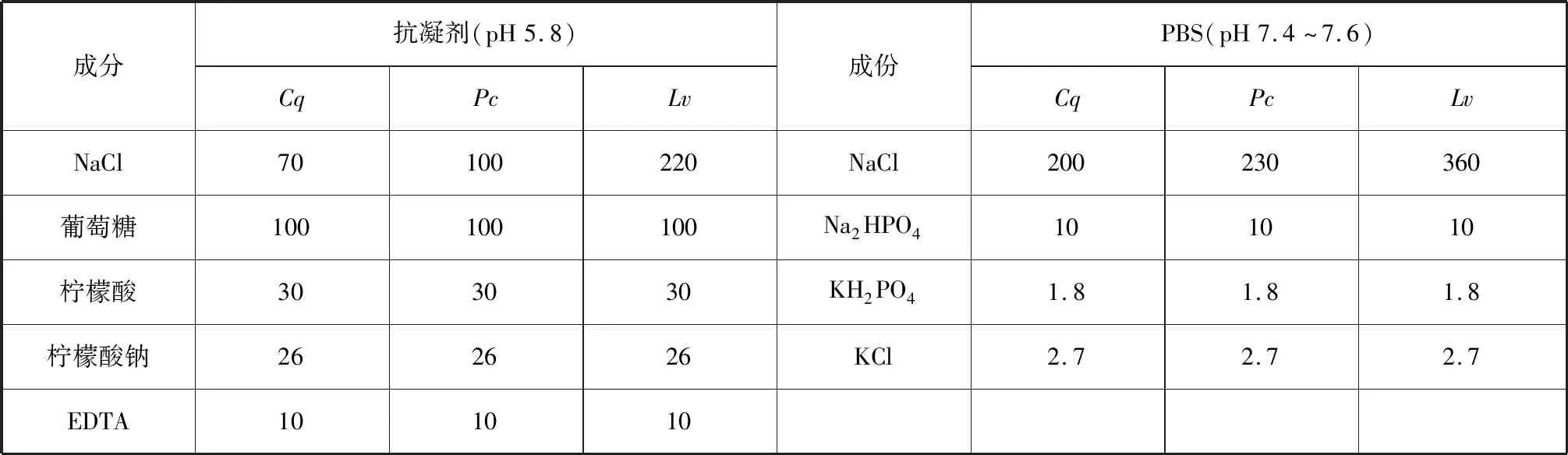
表3 优化后的抗凝剂与PBS配方Tab.3 Optimized formulation of anticoagulant and PBS
2.5 讨论
抗凝剂与PBS是我们进行甲壳动物细胞研究时必不可少的两种缓冲液,其中抗凝剂起到阻止血淋巴凝固的作用,而PBS则能提供一个相对稳定的缓冲体系。但是,以往许多研究在使用这两种缓冲液时,对于抗凝剂通常只注重它对于血淋巴的抗凝效果,而对于PBS更是直接沿用适用于哺乳动物等其他物种的缓冲配方,往往忽略了缓冲液渗透压这个指标以及其是否适用于甲壳动物[3-4,7,29]。这使得我们在进行相关实验操作时,让细胞暴露在一个渗透压不同于体液渗透压的环境中,这在一定程度上会影响细胞生理状态,进而影响包括RNA提取、蛋白抽提、原代培养等在内的后续一系列的实验操作。因此本研究的目的在于通过改变抗凝剂以及PBS中NaCl的浓度使其渗透压值接近甲壳动物体内体液的渗透压值,营造出一个渗透压接近真实体液环境的缓冲体系,使得包括血细胞在内的众多细胞在体外时也能处于类似于生物真实体内环境的体系中,而这将有利于我们后续的众多实验。
从整体的结果来看,抗凝剂渗透压对于血细胞的影响较小,在一定范围内改变抗凝剂的渗透压,红螯螯虾与凡纳滨对虾的血细胞死亡率也没有明显的变化;而克氏原螯虾的血细胞死亡率虽然稍有波动,但是它在优化前后的抗凝剂中的死亡率同样也没有显著性差异。然而PBS对于红螯螯虾、克氏原螯虾和凡纳滨对虾血细胞的影响则比较明显。上述甲壳动物的血细胞对于PBS的渗透压均比较敏感,它们在未改变渗透压的PBS中的死亡率均达到最高,而在调节PBS渗透压至接近血清渗透压后,其死亡率全部降至最低。并且红螯螯虾、克氏原螯虾和凡纳滨对虾血细胞在未优化PBS中的死亡率分别约是优化后PBS中的死亡率的4.5、4.0、10.0倍,优化前后具有显著性差异。研究表明,当外界环境盐度变化时,中华绒螯蟹、克氏原螯虾等甲壳动物能够明显调节自身的血淋巴渗透压以保持等渗,从而维持正常生理活动[30-31]。这说明甲壳动物细胞无论是在体内还是在体外对于渗透压的感知都有相当的敏感性,维持PBS等缓冲液渗透压与血淋巴渗透压等渗,这对于甲壳动物细胞在体外保持正常状态具有十分重要的意义。
3 结论
在综合比较各物种血细胞在不同NaCl浓度抗凝剂和PBS中孵育一段时间后的死亡率以及渗透压后,我们最终确定对于红螯螯虾抗凝剂中NaCl的浓度取70 mmol/L,PBS中NaCl的浓度取200 mmol/L;对于克氏原螯虾抗凝剂中NaCl的浓度取100 mmol/L,PBS中NaCl的浓度取230 mmol/L;而盐度30时,对于凡纳滨对虾抗凝剂中NaCl的浓度取220 mmol/L,PBS中NaCl的浓度取360 mmol/L。
综上所述,通过调节缓冲液的渗透压使其接近体液渗透压,能显著改善细胞状态并降低细胞在体外时的死亡率。而这能大大提高我们实验的准确性,尤其是在涉及活细胞相关实验时,比如体外吞噬实验、细胞凋亡实验、细胞的原代培养等等。优化后的缓冲液能更好地为我们的实验服务。
