等离子体低温催化甲烷选择氧化反应的研究进展*
2022-11-24解则安
王 璐,初 晓,赵 进,解则安,赵 震
(沈阳师范大学化学化工学院,辽宁 沈阳 110034)
天然气的全球储量丰富且是洁净的资源,其产量正在快速增长,尤其是非常规天然气(页岩气)。其中,部分天然气难从偏远地区运输,经常被直接烧掉或排放,浪费了宝贵的C1能源,并且危害环境。甲烷通过放热的选择氧化反应,直接转化为甲醇等方便运输的高值含氧化合物,具有极高的经济价值。由于含有官能团的含氧化合物在转化甲烷的条件下更容易被氧化,导致高甲烷转化率和高含氧化合物选择性难以兼得,因此,开发甲烷直接转化为甲醇的新技术和新工艺正成为具有挑战性的研究课题。在众多方法和技术中,低温等离子体激发的高能电子,可以在常温或低温条件下使甲烷中的C-H键断裂,避免传统热催化的高温反应条件下甲醇等含氧化合物的过度氧化,且所需设备简单、容易放大等,这些优势使等离子体催化甲烷选择氧化反应工业化具有潜在的优势[1-3]。
电晕放电、脉冲放电、微波放电和DBD可以产生低温等离子体。通常情况下,放电是通过向电极提供高电压而产生的,两个电极之间的气体将到达基态能级和激发态能级之间的相变点。在等离子体反应堆内,高能电子可以以多种方式与反应物碰撞:激发、电离、电子倍增、碎裂成原子和亚稳态化合物[4-6]。因此,等离子体反应过程中会产生多种振动激发和电子激发的分子、自由基、原子、离子和电子。如何调控这些物种之间的反应,选择性生成中间物种是等离子催化甲烷选择氧化的关键。
1 甲烷部分氧化DBD反应器类型
研究者已经设计了多种常温常压的低温等离子体DBD反应器,催化甲烷选择氧化反应,如图1~图5所示。
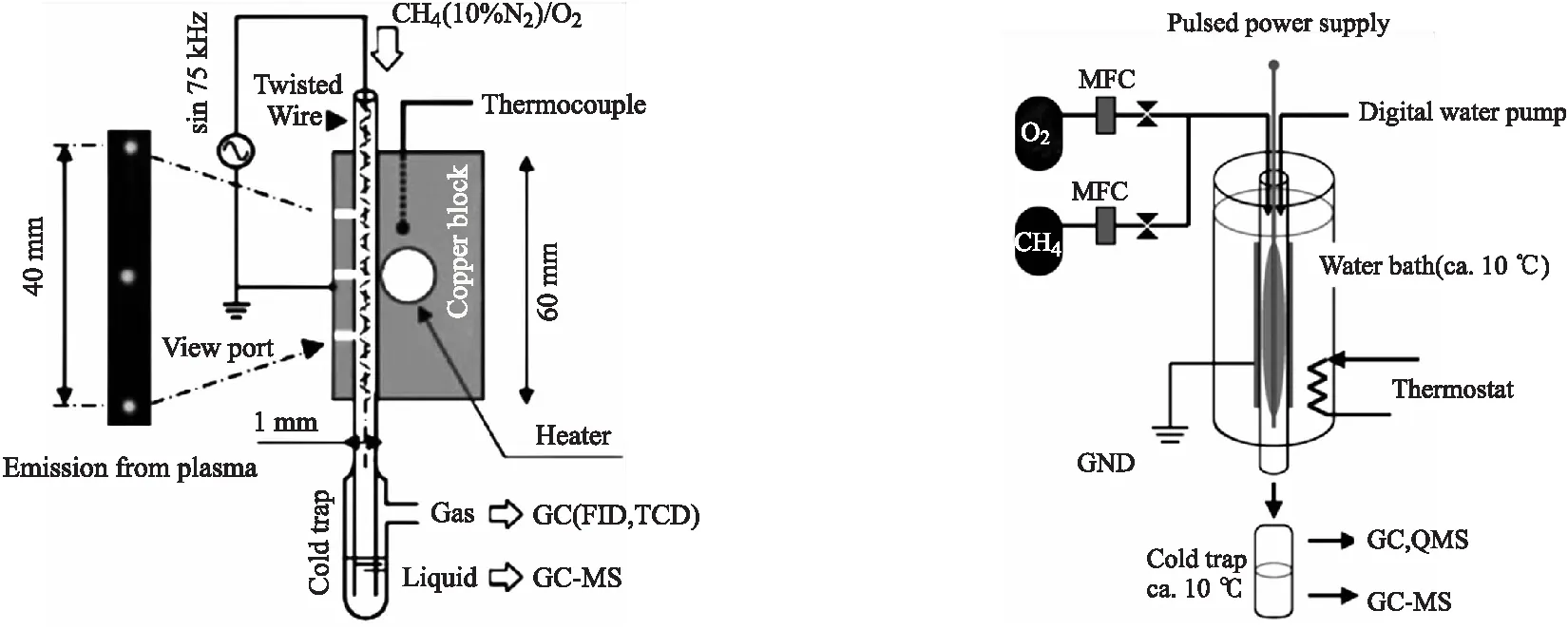
图1 Nozaki等人设计的微DBD等离子体反应器[7] 图2 Nozaki等人设计的接触液体膜放电等离子体反应器[8]
这些典型的管式放电反应器,由两个玻璃或石英的同心圆筒组成,外圆筒的循环水溶液或铁丝网是接地电极,钢或铜金属棒位于内圆筒内,并作为高压电极,无内筒包裹的高压金属电极直接接触反应气体。当等离子体打开时,微放电可能会出现在内部电极的表面,寿命非常短[9-13]。图2由一根薄石英管组成,内部有一根极细的钢丝作为高压电极,铝箔在玻璃管外作外部接地电极,反应过程中气体携带蒸馏水共进料,以冲洗出在反应器壁上冷凝的液相产物,抑制过度氧化。图4和图5是两种不同的DBD反应器,主要区别是内部的高压电极。其中,图4是单介电等离子体反应器(SDPR),SDPR的高压电极是一根裸铜线(内径 2.8 mm);图5是双介电等离子体反应器(DDPR),DDPR的高压电极是一个填充饱和氯化钠溶液的薄壁玻璃管(内径 2.8 mm)。DDPR和SDPR放电产生不同的平均电子能量和等离子体区域的电子能量分布。当使用DDPR时,整个放电空间中充满了大量的微丝,削弱了等离子体区域的平均电子能量和电子能量分布。同时DDPR生成了更多的O(1D),这在O(1D)+CH4→OH+CH3增加甲烷转化率中起着关键作用,使得反应得到更多的液相产物。
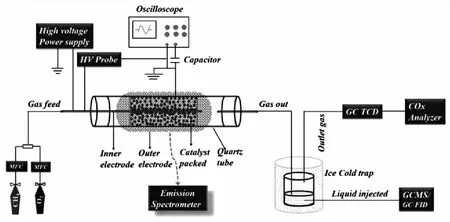
图3 Chawdhury等人设计的单圆柱形管式等离子体反应器[9]
上述研究表明,放电条件在空间和时间上高度不均匀时,对电子能量分布函数(EEDF)以及反应堆中的能量通道几乎没有控制,不利于含氧化合物等中间产物的生成[12,13]。通过设计新型的DBD反应器,控制EEDF和反应管中的放电模式,对于液相产物的选择性会有很好的改善。
2 催化剂与等离子体的协同催化甲烷选择氧化
甲烷的转化率和甲醇的生成受到许多参数的影响,除了反应器的本身外,主要影响反应的工艺参数为原料气混合比、停留时间、放电参数(电流、电压、功率、频率等)、惰性气体种类及比例。表1和表2总结了各种DBD体系中甲烷选择氧化的反应活性。
如表1所示,无催化剂填充的DBD反应器活性中,甲烷转化率从4.1%到66.4%,甲醇选择性从15%到42.2%,高甲烷转化率往往对应着低甲醇选择性。如表2所示,对于Al2O3、玻璃微珠和CZA以及分子筛等各种催化剂填充的DBD反应器,可以单一或同时提高甲烷转化率或者甲醇选择性,以得到比未填装催化剂时更好的甲醇产率。同时,富氧条件会使反应进入完全氧化反应,产物以CO2为主,甲醇生成量较少。关于甲烷与氧气比例对于甲醇的选择性,不同的设备和反应条件都会导致不同的反应结果。氧自由基的低分压有利于CO的形成[26]。易等人[16]的实验表明甲烷比氧气的最佳比例(物质的量比)为2∶1,而Chawdhury等人[9]的实验结果则是5∶1。
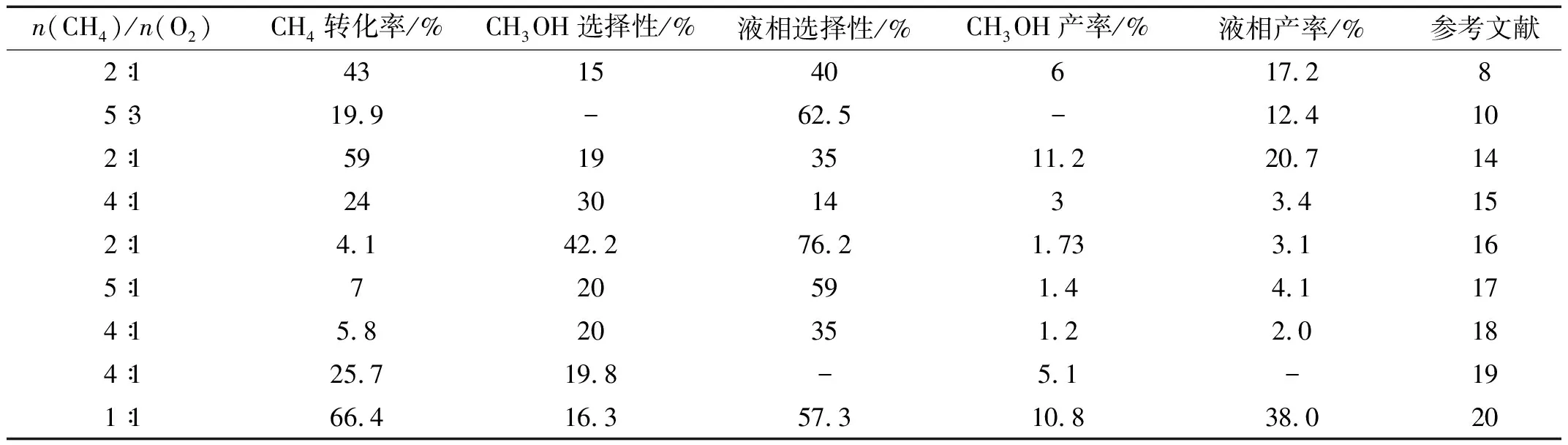
表1 无催化剂填充DBD体系上甲烷转化率和甲醇及液相选择性、产率列表

表2 各种催化剂填充DBD体系的甲烷转化率和甲醇及液相选择性、产率列表
Larkin和Indarto等人[27,28]研究了不同停留时间对甲醇生成的影响。当停留时间小于 2.5 s 时,甲醇是主要产物;随着停留时间的延长,选择性逐渐降低,二氧化碳浓度增加[29]。较长的停留时间会使氧气有更多的机会与甲烷和其他产物反应,从而推动等离子体反应进入深度氧化反应。然而,较短的停留时间会降低甲烷的转化率,导致甲醇产率的降低。
对于不同的放电形式,交流(AC)、直流(DC)、单脉冲、双脉冲等,或不同功率强度的等离子体将甲烷转化为甲醇。宋等人[30]表明,不同的波形会导致不同的产品定量分布。
氦气、氮气、氩气等稀有气体被加入到原料气中,降低反应物的分压,还可以改变等离子体区中放电物质的密度。在相同的条件下,稀有气体,如氦气和氩气的击穿电位低于甲烷或氧气,这意味着等离子体可以在较低的电源电压下启动。同时在稀有气体浓度较高时,高能自由电子的数量可能会增加,这将提高甲烷的转化率[31]。
水蒸气的共进料减少了氧气的分压,从而降低了甲烷的过度氧化。水蒸气对DBD等离子体放电特征产生影响,会使放电更为温和[32]。等离子体化学模拟显示,当DBD等离子体中的水含量从0%增加到8%时,最大电子密度下降了大约40%。此外,更高的水的浓度导致由于水分子旋转和振动激发而导致的电子能量损失,如文献中所讨论的对于He/H2O和Ar/H2O等离子体[32,33]。此外,通过冷却反应器壁,通过冷凝从气相中脱除H2O是有利的[16],为水蒸气可以从气相中快速带出可凝聚的含氧物,并抑制它们的进一步氧化。
等离子体与催化剂协同更容易振动激发的CH4[34],产生甲基自由基[35],甚至是在较低温度条件下。因此,在等离子体作用下,甲烷活化的表观活化能会显著降低[36]。易等人[16]通过对催化剂的表征,推测化学吸附氧是甲醇合成的真实活性中心。相反,晶格氧物种,可能是导致深度氧化产生CO和CO2的活性位。
相对于传统的热催化,填充至等离子体放电空间的催化剂粒径及孔结构对放电和气体停留时间都有较大的影响,一般孔道微放电的尺寸最低限度限制在 10 μm[37],较小的孔尺寸,无法在孔内产生或扩散等离子体[38]。此外,DBD等离子体系统中的填充组分(包括催化剂和玻璃珠)对等离子体参数和整体性能有显著影响[39]。因此,催化剂的结构参数在等离子体催化体系中应该受到更多的关注和研究。催化剂表面的局部曲率及其支撑结构、介电常数以及催化剂表面上电荷的积累都会影响等离子体中的电场。电场影响放电特性、电子能量分布函数(EEDF)和电子密度,从而影响等离子体成分,包括等离子体物质的激发。在DBD反应器中,电场增强对于诸如铁电材料的高介电常数珠更显著,等离子体表现为局部丝状放电。相比之下,对于介电常数较低的珠粒,如Al2O3和SiO2,大多数是丝状放电和表面放电的结合,这反过来也会影响催化剂上物质的种类和数量。
等离子体和催化剂之间还可能存在其他相互作用,如电场效应、表面电荷、热点形成和催化剂的形态变化,以及催化剂对等离子体特性的影响[40]等离子体改变催化剂表面的能力,是一种相互关系,即等离子体冲击表面,产生的表面影响生成的放电物种、能量平衡和等离子体?表面相互作用。例如,在等离子体制备催化剂中,等离子体处理可以提高金属在载体表面的分散度,这对催化反应有一定的影响[41]。
这些相互作用的影响以及它们如何影响催化中的任何结构变化是需要理解的关键信息。光/等离子体与气相物种的相互作用,它们对催化剂结构变化的影响,以及这两种相互作用如何影响气体物种在催化剂上的吸附,最终将决定催化剂的最终性质[1]。
研究这些相互影响,原位结构表征方法很重要,用X射线吸收光谱(XAS)研究了低温等离子体条件下Pd催化剂的甲烷氧化反应。发现Pd催化剂不受等离子体条件的影响。这项工作是一个很好的例子,说明了原位结构表征方法如何潜在地揭示等离子体中催化剂结构的变化[42]。
3 转化机理
等离子体诱导CH4解离为H和CH3是CH4活化的主要机制,CH3O和CH3OO自由基是CH3OH和CH2O的重要前体。因此,增加它们的分压也强烈地促进了CH3OH和CH2O的形成[26]。Bie等人[43,44]用一维流体模型模拟了DBD中CH4的部分氧化反应和主要反应途径。结果表明,CH3和O2反应成的CH3OO是形成氧酸盐的关键物种。钱等人[45]基于零维模型报道了CH3OH主要是通过CH3和OH的三体复合形成的,而不是通过CH3OO形成的。但江等人[46]的实验表明,CH3OH和合成途径主要是通过CH3OO。等离子体诱导的CH4的部分氧化合成甲醇的一个重要问题是中间产物和目标产物都容易深度氧化成CO和CO2。模拟没有催化剂的等离子体中的CH4的部分氧化反应可以提供对气相化学的有用的信息,从热催化的理论研究可以更好地理解催化剂表面的化学[43]。Bogaerts等人[26]认为,气体CH4解离吸附在催化剂表面,形成CH3*和H*。CH3*进一步脱氢为CH2*,CH2*进而形成CH*。在所有三个步骤中,C-H键的断裂都是通过与表面空位的相互作用进行的,而不是通过与OH*或O*的相互作用来进行的。大多数CH*(90.5%)被氧化成CHO*,然后分解成CO*,CO*从表面解吸。小部分CH*(9.4%)首先进行脱氢,然后生成的C*也被氧化成CO*。催化剂与等离子体自由基的结合显示了提高含氧物选择性的潜力。因此,调节等离子体中自由基的分压可能会进一步改变含氧物的分布。
Nozaki等人[7]也模拟了在没有催化剂的情况下在CH4中形成流光等离子体的过程,结果表明,甲烷裂解模式取决于还原电场,还原电场越强,脱氢CHx物种的占的比例越大。
现阶段通过NTP诊断和反应机理OES诊断,可以揭示一些在CH4/O2等离子体合成CH3OH中起作用的重要等离子体物种。其中,可以检测到CH(431.4 nm)、H(656.3 nm)和O(777.4 nm 和 844.7 nm),证明了等离子体O(1D)和H自由基物种[9,16]。其中存在CH、H和O物种。OES结果表明,在CH4/O2等离子体中,含有丰富的CH。
非热等离子体环境可以在结构上或成分上使催化剂本身发生变化,并且通过电场效应影响表面反应速率或路径[2]。来自等离子体的电子流不可避免地导致催化剂上电荷的积累。在宏观尺度上,这影响了流光的形成和等离子体对孔隙的渗透。在微观尺度上,它可以改变催化剂的电子和几何结构,潜在地导致反应动力学发生变化[47]。研究人员通过建立零维和一维模型尝试模拟了这些电场和化学反应的变化。例如,Bie等人[48]基于一维流体模型,预测CH4在DBD等离子体中产生CH3、CH2和CH自由基的概率分别为79%、15%和5%。Bogaerts等人[16]通过建立零维模型很好的模拟了等离子体条件下甲烷制甲醇的中间反应路径,给出了与实验结果基本一致的解释。
实验和模型还表明,对于较大的孔和施加的电压,等离子体形成更容易发生。模型推算了尺寸极限在德拜长度的数量级[49],而实验表明了需要更大的尺寸极限[50]。模型预测,低介电常数材料更容易在催化剂孔隙内形成等离子体,因为孔隙形状会影响电场增强,从而影响等离子体特性,但这仍需通过实验证实[51]。
4 总结
在等离子体催化甲烷转化为甲醇的研究中,我们需要关注反应器的设计来控制放电类型和特性,随后研究催化剂的特征(尺寸、形状、介电常数、活性组分)和它们在等离子体-催化剂共同反应中的相互作用。等离子体条件下催化剂表面化学和反应机理的实时检测变得越来越重要,这可以通过等离子体物理学、流体动力学、固体表面化学和数值模拟之间的多学科合作来实现。为了进一步铺平等离子体催化的未来,需要为原位探测和操作分析制定标准和各种手段,以揭示等离子体合成的基本机制,并确定等离子体在催化材料中的作用,同时重点关注局部电场增强,施加电压对固体催化剂中电子能量分布及其对反应物转化率和产物选择性的影响。还有固体催化剂与等离子体相互作用产生的亚稳态物种如何在反应中起作用,以及非热等离子体发出的热辐射和光辐射对催化剂的影响如何引起反应的变化。
