气相色谱法同时测定肥料中6种植物生长调节剂
2022-11-24王庆彬赵红玲彭春娥但加东
王庆彬, 赵红玲, 彭春娥, 史 磊, 孙 健, 孟 慧, 但加东, 高 漪, 张 民
(1.土肥高效利用国家工程中心,山东农业大学资源与环境学院,山东泰安 271018; 2.山东蓬勃生物科技有限公司,山东泰安 271000; 3.作物生物学国家重点实验室,山东农业大学生命科学学院,山东泰安 271018)
植物生长调节剂(PGRs)是用于调节植物生长发育的一类农药,包括从生物中提取的天然植物激素和人工合成化合物[1]。农业生产中合理施用PGRs可以提高种植效益、增加作物产量、增强作物抗逆性及改善产品品质[2 - 5]。但PGRs盲目使用会导致作物减产、品质下降和残留超标[6],甚至对人体健康产生危害。近年来,一些厂家在肥料产品中隐形添加PGRs,导致出现PGRs重复、过量和拮抗使用的现象,对农作物造成减产、降质甚至绝产的危害。因此,2019年国家农业部在《农药管理条例》明文规定,肥料中添加PGRs属违法行为,并同时发布了国标《肥料中植物生长调节剂的测定高效液相色谱法》[7]的方法,对植调剂产品的规范化施用起到了极大的促进作用。目前,该方法和王庆彬等[8]报道的广泛应用于肥料中PGRs含量检测的方法互为补充。
气相色谱法作为一种较成熟的分析技术,对于挥发性物质的分离具有快速、灵敏、高通量、高选择性等特性,在PGRs分析检测中占有非常重要的地位[9 - 13]。张娟等[14]用丙酮溶解样品,辅助超声、离心前处理工作,建立了叶面肥中多效唑的气相色谱测定方法。苏本玉等[15]通过比较不同提取溶剂对PGRs的提取效果,建立了肥料中3种PGRs的气相色谱分析方法。本实验采用通用性KB-5色谱柱,利用气相色谱法,通过超声辅助提取结合衍生技术,分离分析肥料中对萘乙酸(Naphthylacetic Acid,NAA)、萘乙酸钠(Sodium Naphthylacetate,SNA)、胺鲜酯(Diethyl Aminoethyl Hexanoate,DA-6)、多效唑(Paclobutrazol,MET)、烯效唑(Uniconazole,HS)及三十烷醇(Triacontanol,TA)6种PGRs。DA-6、MET、HS及TA采用超声与离心技术相结合的方法进行提取后直接上机检测,其中MET与HS检测结果可与液相色谱结果进行对比,确保检测结果的准确、可靠、有效。NAA及SNA等高沸点物质,采用衍生后上机检测,以扩大气相检测物质范围。因此,本方法的建立为肥料中PGRs的检测提供参考依据。
1 实验方法
1.1 仪器、试剂和材料
气相色谱仪(AOC-20I,GC-2010,E),配FID检测器(日本,岛津公司),色谱柱:KB-5(5%-苯基二甲基聚硅氧烷毛细管柱)(30 m×0.32 mm×0.25 μm);KQ3200DE超声仪器(昆山市超声仪器有限公司);超纯水仪(美国,Millipore公司);Centrifuge 5810 R高速冷冻离心机(德国,EPPENDORF公司)。
PGRs标准品:TA(纯度≥98%)、MET(纯度≥95%)、HS(纯度≥98%)、SNA(纯度≥95%)均购自上海源叶生物科技有限公司;DA-6(纯度≥99.5%)购自德国Dr.Ehrenstorfer GmbH;NAA(纯度≥96%)购自美国Genview;三氯甲烷、正己烷、乙酸乙酯、甲醇、三氟化硼-甲醇溶液、HCl,均为分析纯。实验用水为超纯水(18.2 MΩ·cm)。
1.2 标准溶液的配制
1.2.1 DA-6、MET、HS、TA标准溶液分别称取0.01 g(精确到0.0001 g)DA-6、MET、HS、TA标准品,用三氯甲烷定容至10 mL,配制成浓度为1 000 mg/L的标准储备溶液。分别移取DA-6、MET、HS标准储备液各0.05、0.25、0.50、0.75、1.00 mL,TA标准储备液各1.00、2.00、3.00、4.00、5.00 mL至10 mL容量瓶中,用三氯甲烷定容至刻度,配制成DA-6、MET、HS浓度分别为5、25、50、75、100 mg/L,TA浓度分别为100、200、300、400、500 mg/L的混合标准工作溶液,现用现配。
1.2.2 NAA及SNA标准溶液分别称取0.01 g(精确到0.0001 g)NAA及SNA标准品,用正己烷定容至10 mL,配制成浓度为1 000 mg/L的标准储备溶液。准确移取NAA标准储备液0.05、0.25、0.50、0.75、1.00 mL,分别注入5支15 mL离心管中,每管中加入三氟化硼-甲醇溶液2 mL,70 ℃水浴反应10~15 min,冷却后加入饱和NaCl溶液2 mL,用8 mL正己烷提取,将提取液转移至10 mL容量瓶中,用正己烷定容至刻度。配制成NAA浓度分别为5、25、50、75、100 mg/L标准工作溶液,现用现配。
1.3 肥料样品的制备
混合标准溶液:分别称取适量TA、DA-6、MET、HS、NAA及SNA标准品,配制成3个水平的混合标准工作液DA-6、MET和HS:10、40、80 mg/L;TA:150、250、400 mg/L;NAA和SNA:10、40、80 mg/L。
固体样品制备:准确称取10.00 g空白肥料,在表面喷施上述标准混合溶液1 mL,颠倒混匀后,40 ℃烘干,待测。每个混合标准品水平3个样品平行。
液体样品制备:准确加入9 mL空白样品,加入1 mL混合标准样品,振荡混匀后待测。每个混合标准品水平3个样品平行。
1.4 样品前处理
1.4.1 DA-6、MET、HS和TA称取1.00 g样品于离心管中,加入8 mL三氯甲烷,涡旋振荡1 min,超声提取30 min,冷却至室温,用三氯甲烷定容至10 mL,6 000 r/min离心10 min,取1 mL上清液,0.22 μm有机相滤膜过滤,待测。
1.4.2 NAA和SNA称取1.00 g样品于50 mL离心管中,加入5 mL正己烷,振荡提取10 min后,加入2 mL三氟化硼-甲醇溶液,70 ℃水浴反应10~15 min,加入2 mL饱和NaCl溶液,用10 mL、10 mL、5 mL正己烷进行3次提取,合并提取液并浓缩至5 mL左右,转移至10 mL容量瓶中,用正己烷定容至刻度。6 000 r/min离心10 min,取1 mL上清液,0.22 μm有机相滤膜过滤,待测样品中NAA含量。
称取1.00 g样品于离心管中,加入1 mL高纯水和1 mL 1 mol/L HCl,静置10 min,再加入5 mL正己烷,振摇10 min,静置10 min分层,分离正己烷相和水相,正己烷中加入三氟化硼-甲醇溶液2 mL,70 ℃水浴反应10~15 min,加入2 mL饱和NaCl溶液,用10 mL、10mL、5 mL正己烷进行3次提取,合并提取液并浓缩至5 mL左右,转移至10 mL容量瓶中,用正己烷定容至刻度。6 000 r/min离心10 min,取 1 mL 上清液,0.22 μm有机相滤膜过滤,待测样品中NAA和SNA总含量。样品中SNA含量为NAA和SNA总含量减去NAA含量。
1.5 气相色谱条件KB-5色谱柱(5%-苯基二甲基聚硅氧烷毛细管柱)(30 m×0.32 mm×0.25 μm);程序升温:初始温度40 ℃,保持3 min,以15 ℃/min升到290 ℃,保持18 min;气化室温度:290 ℃;检测器温度:300 ℃;气体流量(mL/min):载气(N2)1.5、氢气40、空气400、补偿气(N2)30;进样量为1 μL。
2 结果与讨论
2.1 色谱柱的选择
多组分分析方法的建立需要兼顾极性差异较大的各种化合物,选择合适的色谱柱是关键[16]。因此本研究考察了KB-1(聚二甲基硅氧烷毛细管柱)、KB-5(5%-苯基二甲基聚硅氧烷毛细管柱)及KB-1701(14%氰丙基二甲基硅氧烷柱)3种色谱柱。结果发现:DA-6、MET、HS及TA在非极性和中等极性固定相上的响应度较低,且峰形拖尾;而在弱极性的固定相KB-5上,不仅响应值高,而且出峰速度快。因此本实验采用KB-5色谱柱作为固定相,结果如图1所示。

图1 优化后的色谱图Fig.1 Chromatogram at the optimized conditions
2.2 提取溶剂的优化
实验中分别采用甲醇、丙酮及三氯甲烷做为提取溶剂,利用超声辅助涡旋与离心相结合的方法,提取肥料中DA-6、HS、MET及TA,结果发现4种PGRs在三氯甲烷中的提取效果较好。4种PGRs的回收率范围为85.24%~110.88%,结果见图2。
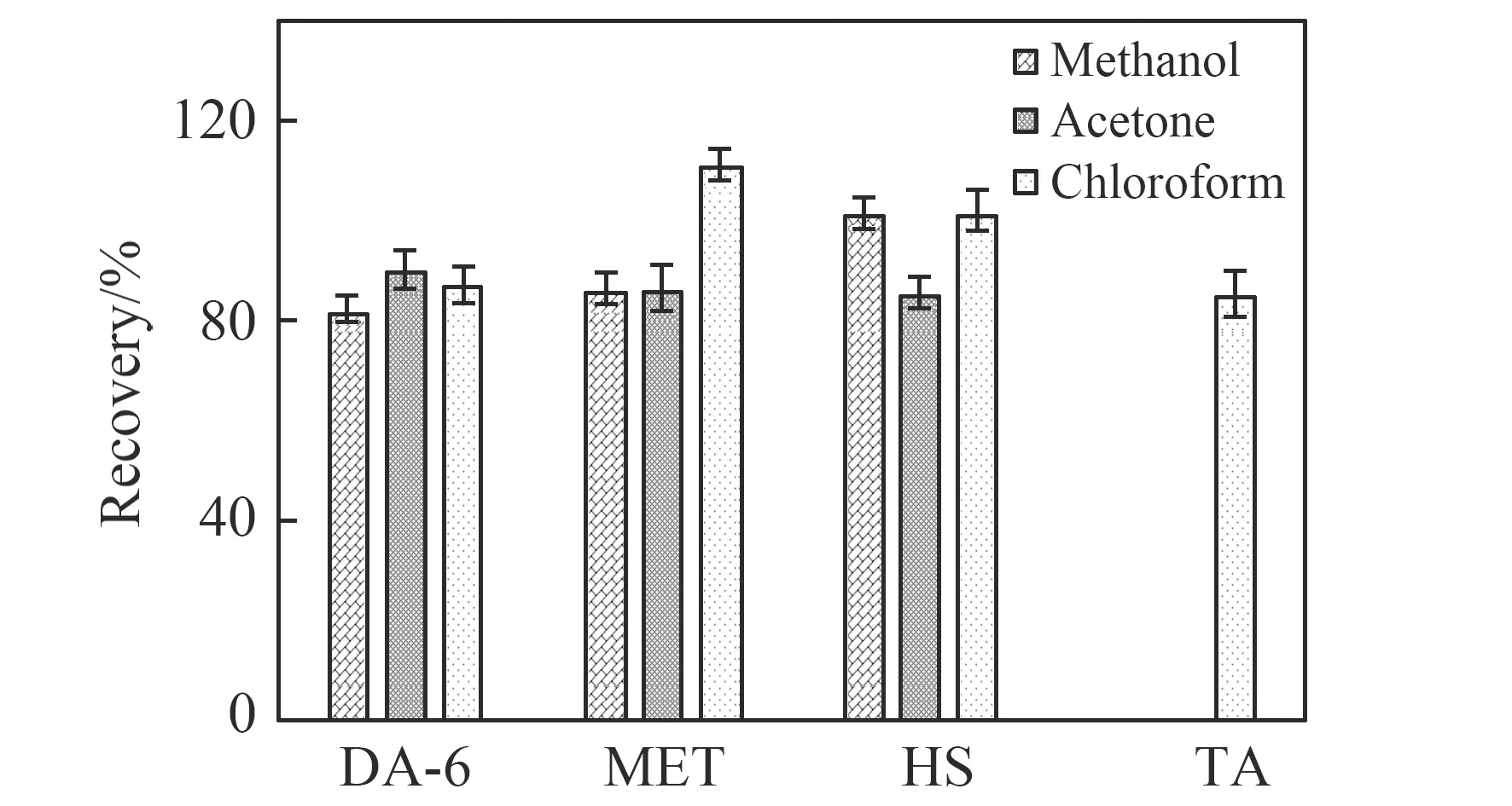
图2 不同提取溶剂对DA-6、MET、HS和TA的回收率Fig.2 Recoveries of different extraction solvents for DA-6,MET,HS and TA
NAA及SNA极性强,沸点高,直接用气相色谱检测会使高沸点组分残留从而影响检测准确性,为了增加其挥发性,本实验将NAA及SNA甲酯化后[12],利用气相色谱分析萘乙酸甲酯(Methyl Naphthalene-1-Acetate,MENA)的含量,间接检测NAA及SNA的含量。实验对提取溶剂进行了优化,比较正己烷与二氯甲烷溶剂,结果发现SNA在肥料中添加浓度60 mg/L 时,正己烷的响应值较二氯甲烷高(图3b),正己烷添加回收效果较二氯甲烷好(图3a)。进一步研究沸水回流与不回流条件对SNA回收率的影响,结果表明是否回流对结果无明显影响,因此实验选择正已烷不回流条件下提取SNA。
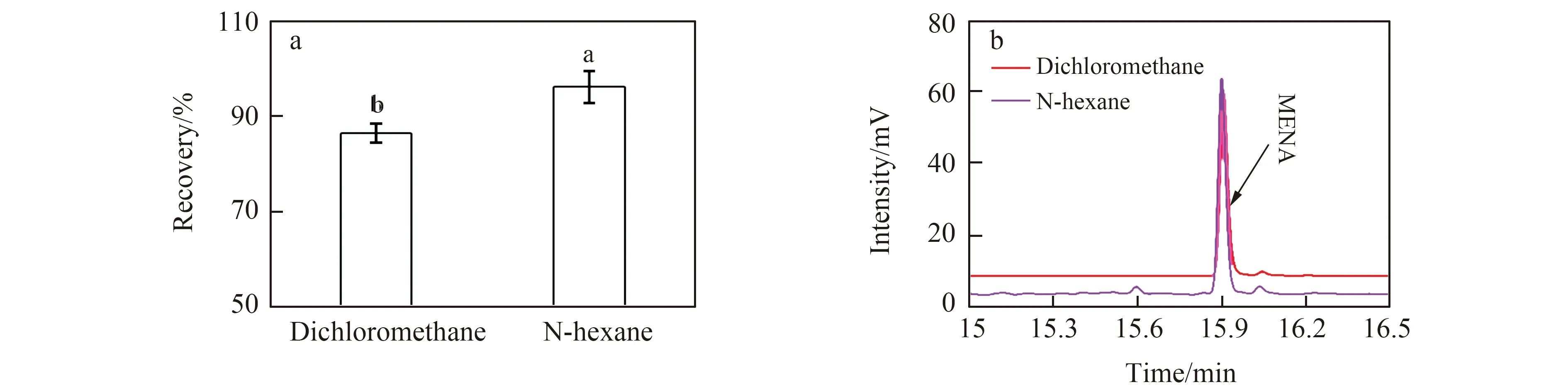
图3 SNA在不同提取溶剂的回收率(a)及色谱图(b)Fig.3 Recoveries(a) and chromatograms (b) of SNA at different extraction solvents
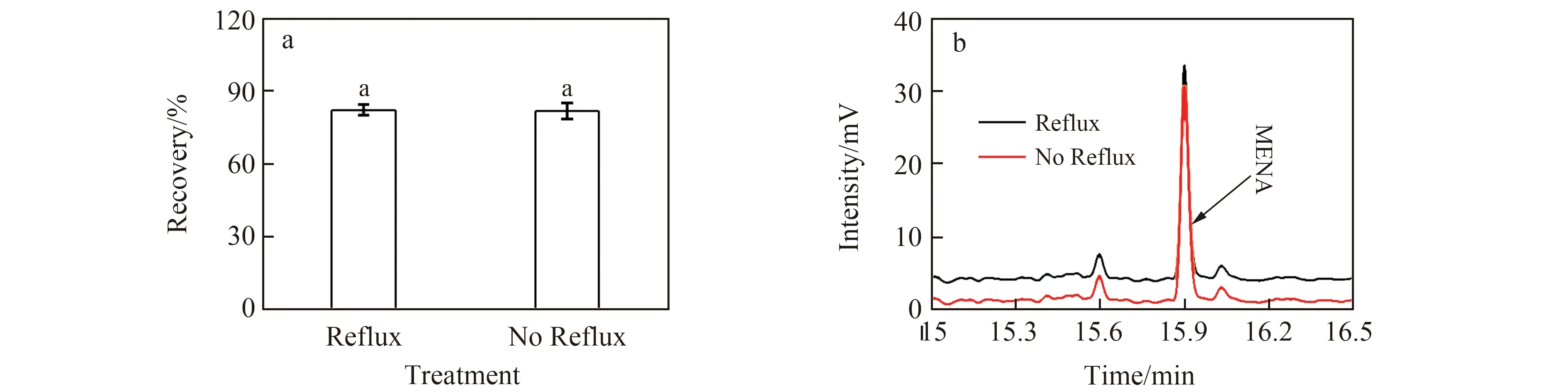
图4 SNA在不同提取条件的回收率(a)及色谱图(b)Fig.4 Recoveries (a) and chromatograms (b) of SNA at different extraction conditions
2.3 方法学考察
2.3.1 线性范围、检出限与定量限配制一系列不同浓度的混合标准工作溶液,按照“1.5”进行测定,以溶液浓度(x,mg/L)为横坐标,对应的色谱峰峰面积(y)为纵坐标作图,绘制标准工作曲线,6种PGRs的线性回归方程和线性相关系数如表1所示。
以低浓度基质加标进样分析,以信噪比(S/N)为3时的检测量为检出限(LOD),信噪比为10时的检测量为定量限(LOQ)[17],NAA、SNA、DA-6、HS、MET、TA的检出限分别为4、4、8、8、10、30 mg/kg;NAA、SNA、DA-6、HS、MET、TA的定量限分别为10、10、30、30、40、120 mg/kg(表1)。MET与DA-6在已有液相色谱文献[8]中的检出限分别为5、10 mg/kg,由此得出,气相色谱基本可以达到同等效果。
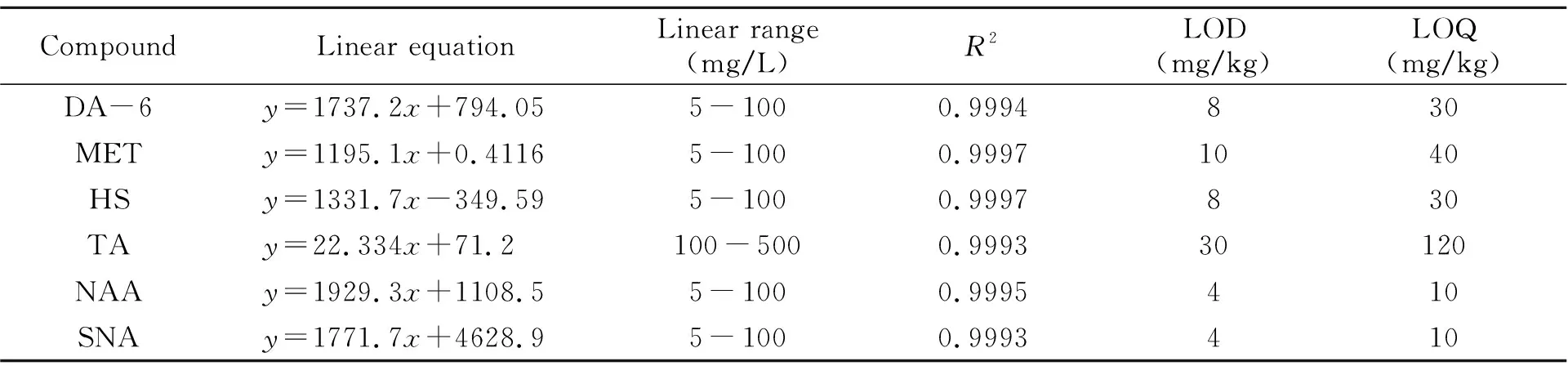
表1 6种植物调节剂的线性方程、线性范围和相关系数(R2)Table 1 Linear equation,linear range and correlation coefficients(R2) of 6 PGRs
2.3.2 准确度在空白肥料样品中,分别添加3 个水平浓度的混合标准溶液,然后按照“1.4”所述方法进行前处理后,按“1.5”色谱条件上机分析,考察方法的准确度,结果见表2。样品添加回收率范围在87.38%~108.75%之间,相对标准偏差(RSD)在1.15%~2.97%之间。回收率及相对标准偏差符合分析检测要求。

表2 6种植调剂在肥料样品中的加标回收率和相对标准偏差(n=3)Table 2 Spiked recovery and relative standard deviation(RSD) of 6 PGRs in fertilizer(n=3)
2.3.3 精密度分别取适宜浓度PGRs添加样品,按1.5所述色谱条件连续进样5次,其结果的RSD见表3,RSD在0.31%~1.49%范围内,表明仪器精密度良好。

表3 分析方法的精密度Table 3 Precision test results of analytical methods
2.3.4 重复性的测定采用同一空白样品,准确称取5个平行试样,分别添加适宜浓度的6种PGRs标准溶液,按“1.4”所述方法进行前处理,按“1.5”所述色谱条件下进行分析,结果见表4,相对标准偏差(RSD)在0.36%~2.72%范围内,方法重复性符合一般色谱方法验证的要求。
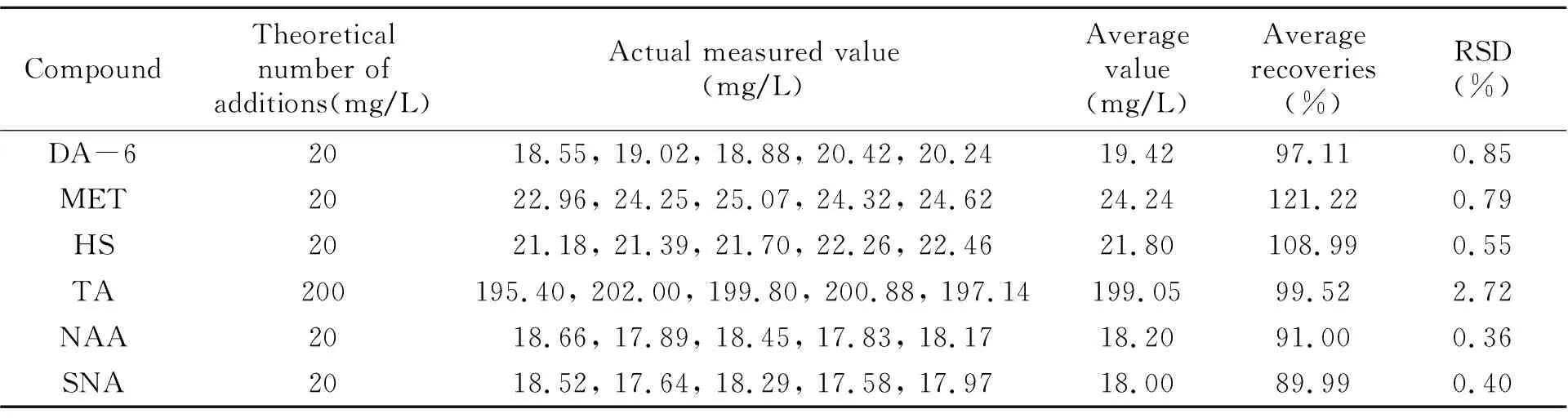
表4 分析方法的重复性Table 4 Repetitive experimental results of analytical methods
3 结论
本实验通过对色谱条件及提取溶剂的优化,建立了气相色谱同时检测肥料中NAA、SNA、DA-6、MET、HS及TA 6种植物生长调节剂的检测方法。该方法灵敏可靠,线性关系良好,R2均达到0.9993以上。准确度、精密度和重复性均满足方法学指标,而且操作简单,便于普及,为肥料中植调剂的测定提供了一种高效、可靠的分析手段。
