4-巯基苯硼酸功能化的金纳米溶胶用于细菌的快速SERS检测
2022-11-24沈爱国
刘 敏, 叶 勇, 沈爱国, 周 吉*
(1.湖北大学化学化工学院,湖北武汉 430062 2.武汉大学印刷与包装系,湖北武汉 430072)
为了保障食品安全和公共卫生安全,快速、准确地检测病原体细菌是一个高度热门的研究方向。细菌的传统检测方法包括染色、微生物培养[1]、酶联免疫吸附(ELISA)[2]和聚合酶链反应(PCR)[3]等技术。但是这些方法具有耗时、复杂的样品预处理过程、昂贵设备和专业技能要求等缺点,严重限制了它们在细菌现场检测中的应用。因此,需要发展快速可靠的细菌现场检测技术。表面增强拉曼散射(SERS)技术可以实现对细菌的快速、灵敏检测,已成为人们研究的热点[4,5]。目前细菌的SERS检测方法可以分为两类:无标记SERS方法和标记SERS方法。无标记SERS方法具有灵敏度低、选择性差、易受环境干扰等缺点,限制了其在细菌检测中的应用。而标记SERS方法具有以下优点:(1)灵敏度高,可检测低浓度细菌;(2)操作简单,无需复杂的样品前处理过程;(3)具有特异性识别细菌的能力,可实现多种细菌的同时检测;(4)SERS基底可以提供较高的SERS活性,实现对细菌的定量检测[6 - 12]。
4-巯基苯硼酸(4-MPBA)是双官能小分子,它含有两个官能团:巯基基团,能与Ag或Au结合形成Ag-S键和Au-S键,使得拉曼信号增强;硼酸基团,能通过硼酸与细菌细胞壁中存在的肽聚糖结合形成环状硼酸酯,达到识别细菌的目的。4-MPBA因其具有简明的指纹拉曼光谱,低成本和普适性的优点,引起人们广泛的兴趣[13 - 15]。本文采用经典柠檬酸钠还原法制备金纳米粒子(AuNPs)溶胶作为SERS基底,使用4-MPBA作为拉曼报告分子以及细菌识别元件来功能化AuNPs。基于细菌抑制盐诱导聚集的检测机制,通过检测4-MPBA的拉曼信号变化间接检测细菌,构建了一种细菌的标记SERS检测方法。此外,选择革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌作为检测对象,证明了其检测广谱细菌的能力。饮用水样品中的加标回收实验结果与平板培养法相近,表明本方法具有良好的准确度,在实际样品检测中具有潜在的应用价值。
1 实验部分
1.1 仪器与试剂
紫外可见分光光度计(UV-2550,日本岛津);共聚焦显微拉曼光谱仪(In Via,英国雷尼绍);透射电子显微镜(JEM-2100,日本JEOL公司);傅里叶变换红外光谱仪(Cary600,安捷伦科技有限公司);便携拉曼光谱仪(Portman633,上海如海光电);高速离心机(TG16-11,长沙平凡仪器表有限公司);微型混匀仪(MX-S,北京大龙仪器);真空干燥箱(DZF-6020,上海精宏实验设备有限公司);高压灭菌锅(YM30Z,上海三申医疗器械有限公司)。
三水合氯金酸(HAuCl4·3H2O,Au 23.5%~23.8%)和4-巯基苯硼酸(4-MPBA,分析纯)购自阿拉丁试剂公司;柠檬酸三钠(C6H5Na3O7,99%)购自西格玛奥德里奇试剂公司;大肠杆菌(E.coil,ATCC 8739)和金黄色葡萄球菌(S.aureus,ATCC 91093)由武汉大学保藏中心提供。KOH、NaCl、乙醇均为分析纯,购自国药化学试剂公司。实验所用去离子水(18.2 MΩ·cm)来自Milli-Q纯化系统。
所有玻璃器皿和磁力搅拌子均用王水浸泡,去离子水反复冲洗,烘箱干燥后使用。
1.2 金纳米粒子的合成
向250 mL圆底烧瓶中加入100 mL去离子水,然后加入1 mL 29.9 mmol/L的HAuCl4溶液,加热至微沸,迅速加入1.8 mL 38.8 mmol/L柠檬酸三钠溶液,冷凝回流并继续加热20 min后,停止加热继续搅拌,自然冷却至室温。在进一步功能化之前,AuNPs保存在4 ℃冰箱中处。
1.3 4-巯基苯硼酸功能化金纳米粒子
取100 mL AuNPs于圆底烧瓶,加入1.8 mL浓度0.1 mmol/L的4-MPBA乙醇溶液,缓慢搅拌2 h。4-MPBA与AuNPs自组装形成Au-S键进而得到4-MPBA@AuNPs。将4-MPBA@AuNPs以3 000 r/min转速离心1 h,除去上清液,并将浓缩胶体重新分散在pH=9.2的KOH溶液中。
1.4 细菌培养
实验选择两个典型的常见致病菌菌株(革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌)作为实验菌株,均采用LB培养基进行培养。将细菌放在转速为100 r/min的37 ℃恒温培养箱中培养24 h。根据平板计数结果,首先将细菌溶液稀释至107CFU/mL,以4 000 r/min转速离心两次,离心时间为10 min,将细菌重悬浮至pH=9.2的KOH溶液中,然后依次稀释得到10 CFU/mL~106CFU/mL细菌溶液。
1.5 细菌检测
将250 μL不同浓度(0 CFU/mL~105CFU/mL)的细菌溶液分别与250 μL 4-MPBA@AuNPs混合,在37 ℃下振荡孵育30 min。加入16 μL 1 mol/L NaCl后,涡旋5 s,然后用633 nm便携拉曼光谱仪采集每个样品的拉曼光谱,每个样品测试10次取平均值。细菌浓度为0 CFU/mL时,4-MPBA@AuNPs在1 070 cm-1处所测得的拉曼强度,定为I0;细菌浓度为10 CFU/mL~105CFU/mL时,4-MPBA@AuNPs在1 070 cm-1所测得的拉曼强度,定为Ii。拉曼采集条件为:激光633 nm,激光功率50 mW, 扫描范围400~1 800 cm-1,积分时间15 s。
2 结果与讨论
2.1 材料表征
采用透射电子显微镜(TEM)表征AuNPs的微观结构,AuNPs的透射电镜图如图1A、B所示,所制备的AuNPs为类球形,其尺寸约为19.5±1.5 nm。
采用紫外-可见吸收光谱对AuNPs和4-MPBA@AuNPs进行了表征。如图1C所示,AuNPs的紫外-可见吸收峰在522 nm处,4-MPBA@AuNPs的紫外-可见吸收峰在524 nm。采用红外光谱进一步验证4-MPBA@AuNPs的形成,如图1D所示,3 430 cm-1为硼酸羟基的吸收峰,1 630 cm-1为苯环振动的吸收峰,与文献报道结果一致[16]。表明4-MPBA成功功能化AuNPs。

图1 (A)AuNPs的透射电子显微镜(TEM)图;(B)AuNPs的尺寸分布;(C)AuNPs和4-MPBA@AuNPs的紫外-可见吸收光谱(UV-vis)图;(D)4-MPBA@AuNPs的傅里叶变换红外光谱(FT-IR)图;(E)AuNPs和4-MPBA@AuNPs的拉曼光谱(Raman)图;(F)4-MPBA@AuNPs的拉曼位移和谱峰归属Fig.1 (A)Transmission electron microscope(TEM)image of AuNPs;(B)Size distribution of AuNPs;(C)Ultraviolet visible(UV-vis)absorption spectra of AuNPs and 4-MPBA@AuNPs;(D)Fourier transform infrared spectrum(FT-IR)of 4-MPBA@AuNPs;(E)Raman spectra of AuNPs and 4-MPBA@AuNPs;(F)Raman shift and peak assignment of 4-MPBA@AuNPs
此外,实验比较了AuNPs和4-MPBA@AuNPs的拉曼信号。如图1E、F所示,4-MPBA@AuNPs在994 cm-1、1 017 cm-1、1 570 cm-1和1 581 cm-1均有较强的拉曼信号,它们分别归属于4-MPBA的苯环骨架的C=C面内弯曲振动、C-H面内弯曲振动、非对称的C-C伸缩振动以及完全对称的C-C伸缩振动,4-MPBA@AuNPs在1 070 cm-1处有强拉曼信号,它归属于4-巯基苯硼酸的苯环骨架的C=C面内弯曲振动和C-S伸缩振动的耦合振动,与文献报道结果一致[17]。以上结果表明实验成功合成了4-MPBA@AuNPs。
2.2 检测原理与可行性分析
4-MPBA@AuNPs检测细菌的原理如图2所示,4-MPBA通过巯基与AuNPs化学键合,形成了4-MPBA@AuNPs探针。该探针的SERS光谱在1 070 cm-1出现明显的4-MPBA特征峰。研究表明,高浓度的NaCl可以诱导金属胶体的聚集,在颗粒间隙产生大量的表面增强拉曼散射热点,从而产生显著的增强效应[18]。当体系中加入NaCl时,NaCl会诱导4-MPBA@AuNPs的聚集,导致4-MPBA的拉曼信号强度显著增强;但在体系中存在细菌的情况下,细菌细胞壁上肽聚糖的顺式二醇基团可以与4-MPBA@AuNPs的硼酸基团形成共价键,将4-MPBA@AuNPs固定在细菌表面,由于细菌处于微米尺度,将4-MPBA@AuNPs固定在细菌表面会抵抗高浓度NaCl引起的聚集,4-MPBA的拉曼信号强度没有显著增强。随着细菌浓度的增加,与细菌结合的4-MPBA@AuNPs增多,体系中游离的4-MPBA@AuNPs减少,当体系中加入NaCl后,4-MPBA的拉曼信号强度逐渐减弱。4-MPBA的特征峰1 070 cm-1的拉曼信号强度的变化((I0-Ii)/I0)和细菌浓度之间的关系作为细菌定量分析的依据。

图2 4-MPBA@AuNPs检测细菌的原理图Fig.2 Schematic diagram of bacterial detection by 4-MPBA@AuNPs
为了证明检测原理的可行性,对不同状态下的4-MPBA@AuNPs进行了TEM表征。如图3所示,图3A中4-MPBA@AuNPs是均匀分散状态,溶液颜色为酒红色;图3B中4-MPBA@AuNPs在加入NaCl后,呈聚集状态,溶液颜色为紫色;图3C中4-MPBA@AuNPs因与大肠杆菌结合,呈相对分散状态,溶液颜色为酒红色;图3D中与大肠杆菌结合的4-MPBA@AuNPs,加入NaCl后仍呈现相对分散状态溶液,颜色为酒红色。上述实验结果表明,本方法具有一定的可行性,可用于细菌的检测。
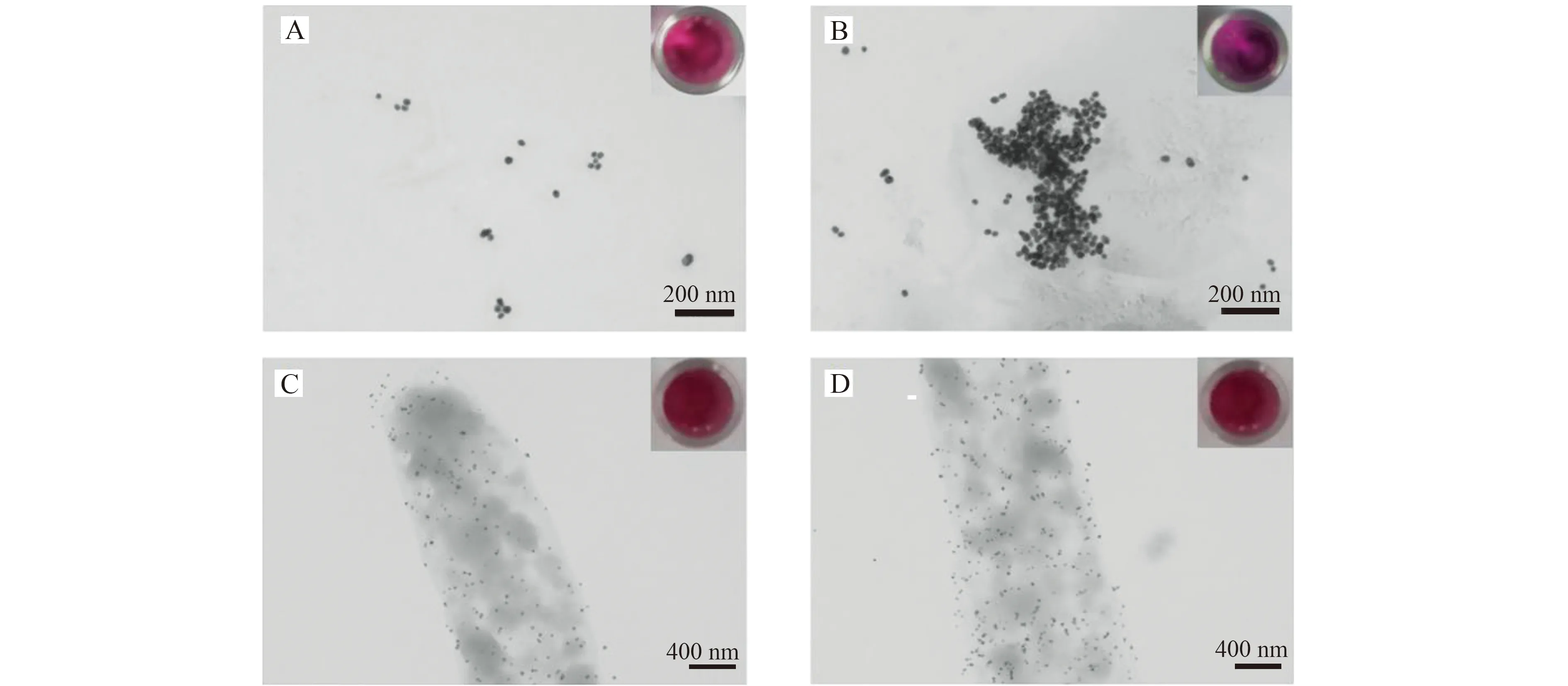
图3 4-MPBA@AuNPs的TEM表征:(A)4-MPBA@AuNPs;(B)加入NaCl后的4-MPBA@AuNPs;(C)与大肠杆菌结合的4-MPBA@AuNPs;(D)加入NaCl后与大肠杆菌结合的4-MPBA@AuNPsFig.3 TEM characterization of 4-MPBA@AuNPs:(A)4-MPBA@AuNPs;(B)4-MPBA@AuNPs after NaCl addition;(C)4-MPBA@AuNPs bound to E.coli (D)4-MPBA@AuNPs bound to E.coli after NaCl addition
2.3 检测条件的优化
2.3.1 4-MPBA的用量4-MPBA的用量对AuNPs溶胶的稳定性有直接影响。如图4A所示,当4-MPBA 的体积从18 μL增加到24 μL时,4-MPBA@AuNPs在1 070 cm-1处的拉曼信号强度逐渐增高,这可能是因为随着4-MPBA含量的增加,金纳米粒子表面双电层变化引起纳米粒子的聚集,聚集产生的热点导致SERS信号的增强[17]。当加入4-MPBA的体积为18 μL时,4-MPBA@AuNPs在1 070 cm-1处的拉曼信号强度最弱,表明此时4-MPBA@AuNPs的分散性最好。结果表明,4-MPBA的最优用量为1 mL 的AuNPs中加入18 μL 0.1 mmol/L的4-MPBA,以获得均匀分散的4-MPBA@AuNPs。
2.3.2 NaCl的用量纳米粒子的聚集程度与NaCl的加入量有关,为了获得较好的拉曼增强效果,进一步优化了1 mol/L NaCl溶液的用量。如图4B所示,当NaCl溶液的体积从12 μL增加到16 μL时,4-MPBA@AuNPs在1 070 cm-1处的拉曼信号强度逐渐增强,体积为16 μL时,拉曼信号强度最强;继续增加的NaCl溶液用量,4-MPBA@AuNPs在1 070 cm-1处的拉曼信号强度逐渐降低,这是因为过量的NaCl会导致4-MPBA@AuNPs沉淀并失去它们的增强作用。因此,16 μL被认为是NaCl的最优用量。
2.2.3 4-MPBA@AuNPs与细菌的孵育时间细菌与4-MPBA@AuNPs的孵育时间是影响实验结果的一个关键因素。如图4C所示,在10 min~30 min的时间范围内,4-MPBA@AuNPs在1 070 cm-1处的拉曼信号强度逐渐降低,到30 min时,到达一个平台。当孵育时间较短时,细菌无法与4-MPBA@AuNPs充分结合,游离的4-MPBA@AuNPs较多,加入NaCl后,导致4-MPBA@AuNPs聚集。因此,选择30 min作为4-MPBA@AuNPs与细菌的最优孵育时间。

图4 实验条件优化:(A)4-MPBA的用量(拉曼采集条件为:Renishaw-In Via共聚焦显微拉曼光谱仪,激光633 nm,10倍镜头,激光功率20 mW,动态扫描,扫描范围:400~1 800 cm-1);(B)氯化钠的用量;(C)4-MPBA@AuNPs与细菌的孵育时间。(拉曼采集条件为:如海光电便携拉曼光谱仪,激光633 nm,激光功率50 mW扫描范围:400~1 800 cm-1,积分时间15 s)Fig.4 Experimental conditions optimization:(A)Amount of 4-MPBA(Raman acquisition condition:Renishaw-In Via confocal microscopy Raman spectrometer,laser 633 nm,10 times lens,laser power 20 mW,dynamic scanning,scanning range:400 - 1 800 cm-1);(B)Amount of sodium chloride;(C)Incubation time of 4-MPBA@AuNPs with bacteria.(Raman acquisition conditions:RuHai photolectronics portable Raman spectrometer,laser 633 nm,laser power 50 mW scanning range:400 - 1 800 cm-1,integration time 15 s)
2.4细菌检测
在优化实验条件下,考察该检测方法的分析性能。如图5A所示,在0 CFU/mL~105CFU/mL浓度范围内,4-MPBA@AuNPs在1 070 cm-1处的拉曼信号强度随着细菌浓度的增加而逐渐降低。绘制了(I0-Ii)/I0随细菌浓度对数lgcE.coil的变化曲线,并对其进行了线性拟合,如图5B所示。线性范围为10 CFU/mL~105CFU/mL,定量检测限10 CFU/mL,线性回归方程为y=0.1183x-0.08,相关系数(R2)为0.982。如表1所示,与目前报道的一些细菌检测方法相比,本方法的线性范围和检出限都表现出一定的优势。
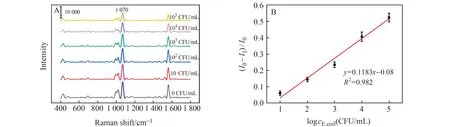
图5 (A)不同浓度的大肠杆菌与4-MPBA@AuNPs孵育在加入NaCl后的拉曼图谱;(B)SERS定量检测大肠杆菌的标准曲线Fig.5 (A)Raman spectra of E.coli at different concentrations incubated with 4-MPBA@AuNPs after adding NaCl;(B)Standard curve of SERS quantitative detection of E.coli

表1 不同细菌检测方法的对比Table 1 Comparison of different bacterial detection methods
2.5 检测广谱细菌的能力
为了考察这种方法检测广谱细菌的能力,本文选择两个典型的致病菌菌株革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌作为实验菌株进行了测试。如图6所示,没有加入细菌时,4-MPBA@AuNPs在1 070 cm-1处的拉曼信号强度最强。加入金黄色葡萄球菌的4-MPBA@AuNPs低于加入大肠杆菌的4-MPBA@AuNPs在1 070 cm-1的拉曼强度。这是因为革兰氏阳性细菌的细胞壁所含的肽聚糖高于革兰氏阴性细菌的细胞壁所含的肽聚糖,所以金黄色葡萄球菌所能结合的4-MPBA@AuNPs多于大肠杆菌所能结合的4-MPBA@AuNPs。实验结果表明所提出的策略可以检测广谱细菌。

图6 分别加入浓度为105 CFU/mL大肠杆菌和金黄色葡萄球菌的4-MPBA@AuNPs溶液在1 070 cm-1的拉曼强度Fig.6 Raman intensity of 4-MPBA@AuNPs solution with the concentration of 105 CFU/mL E.coli and S.aureus at 1 070 cm-1
2.6 实际样品检测
为了验证该检测方法在实际样品中的应用,将本实验所建立的细菌检测方法用于饮用水样品的检测并进行加标回收实验。饮用水样品检测结果如图7所示。分别使用本方法和传统的平板培养法对不同浓度的细菌进行检测,并对得到的结果进行比较,计算回收率。结果如表2所示,本方法检测结果与平板培养法相近,加标回收率为89.2%~103.8%,相对标准偏差小于4.7%,表明本方法检测结果具有良好的准确度,对实际样品中细菌的检测有适用性。

图7 检测饮用水样品中细菌数量的拉曼图Fig.7 Raman graph for detecting the number of bacteria in drinking water samples
3 结论
在本工作中,介绍了一种灵敏、快速、低成本、操作简单的检测细菌方法。采用经典柠檬酸钠还原法制备金纳米粒子(AuNPs)溶胶作为SERS基底,使用4-巯基苯硼酸(4-MPBA)作为拉曼报告分子以及细菌识别元件来功能化AuNPs。基于细菌抑制盐诱导聚集的检测机制,通过检测4-MPBA拉曼信号的变化间接检测细菌,构建了一种细菌的标记SERS检测方法。此外,选择革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌作为检测对象,证明了其检测广谱细菌的能力。饮用水样品中的加标回收实验结果与平板培养法相近,表明本方法具有良好的准确度,在实际样检测上具有潜在的应用价值。
