miR-566与miR-1183靶向抑制RHD基因表达的研究*
2022-11-24张印则吴宗勇岳贺佳刘瑞琪蔡佩佩陈家倪杨翠红
王 琳,张印则,吴宗勇,岳贺佳,刘瑞琪,蔡佩佩,陈家倪,杨翠红,齐 军△
1.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院深圳医院输血科,广东深圳 518116;2.深圳大学总医院输血科,广东深圳 518055
Rh血型系统由1p34.3-1q36.1控制编码,有54种抗原,是仅次于ABO血型的具有重要临床意义的血型系统[1-2]。RhD蛋白在Rh血型系统中免疫原性最强,因此在临床输血及母婴同种免疫中起着重要作用[3]。D抗原的变异型包括“弱D”“部分D”“DEL型”等。其中“弱D”的特征是红细胞表面D抗原位点显著性减少,但其免疫反应性不变[4]。因此,明确“弱D”表型发生的分子机制,对于准确鉴定RhD血型,指导临床输血与预防新生儿溶血病等均有重要意义。有学者发现,大部分“弱D”表型与RHD基因结构相关[5],HOURIA等[6]认为“弱D”表型D抗原低水平是由于低水平RHD基因转录所致。
研究表明,微小RNA(miRNA)通过干预基因表达,可调节细胞的新陈代谢、分化、增殖、凋亡,其在基因的表达调控中起着重要的作用[7-8]。本研究以3例Rh“弱D”表型样本和6例RhD阳性样本为研究对象,通过生物信息学的方法筛选与调控RHD基因表达相关的miRNA,构建双荧光素酶报告基因载体,探索miRNA与RHD基因表达的关系,以期进一步研究“弱D”表型的分子机制与miRNA的关系。现报道如下。
1 材料与方法
1.1材料来源 6例RhD阳性及3例“弱D”表型血液样本均来源于深圳市血液中心,于-80 ℃冰箱保存备用。
1.2仪器与试剂 Dual-Gloluciferase Assay system(美国Promega公司,批号:0000129139);293T细胞株(深圳博奥康生物科技有限公司);NotI限制性内切酶(美国Thermo公司,批号:00155534)、XhoI限制性内切酶(美国Thermo公司,批号:00209345);质粒提取试剂盒(美国Omega公司,批号:00D6943020000C19O091);miRNA mimcs和miRNA mimics的空白对照(广州锐博生物科技有限公司);DMEM培养基(美国Gibco公司,批号:8116402);Lilpofectamine 2000(美国Invitrogen公司,批号:136719);SYBR®Premix Ex TaqTM(2×)[宝生物工程(大连)有限公司,批号:AK9204];primeSTAR HS(primix)[宝生物工程(大连)有限公司,批号:1603057];PrimeScriptTMRT reagent Kit反转录试剂盒[宝生物工程(大连)有限公司,批号:00382191];psicheck2 vector(美国Promega公司,批号:0000095842);miRNeasy Serum/Plasma kit(美国Qiagen公司,批号:154023933)。
1.3生物信息学预测调控RHD基因表达的miRNA 利用生物信息学软件TargetScan、PicTar和miRWalk,在线搜索可作用于RHD基因的miRNA,选择靶标率靠前的5个miRNA进行分析。
1.4双荧光素酶报告基因载体的构建
1.4.1引物 根据Pubmed Genebank ID 6007确定RHD基因3′-非编码区(3′-UTR),采用Oligo 8.0软件设计聚合酶链反应(PCR)引物,RHD-3UTR-F:CCCTCGAGCCGCCTGCATTTG-TACGTGAG;RHD-3UTR-R:GAATGCGGCCGCACAAGCACTGCCACGTTCAC(上海生工生物科技有限公司合成)。
1.4.2PCR合成RHD基因3′-UTR片段 以人基因组DNA为模板进行PCR扩增,反应体系为50 μL:2×primeSTAR HS(primix) 25 μL,模板100 ng,上游引物(100 μmol/L)0.4 μL,下游引物(100 μmol/L)0.4 μL,加双蒸水(ddH2O)至50 μL。设置PCR反应条件为:98 ℃变性10 s,55 ℃退火10 s,72 ℃延伸75 s,30个循环。
1.4.3载体构建 将上述PCR产物纯化后进行NotI/XhoI双酶切,与双荧光素酶报告基因载体psicheck2连接,然后转化至DH5α感受态细胞。随机挑取克隆放大培养后提取质粒DNA。
1.4.4酶切验证及测序 把提取的质粒DNA用NotI和XhoI做双酶切处理,用琼脂糖凝胶电泳验证RHD基因3′-UTR序列是否成功插入载体;选取酶切验证正确的克隆进行测序。
1.5报告基因载体与miRNA mimics共转染细胞 用DMEM培养基于37℃,5% CO2的条件下培养293 T细胞。96孔板,100微升/孔,1.5×104个/孔,培养24 h。取浓度为10 μmol/L的5个miRNA mimics和miRNA mimics的空白对照(miRNA-NC)各1 μL,分别与9 μL OPTI-MEM培养基混合;取100 ng/μL的靶基因3′-UTR报告基因载体2 μL,与13 μL OPTI-MEM培养基混合;取1 μL Lipofectamin 2000与24 μL OPTI-MEM培养基混合。5 min后三者混合,共50 μL。轻轻摇匀静置20 min,然后加至细胞内。做3个平行孔。转染48 h后加入底物,测定荧光值。
1.6实时荧光定量PCR(RT-qPCR)检测miRNA的表达 提取9个样本的RNA,将RNA反转录为cDNA,以cDNA为模板,荧光定量检测miRNA的表达量。正向引物为:miRNA566-GGGCGCCTGTGATCCCAAC,miRNA1183-CACTGTAGGTGATGGTGAGAGTG,miRNA1207-TGGCAGGGAGGC TGGGAG。20 μL反应体系:SYBR®Premix Ex TaqTM(2×) 10 μL,正向引物(10 μmol/L)0.4 μL,反向通用引物(10 μmol/L)0.4 μL,ROX Reference DyeⅡ 0.4 μL,cDNA模板 0.4 μL,ddH2O 8.4 μL。PCR反应条件为:94 ℃ 2 min,94 ℃ 12 s,60 ℃ 34 s,40个循环,每个样本及内参(U6)进行3次重复,阴性对照以ddH2O代替cDNA模板进行熔解曲线检测。miRNA相对表达量的计算采用2-ΔΔCt法计算。

2 结 果
2.1调控RHD基因表达的miRNA 生物信息学预测的靶标率靠前的5个调控RHD基因表达的miRNA分别为miR-566、miR-939、miR-1183、miR-1207和miR-1222。
2.2双荧光素酶报告基因载体的构建 成功构建了RHD基因3′-UTR双荧光素酶报告基因载体,将该报告基因载体命名为priR-RB-REPORT-RHD-3′-UTR。PCR合成的RHD基因3′-UTR序列,经琼脂糖凝胶电泳鉴定结果见图1,扩增片段1 200 bp与理论值相符。克隆后挑取6个单菌落经PCR验证,片段长度为1 200 bp,证明目的片段已成功插入载体,结果见图2。在6个单菌落中选取3个单菌落扩大培养提取质粒DNA,双酶切priR-RB-REPORT-RHD-3′-UTR,得到2个条带,RHD基因3′-UTR片段与预期大小相符,见图3。priR-RB-REPORT-RHD-3′-UTR的测序图显示其RHD基因3′-UTR序列与参考序列完全一致。
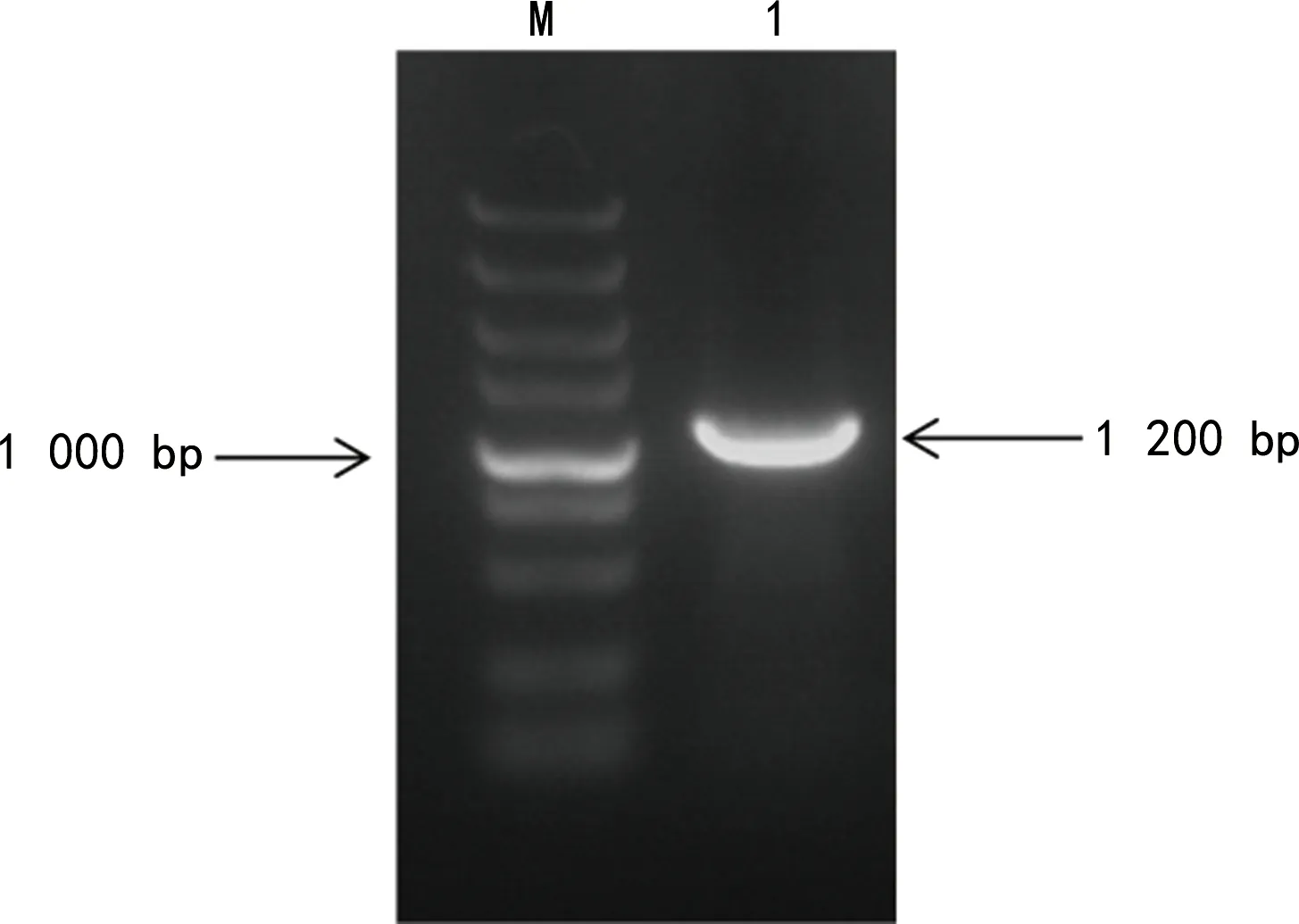
注:M为Marker;1为PCR扩增产物。
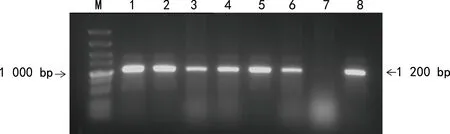
注:M为marker;1~6为6个菌落的PCR产物;7为阴性对照;8为阳性对照。
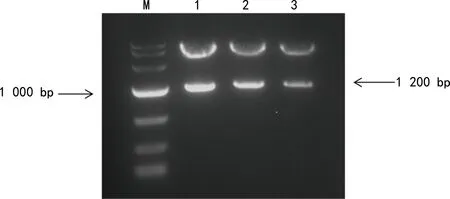
注:M为marker;1~3为priR-RB-REPORT-RHD-3′-UTR的双酶切产物。
2.3miRNA与RHD基因的靶点验证结果 priR-RB-REPORT-RHD-3′-UTR与miR-566、miR-939、miR-1183、miR-1207、miR-1222共转染细胞的相对荧光素酶活性分别为0.63±0.02、1.08±0.18、0.87±0.11、0.86±0.05、0.99±0.01。转染miR-566、miR-1183、miR-1207可以使priR-RB-REPORT-RHD-3′-UTR的相对荧光素酶活性较miRNA-NC分别降低37%、13%、14%(P<0.05),而miR-939与miR-1222没有使该载体的相对荧光素酶活性降低。见图4。

注:与miRNA-NC比较,*P<0.05。
2.4qRT-PCR定量测定miRNA的差异表达 双荧光素酶报告基因实验发现,miR-566、miR-1183和miR-1207对RHD基因3′-UTR有靶向作用,于是检测miR-566、miR-1183和miR-1207在RhD阳性及“弱D”表型样本中的相对表达量。结果显示,miR-566和miR-1183在“弱D”表型样本中的相对表达量明显高于RhD阳性样本(P<0.05),见图5。
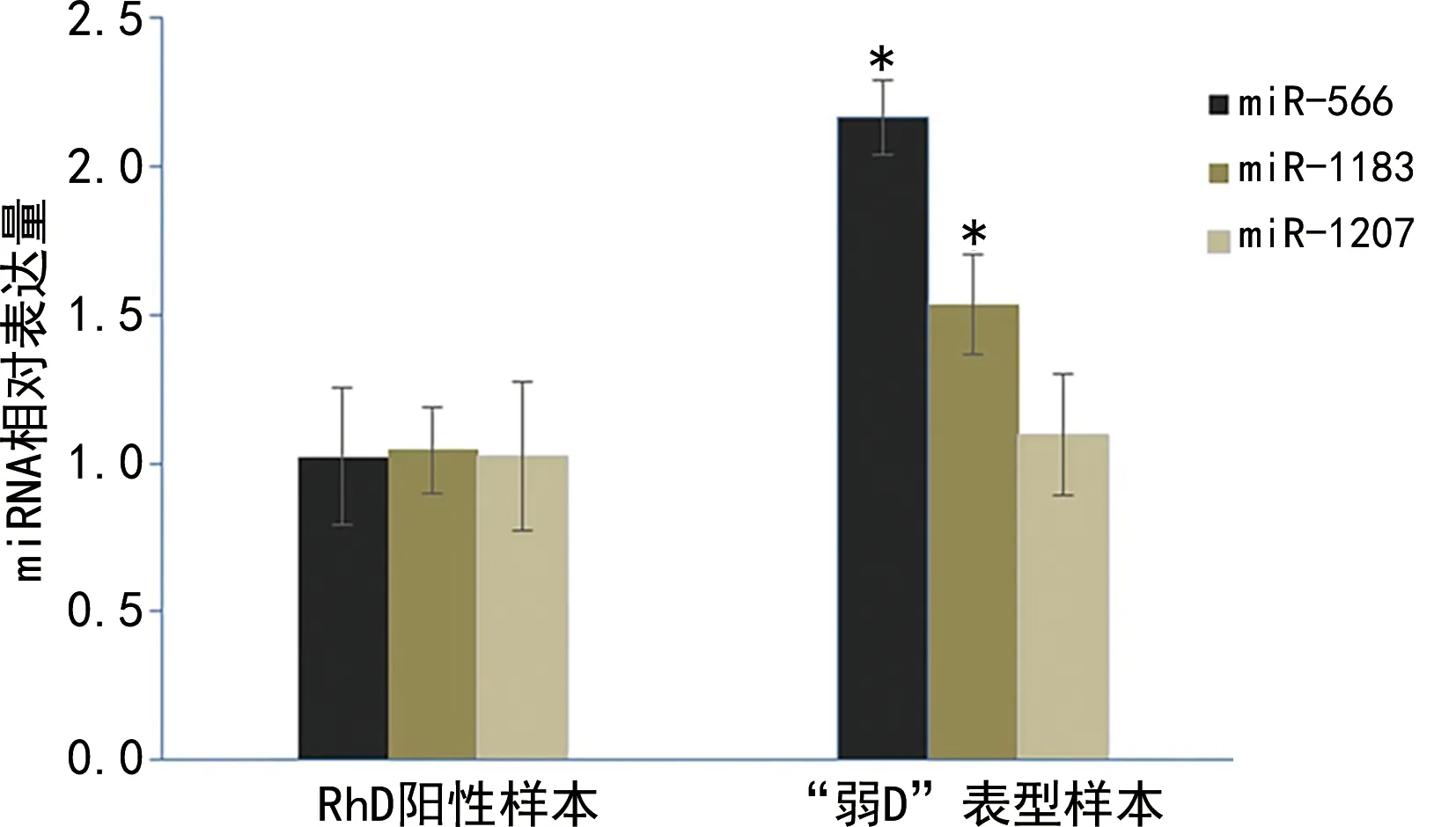
注:与RhD阳性样本比较,*P<0.05。
3 讨 论
miRNA是由20~25个核苷酸组成的非编码小分子RNA,它能通过碱基互补配对方式识别靶信使RNA(mRNA),并且根据互补程度的不同指导沉默复合体阻遏靶mRNA的翻译或者降解靶mRNA,进而发挥相应的生物学作用[9]。每个miRNA可以有多个靶基因,而几个miRNA也可以有同一个靶基因。这种复杂的调节网络既可以通过一个miRNA来调控多个基因的表达,也可以通过几个miRNA的组合来精细调控某个基因的表达。miRNA参与多种调节途径,包括发育、造血过程、病毒防御、脂肪代谢、器官形成、细胞增殖和凋亡等[10]。
Rh血型系统是人类红细胞血型系统中最复杂、最重要也是最富有多态性的一个系统,D抗原是人RHD基因表达的最重要的抗原。RHD基因变异较多,其中“弱D”是其编码D抗原数量较少[11-12]。miRNA可以通过部分互补结合到目的mRNA的3′-UTR,以一种未知方式诱发蛋白质翻译抑制,进而抑制蛋白质合成,因而可能成为调控Rh血型系统的“弱D”表型表达的关键分子。
本研究利用生物信息学方法分析预测潜在靶向调节RHD基因表达的miRNA。在此基础之上,笔者构建了RHD基因3′-UTR双荧光素酶报告基因载体priR-RB-REPORT-RHD-3′-UTR,将预测的miR-566、miR-939、miR-1183、miR-1207、miR-1222和priR-RB-REPORT-RHD-3′-UTR共转染293 T细胞,研究其相对荧光素酶活性变化。结果表明,miR-566能使priR-RB-REPORT-RHD-3′-UTR的相对荧光素酶活性降低37%,对其有明显的抑制作用(P<0.05),miR-1183、miR-1207亦使priR-RB-REPORT-RHD-3′-UTR的相对荧光素酶活性分别降低13%(P<0.05)和14%(P<0.05),说明miR-566、miR-1183和miR-1207潜在靶向调控RHD基因3′-UTR。于是笔者在RhD阳性及“弱D”表型两组样本中检测了miR-566、miR-1183、miR-1207的表达,发现miR-566和miR-1183在“弱D”表型样本中的相对表达量明显高于RhD阳性样本(P<0.05)。因而推测miR-566、miR-1183能下调RHD基因的表达,这可能是使Rh血型系统“弱D”表型出现的相关分子机制。但为什么miR-1207在“弱D”表型和RhD阳性样本中的相对表达量差异无统计学意义还有待进一步研究[13]。此外,有报道称,miR-566通过调控WNT6而影响乳腺癌的进展[14];而miR-1183对胶质瘤细胞可能存在调控作用[15]。
miR-566与miR-1183在“弱D” 和RhD阳性标本中的相对表达量的显著差异,为在miRNA水平研究Rh血型中“弱D”表型的分子机制奠定了基础,同时为RhD阳性与“弱D”表型间的鉴别提供了新的分子检测方法。
综上所述,本研究成功构建了RHD基因3′-UTR的双荧光素酶报告基因载体,同时初步证明RHD基因的3′-UTR与miR-566、miR-1183和miR-1207有结合靶点,且在“弱D”表型样本中发现miR-566和miR-1183的高表达,初步证明了miR-566和miR-1183能调控RHD基因的表达,为进一步研究调控RHD基因表达的分子机制提供了理论依据。
