定量检测抗甲状腺球蛋白抗体的磁微粒吖啶酯化学发光免疫检测方法的建立与初步应用
2022-11-24朱俊辉刘凤林
朱俊辉,韩 东,刘凤林,韦 妮
1.山东朱氏药业集团有限公司临床诊断试剂开发部,山东菏泽 274000;2.山东省食品药品审评查验中心,山东济南 250000;3.山东省菏泽市单县东大医院检验科,山东菏泽 274000
抗甲状腺球蛋白抗体(TgAb)是一种抗甲状腺自身抗体,属于一种碘化糖蛋白,主要由甲状腺上皮细胞合成与分泌,其异常增高常见于甲状腺癌、结节性甲状腺肿和自身免疫性甲状腺疾病等[1-3]。TgAb是甲状腺癌的独立预测因子,不仅对预测甲状腺癌发生风险有着重要作用,TgAb水平的变化也可用于反映甲状腺癌患者的治疗效果[4-5]。相比于常规的影像学检测或穿刺活检,血清TgAb检测临床接受程度更高,患者经济负担更小,其已成为临床检测甲状腺疾病的常用指标[6]。对于血清TgAb水平检测方法,传统方法为放射免疫分析法,近年来化学发光免疫检测法以其高灵敏度、高准确性、无放射污染等优点得到了快速发展与应用[7-8]。因此,本研究拟建立一种定量检测血清中TgAb水平的吖啶酯化学发光免疫检测方法,评估其检测性能,建立参考区间,并与临床常用检测试剂盒比对,以期为血清TgAb水平的高灵敏度、方便快捷检测提供更多选择。
1 资料与方法
1.1一般资料 选取菏泽市单县东大医院体检科120例健康人血清样本,其中男65例,女55例;年龄28~55岁,平均(39.26±10.27)岁。另选取菏泽市单县东大医院60例TgAb水平异常偏高的血清样本,其中男21例,女39例;年龄25~55岁,平均(36.26±10.27)岁。
1.2仪器与试剂 羧基磁微粒购自杭州博岳生物技术有限公司(产品号M1000C);抗人TgAb国家标准品购自国家药品标准物质网(产品号150556);吖啶酯购自赫利森(厦门)生物科技有限公司(产品号HS-11015006);人甲状腺球蛋白抗原购自美国Meridian bioscience.Inc公司(产品号H6T08-275);鼠抗人IgG抗体购自菲鹏生物股份有限公司(产品号抗人IgG-6);1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC,产品号22980)及N-羟基琥珀酰亚胺(NHS,产品号24500)购自美国Thermo公司。化学发光检测仪(产品号SMART500S)购自重庆科斯迈生物科技有限公司。发光底物(含预激发液和激发液)购自美国雅培Abott公司(产品号6E23-82和产品号6C55-82)。TgAb检测试剂盒(化学发光法)购自瑞士罗氏公司(国械注进20182402107)。其他试剂为实验室常用试剂,均购自生工生物工程(上海)有限公司。
1.3检测方法
1.3.1鼠抗人IgG抗体-吖啶酯发光试剂的制备 将鼠抗人IgG抗体与吖啶酯偶联,以制备鼠抗人IgG抗体-吖啶酯发光试剂。具体步骤为:按照2∶1的质量比,取鼠抗人IgG抗体与吖啶酯充分混匀,常温下振荡偶联0.5 h,透析法去除游离的吖啶酯,过凝胶层析柱(Sephadex G50)纯化,收集发光强度高的流出液,即为鼠抗人IgG抗体与吖啶酯交联发光试剂,用发光稀释液[0.01 mol/L磷酸盐缓冲液(PBS)+0.05%聚乙二醇辛基苯基醚(Triton X-100)+5%海藻糖+0.2%酪蛋白+0.5% Proclin300]稀释,避光放置于4 ℃下备用。
1.3.2人甲状腺球蛋白抗原-磁微粒偶联物的制备 采用经典的EDC/NHS方法活化羧基磁微粒后再与人甲状腺球蛋白抗原进行偶联。具体步骤为:洗涤缓冲液(0.05 mol/L吗啉磺酸,pH 6.0)洗涤羧基磁微粒数次后,加入等量的EDC和NHS,常温下振荡活化40 min;洗涤缓冲液洗涤4次后,按照抗体与磁微粒质量比1∶20加入人甲状腺球蛋白抗原,室温振荡反应5 h。经封闭缓冲液[0.05 mol/L三羟甲基氨基甲烷(Tris)+2%牛血清清蛋白+0.05% Triton X-100+0.5% Proclin300]封闭2 h后,洗涤缓冲液洗涤后得到人甲状腺球蛋白抗原-磁微粒偶联物,用微球稀释液[0.05 mol/L Tris+3%牛血清清蛋白+0.05% Triton X-100+5%海藻糖+1%氯化钠+0.2% Proclin300]溶解,放置于4 ℃冰箱中备用。
1.3.3检测步骤 检测前,按照优化的条件,设置好化学发光检测仪上的各参数(如各试剂加入量、洗涤次数、反应时间等),进行全自动化检测。实际步骤为:取60 μL人甲状腺球蛋白抗原-磁微粒偶联物,分别加入40 μL的抗人TgAb国家标准品或人血清样本和100 μL鼠抗人IgG抗体-吖啶酯发光试剂,设备内37 ℃温育反应20 min,外加磁场促使磁微粒及其磁微粒偶联物聚集到试管底部,轻轻洗涤磁微粒以去除未结合物质和杂质,分别加入100 μL的发光底物激发液和预激发液后,全自动化学发光仪检测吖啶酯光子的相对光强度(RLU)。上述检测步骤均在全自动化学发光检测仪上进行,只需设好程序及放好样本即可。样本中的TgAb水平与收集到的RLU呈正相关,通过检测系列抗人TgAb国家标准品绘制标准曲线,利用标准曲线可计算得出待测样品中TgAb水平。
1.3.4试剂盒组装 试剂盒由鼠抗人IgG抗体-吖啶酯发光试剂、人甲状腺球蛋白抗原-磁微粒偶联物、抗人TgAb国家标准品制备成冻干粉、标准曲线信息卡、说明书等组成。鼠抗人IgG抗体-吖啶酯发光试剂分装在棕色试剂管中,10毫升/管。人甲状腺球蛋白抗原-磁微粒偶联物混匀分装于试剂管中,6毫升/管。系列浓度(0、1、10、100、500、2 000 IU/mL)的抗人TgAb国家标准品制备成冻干粉,使用时加入0.5 mL 双蒸水复融。将分装好的试剂贴好标签,注明名称、批号、保存期限等信息,组装于试剂盒中,置于2~8 ℃中储存。
1.4检测性能评估
1.4.1检测线性范围与灵敏度 参考《临床化学设备线性评价指南:WS/T408-2012》[9],使用0.3%酪蛋白缓冲液(溶剂用PBS)将抗人TgAb国家标准品稀释成系列浓度(0、1、10、100、500、2 000 IU/mL),采用本试剂盒检测抗人TgAb国家标准品系列浓度的RLU,每个浓度重复测定3次,计算平均值。以抗人TgAb国家标准品系列浓度的对数值作为横坐标,以对应RLU的对数值为纵坐标,进行标准曲线的绘制与拟合。
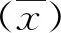

1.4.3特异性实验 采用本实验制备的试剂盒分别检测200 IU/mL TgAb、1 000 mg/dL的IgG、100 ng/mL人血清清蛋白、100 ng/mL胆红素、100 ng/mL血红蛋白、100 ng/mL肿瘤坏死因子-α(TNF-α)和100 ng/mL癌胚抗原(CEA)样本,以评估该试剂盒的特异性。
1.5与临床检测常用试剂盒比对 分别用本试剂盒和瑞士罗氏公司的TgAb检测试剂盒(化学发光法)平行测定60例血清样本,本试剂盒检测得到的TgAb水平值作为横坐标,瑞士罗氏公司的试剂盒检测得到的TgAb水平值作为纵坐标,绘制相关性曲线并计算相关系数(r)。
1.6健康人群参考区间的建立 对120例健康人血清样本进行检测,参考区间的建立采用百分位数法。
1.7统计学处理 数据处理及分析采用SPSS19.0软件。用非参数检验方法柯尔莫哥洛夫-斯米诺夫检验(D检验)和夏皮洛-威尔克检验(W检验)对检测结果进行分析,确定120例样本TgAb水平是否为正态分布,再根据其正态性选择相应的参考区间计算方法。若服从正态分布,采用正态分布法;若不服从正态分布,采用百分位数法,取其第95百分位。
2 结 果


注:TgAb单位为IU/mL。
2.2检测准确度与精密度 准确度和精密度评估结果见表1。批内对高(1 000 IU/mL)、中(200 IU/mL)、低(50 IU/mL)浓度抗人TgAb国家标准品的相对偏差为1.34%~5.20%,批间相对偏差为1.15%~6.70%。批内对高(1 000 IU/mL)、中(200 IU/mL)、低(50 IU/mL)浓度抗人TgAb国家标准品的CV为1.50%~3.23%,批间CV为1.68%~3.84%。

表1 准确度与精密度评估结果
2.3检测特异性 特异性评估结果见表2。用本试剂盒检测抗人TgAb国家标准品的交叉反应率为98.22%,而检测人血清清蛋白(100 ng/mL)、胆红素(100 ng/mL)、血红蛋白(100 ng/mL)、TNF-α(100 ng/mL)、CEA(100 ng/mL)均无明显交叉反应,检测值分别为1.73、1.15、1.87、1.42和1.76 IU/mL,其中选用了一个含IgG的样本(IgG水平:1 000 mg/dL),其检测结果不高于参考区间上限值,说明干扰较小,不影响检测结果。

表2 特异性评估结果
2.4与临床检测常用试剂盒比对 60例血清样本平行检测,绘制的相关性曲线见图2,相关性方程为Y=0.964 9X+10.823 0,R2=0.937 0,r=0.968 0,其覆盖了中、高浓度情况,符合率较高。

图2 与临床检测用试剂盒比对的相关性
2.5健康人群参考区间 本试剂盒检测120例健康人血清样本得到的TgAb水平使用SPSS19.0进行分析,均显示数据不服从正态分布,故采用百分位数法,取其第95百分位,建议最合适的阀值为111.65 IU/mL,即健康人群参考区间为≤111.65 IU/mL。
3 讨 论
甲状腺癌是临床常见的一种内分泌系统恶性肿瘤,由甲状腺细胞异常增生所导致,常表现为甲状腺结节,近年来其发病率呈现快速增长趋势[11]。2018年全球新增甲状腺癌患者56.7万例,占所有癌症的3.10%。甲状腺癌发病率居全球癌症发病率的第9位,其发病率在我国居第7位[12]。据统计,甲状腺癌患病率在我国以每年20%的速度不断增长,常见于小于30岁女性[13]。临床上,主要采用超声、查体、穿刺活检等方式进行甲状腺异常诊断,但上述方法临床适用性较低,血清学生物标志物的发现与应用在甲状腺疾病的早期筛查中的作用越来越明显[14]。田亮等[15]对212例有明确病理学诊断的甲状腺癌患者研究发现,细胞角蛋白19片段抗原(Cyfra 21.1)与甲状腺癌患者术后复发和转移有关,可能是一种能够独立预测甲状腺癌患者术后复发及恶性分化风险的循环生物标志物。
本研究基于TgAb是甲状腺癌的独立预测因素,在甲状腺疾病中异常高表达的理论基础[16-18],制备了一种吖啶酯化学发光免疫检测试剂盒,本试剂盒可开发用于体外定量测定人血清中TgAb水平,该指标临床上主要用于甲状腺功能亢进症和慢性甲状腺炎的早期诊断,还用作甲状腺异常,如慢性淋巴性甲状腺炎、非毒性甲状腺肿、Grave病及甲状腺癌的辅助诊断。此次研发试剂盒对血清中TgAb的检测灵敏度为0.8 IU/mL,线性范围在5~2 000 IU/mL;5种潜在交叉反应物(清蛋白、胆红素、血红蛋白、TNF-α、CEA)高浓度的情况下对应的检测值远低于人血清TgAb正常水平,而接近于检测灵敏度,说明该试剂盒对TgAb水平检测具有高特异性,受杂质干扰较小;对高、中、低浓度的抗人TgAb国家标准品检测时,批内、批间相对偏差均小于10.00%,批内、批间CV均小于5.00%,说明本试剂盒对TgAb的检测准确度和精密度较高。与价格昂贵的瑞士罗氏公司TgAb检测试剂盒(化学发光法)比对,本试剂盒表现出了较高的相关性(r=0.968 0)。此外,本研究收集了120例健康人血清,初步推测出了TgAb在健康人群中的参考区间(阀值为111.65 IU/mL),即当测得的样本TgAb>111.65 IU/mL时,患者可能为甲状腺异常;TgAb≤111.65 IU/mL时,患者甲状腺无异常的可能性较大。参照人TgAb测定试剂盒行业标准[10,19],本研究制备的血清TgAb化学发光免疫检测试剂盒各项检测性能均符合行业标准,本试剂盒质量可满足临床检测的需要[20-21]。
综上所述,本研究制备的TgAb磁微粒吖啶酯化学发光免疫试剂盒各项检测性能合格,可满足临床检测要求,在与瑞士罗氏公司TgAb检测试剂盒初略对比中表现出了较高的相关性。另外,本研究还初步建立了本试剂盒对健康人群的参考区间。本试剂盒的开发降低了医疗成本,提高了临床检测的适用性,为甲状腺疾病的早期筛查提供了一种新的实验室检查手段。
