紫杉醇脂质体对肺动脉高压大鼠肺血管重构的干预作用
2022-11-24王思凝许先荣
陈 明 张 苗 王思凝 施 淼 许先荣
1.浙江省立同德医院呼吸与危重症医学科,浙江杭州 310012;2.浙江省立同德医院综合内科,浙江杭州 310012;3.浙江省立同德医院妇科,浙江杭州 310012
肺动脉高压是一组由不同病因及发病机制导致的以肺血管结构或功能改变、肺动脉阻力增加,表现为肺动脉压力升高并呈进行性发展,最终导致右心室功能障碍、衰竭的疾病[1]。其发病机制复杂,是多种因素共同作用的结果,其中肺血管的收缩、重构是导致肺动脉高压的重要环节[2]。紫杉醇制剂目前除广泛应用于肿瘤的治疗外,其在改善血管重构、抑制新生血管生成、延缓血管再狭窄等方面有独特优势,已被用于防治心血管疾病,如冠状动脉术后再狭窄及药物涂层支架等[3],但目前对肺血管增殖性疾病领域的研究相对较少,本研究拟通过一次性腹腔注射野百合碱(monocrotaline,MCT)建立大鼠肺动脉高压模型,观察紫杉醇脂质体对大鼠肺血管重构的影响,以期为肺动脉高压治疗提供借鉴。
1 材料与方法
1.1 实验材料
健康清洁级雄性Sprague–Dawley 大鼠30 只,平均体质量(200±20)g,由浙江省中医药研究院实验动物中心提供[许可证号:SYXK(浙)2019–0010]。野百合碱(货号:C101555,上海阿拉丁生化科技股份有限公司);紫杉醇脂质体(批准文号:国药准字H20030357,生产单位:南京绿叶制药有限公司,规格:30mg);生物信号采集处理系统(MedLab–U/ 4C501H,南京美易科技有限公司);数字切片扫描仪(NanoZoomer S360)、光学显微镜(Leica DMLB,德国Leica 公司)。
1.2 肺动脉高压模型的建立与分组
将30 只大鼠适应性喂养1 周后,按随机数字表法将其分为正常对照组(正常组)、野百合碱模型组(MCT 组)和紫杉醇脂质体组(治疗组),每组各10 只;除正常组外,其余两组大鼠予配置好的1% MCT 溶液按照60mg/kg 腹腔注射1 次,制作肺动脉高压模型,正常组大鼠予一次性腹腔注射等量的生理盐水。
1.3 药物干预
治疗组:造模第21 天起予紫杉醇脂质体7.24mg/kg尾静脉注射,每3d 注射一次,至35d 测压、取标本处死。正常组与MCT 组:造模第21 天起尾静脉注射与治疗组等量生理盐水,每3d 注射一次,至35d测压、取标本处死。上述三组大鼠注射剂量以5d 为1 个周期随体质量变化而作出调整,干预时间35d。
1.4 右心室收缩压测定及标本采集
于MCT 注射第35 天,参考相关文献及前期实验的基础上测量大鼠的右心室收缩压(right ventricular systolic pressure,RVSP)。大鼠以10%水合氯醛按350mg/kg 腹腔注射麻醉,固定于固定器上。在大鼠颈部偏右侧做一切口,暴露并游离右颈外静脉和右颈总静脉,以眼科剪斜行剪开颈总静脉血管直径的1/3,将导管在此切口处插入血管,并向心脏方向缓慢递送导管,根据生理信号采集处理系统软件界面所显示的压力波形曲线、压力值和导管进入的长度来判断导管口所处的位置[4]。为提高操作可行性和稳定性,右心导管仅进入右心室,测定RVSP,并以此代表肺动脉压力[5]。
开胸取出心脏,冰盐水冲洗,沿房室沟剪去左、右心房及大血管根部,沿室间隔剪下右心室,用滤纸吸去水分,用电子天平分别称量右心室(right ventri cular,RV)、左心室+室间隔(left vent ricular +septum,LV+S)的重量,最后计算右心室肥厚指数(right ventricular hypertrophy index,RVHI)。RVHI=RV/(LV+S)×100%,以此作为评价右心室肥厚的指标。
1.5 肺血管组织病理测定
1.5.1 病理组织取材 取各组大鼠左下肺组织,浸泡于10%福尔马林溶液中固定48h,脱水、透明、石蜡包埋,依次经苏木精–伊红染色(hematoxylin and eosin staining,HE 染色)和免疫组织化学染色,随后制作数字切片,通过NDP.view 软件查看、导出待分析的病理切片。
1.5.2 肺动脉中膜厚度百分比及血管壁面积指数测定 采用肺动脉中膜厚度百分比及血管壁面积指数对肺动脉重构进行评估。每组大鼠选取3 张肺组织HE 染色切片,随机选取6 条血管(50~150μm),采用ImageJ 软件测量血管内径、血管外径、血管腔内面积和血管总面积。肺动脉中膜厚度百分比=(血管外径-血管内径)/血管外径×100%,反映肺动脉管壁的增殖程度;血管壁面积指数=(血管总面积-血管腔内面积)/血管总面积×100%,反映肺动脉管腔的狭窄程度[6]。
1.5.3 肺组织免疫组织化学测定 用免疫组织化学染色的方法检测肺组织中增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、α–平滑肌肌动蛋白(α–smooth muscle actin,α–SMA)表达量。PCNA增殖度计算:石蜡切块免疫组织化学染色后,每组大鼠选取3 张肺组织切片,选取6 条血管(50~150μm),计数血管壁及周围所有细胞数及PCNA染色阳性(棕色)细胞数。PCNA 增殖度=PCNA 染色阳性细胞数/总细胞数×l00%[7]。α–SMA 的表达量计算:分别测量血管总面积及血管壁平滑肌染成棕色部分的阳性面积。以阳性面积/血管总面积反映表达量程度。
1.6 统计学方法
使用SPSS 26.0 统计软件对数据进行分析。计量资料以均数±标准差(x s± )表示,多组间比较用单因素方差分析,组间两两比较用LSD–t法。P<0.05为差异有统计学意义。
2 结果
2.1 三组大鼠的一般情况比较
正常组大鼠实验期间精神状态、进食和饮水情况正常,皮毛光泽发亮,行为活跃,反应灵敏,大小便正常;MCT 组大鼠实验前期精神状态、进食和饮水情况正常,第3 周开始,精神较差,进食较前减少,饮水尚可,反应尚灵敏,皮毛光泽但抓取时易脱落;治疗组大鼠实验期间精神状态、饮水情况正常,皮毛光泽但抓取时易脱落,行为较活跃,反应灵敏,大小便正常。
2.2 三组大鼠的RVSP 及RVHI 比较
第35 天,MCT 组大鼠的RVSP 显著高于正常组(P<0.01),提示病理模型复制成功;治疗组大鼠的RVSP 显著低于MCT 组(P<0.05)。第35 天,MCT组和治疗组大鼠的RVHI 显著高于正常组(P<0.01);治疗组大鼠的RVHI 显著低于MCT 组(P<0.01),见表1。
表1 三组大鼠的RVSP 及RVHI 比较()
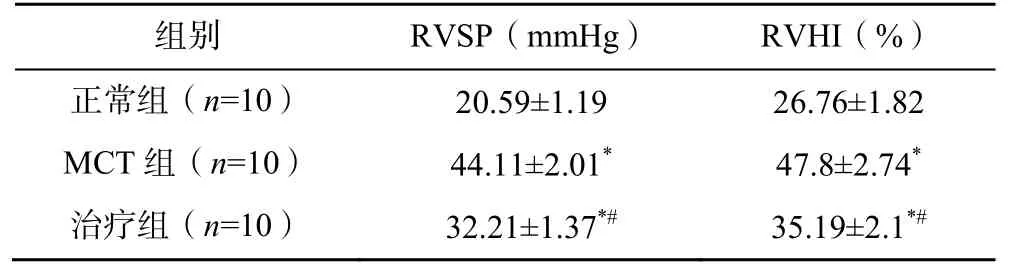
表1 三组大鼠的RVSP 及RVHI 比较()
注:与正常组比较,*P<0.05;与MCT 组比较,#P<0.05;1mmHg=0.133kPa
2.3 三组大鼠的肺组织病理改变
正常组大鼠肺组织肺动脉管壁结构清楚,厚度正常,中膜平滑肌细胞未见明显增殖,外膜未见血管外基质沉积。MCT 组大鼠肺组织肺动脉管壁明显增厚,平滑肌细胞增殖、肥大,导致管腔狭窄,外膜可见血管外基质沉积;治疗组大鼠肺动脉管壁增厚较MCT 组明显降低,肺动脉外膜周围可见少量血管外基质沉积,见图1。
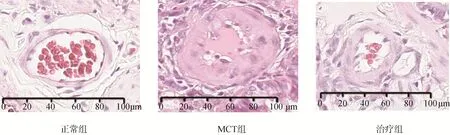
图1 三组大鼠肺动脉组织形态学改变(HE 染色×200)
2.4 三组大鼠的肺动脉形态计量学指标比较
MCT 组大鼠的肺动脉中膜厚度百分比及血管壁面积指数显著高于正常组(P<0.01)。治疗组大鼠的肺动脉中膜厚度百分比及血管壁面积指数显著低于MCT 组(P<0.05),见表2。
表2 三组大鼠的肺动脉形态计量学指标比较()

表2 三组大鼠的肺动脉形态计量学指标比较()
注:与正常组比较,*P<0.01;与MCT 组比较,#P<0.05
2.5 三组大鼠的肺动脉PCNA 及α–SMA 表达量比较
正常组大鼠的肺动脉管壁及血管壁周围仅有少量PCNA 表达。MCT 组大鼠的PCNA 及α–SMA 表达均显著高于正常组(P<0.01);治疗组大鼠的PCNA及α–SMA 表达均显著低于MCT 组(P<0.01),见表3、图2。

图2 三组大鼠的免疫组织化学检测PCNA 及α–SMA 表达(×200)
表3 三组大鼠的肺动脉PCNA 及α–SMA 表达量比较()
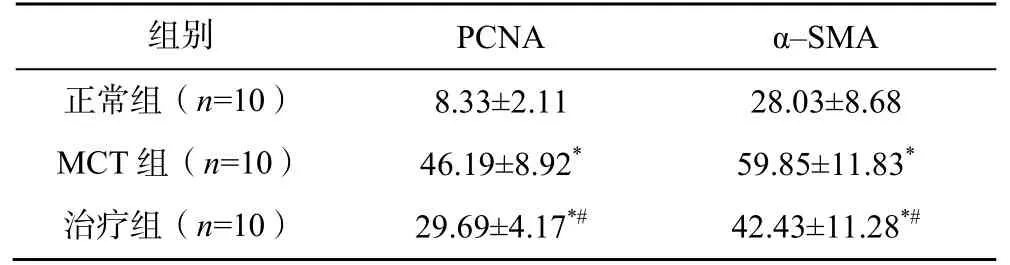
表3 三组大鼠的肺动脉PCNA 及α–SMA 表达量比较()
注:与正常组比较,*P<0.01;与MCT 组比较,#P<0.01
3 讨论
随着近年来对肺动脉高压研究的深入,临床上可用的治疗药物较前有所增加,特异性针对前列环素、内皮素和一氧化氮通路的靶向药物可明显改善患者的活动能力和预后[8],但仍不能完全阻止病程进展,且部分药物存在价格昂贵、无法普及等情况[9]。
肺血管重构是促进肺动脉高压发生发展的关键因素,是一个持续发展的病理过程[10]。肺血管重构涉及血管内皮损伤、血管中膜增厚、周围血管的肌纤维化和细胞外基质增多等[11]。其中肺动脉平滑肌细胞(pulmonary arterial smooth muscle cell,PASMC)增殖和肥大引起的肺血管重构是导致肺动脉高压的关键因素[12]。在肺血管重构过程中PASMC 不仅是肺血管收缩的效应细胞,同时也是导致血管平滑肌迁移、肥大增殖的细胞基础。因此,如能减缓PASMC的增殖和肥大,对改善肺血管重构具有重要意义。
近年来发现,紫杉醇不仅能用于肿瘤的治疗,在抗血管重构方面也有独特的优势,既往研究发现它在抑制细胞快速增殖的同时,还可下调肿瘤坏死因子–α 等,促进细胞凋亡,对PASMC 的增殖、迁移有较好的抑制作用[13,14]。研究表明,低浓度紫杉醇可对转化生长因子–β 促进PASMC 外胶原合成具有显著的抑制作用,该作用可能是通过调控Smad3 蛋白的磷酸化实现[15]。
但传统的紫杉醇制剂由于自身及溶剂的特点,可引起严重过敏反应、骨髓抑制、消化系统反应、神经毒性及毛囊炎、静脉炎等不良反应,且不良反应随剂量增加而加重,限制了其临床应用的安全性和有效性[16]。脂质体是将亲水性或亲脂性药物封包在脂质双分子层所制成的超微制剂[17]。由于紫杉醇脂质体结构类似生物膜,可使紫杉醇携带各种亲水的、疏水的或两亲的物质,有减少药物剂量、降低毒性、减轻变态反应和免疫反应的效果,同时又不降低紫杉醇的治疗效果[18]。
本研究表明紫杉醇脂质体对MCT诱导建立的大鼠肺动脉高压模型进行干预,可明显降低肺动脉高压大鼠的RVSP 和RVHI,病理也证实经紫杉醇脂质体干预后,肺动脉管壁厚度及管腔狭窄程度有较大改善。说明对肺动脉高压有一定的缓解作用。
PCNA 是反映细胞增殖的良好指标,存在于细胞核内,是启动DNA 复制的必要条件[19]。因此,PCNA 阳性细胞数量的增多也提示细胞增殖异常活跃。α–SMA对定位平滑肌细胞具有较高特异性,对了解PASMC增殖意义较大[20]。本实验中,MCT 组大鼠肺动脉及血管周围的PCNA 阳性细胞表达增加,α–SMA 表达也显著升高,提示肺动脉平滑肌细胞增殖明显,而经过紫杉醇脂质体干预后肺动脉及血管周围的PCNA及α–SMA 表达均降低,提示紫杉醇脂质体通过抑制肺血管中的平滑肌细胞增殖而缓解肺血管重构。
综上,紫杉醇脂质体可降低MCT 诱导肺动脉高压大鼠的肺动脉压力,其可通过抑制肺动脉平滑肌细胞增殖而缓解肺血管重构,但仍需进一步研究探讨其抑制肺动脉平滑肌细胞增殖的机制。
