抑制Polo样蛋白激酶1联合细胞因子诱导的杀伤细胞对三阴性乳腺癌杀伤效应的机制初探
2022-11-24鲁洪丰李旭军
励 超 钱 飚 鲁洪丰 李旭军
中国科学院大学宁波华美医院乳腺外科,浙江宁波 315000
三阴性乳腺癌(triple–negative breast cancer,TNBC)是女性最常见的恶性肿瘤之一,作为复杂的疾病类型,其表现出明显的肿瘤间和肿瘤内异质性[1,2]。研究表明,晚期乳腺癌通常可转移到骨、肝、肺和脑等远处器官[3],优化当前乳腺癌的临床治疗方法以寻找新型诊疗方案仍是目前的研究热点。Polo样蛋白激酶1(Polo–like kinase1,PLK1)是PLK 家族成员之一,是一类广泛存在于真核细胞中的丝氨酸/苏氨酸蛋白激酶。现已知PLK1 在大多数肿瘤中高度表达,如骨肉瘤、非小细胞肺癌和乳腺癌等,并与患者的肿瘤细胞增殖和预后密切相关[4-6]。此外,通过抑制PLK1 免受蛋白酶体降解能够促进乳腺癌细胞增殖,提示PLK1 可能是治疗乳腺癌的潜在靶点[7]。目前,随着对肿瘤发生发展机制和现代生物技术的深入探索,自体免疫细胞疗法对肿瘤治疗发挥重要作用,其中,细胞因子诱导的杀伤细胞(cytokine–induced killer cell,CIK 细胞)是用于免疫治疗的常见免疫效应细胞,可介导肿瘤细胞凋亡或导致细胞死亡,并分泌相关细胞因子以促进抗肿瘤作用,具有杀瘤活性高和识别能力强等优点[8]。鉴于此,本研究旨在探究抑制PLK1 表达联合CIK 细胞作用下对乳腺癌细胞的影响,以期为该疾病的治疗提供新选择。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级BALB/c 裸鼠40 只,雌性,4~6 周龄,体质量18~20g,饲养室温度22~24℃、相对湿度(50±5)%且每日光照/黑暗交替12h,饲养环境经严格灭菌处理,期间自由饮水与摄食,适应性饲喂1 周后开始实验。本研究获得医院动物伦理委员会审批通过(批件号:SL–NBEY–KY–2022–045–03)。
1.1.2 细胞 TNBC细胞株MDA–MB–231购于美国典型培养物保藏中心。
1.1.3 主要试剂 PLK1 抑制剂BI–2536 购于美国Selleck 公司,γ 干扰素(interferon–γ,IFN–γ)购于美国PeproTech 公司,白细胞介素–2(interleukin 2,IL–2)购于北京四环生物制药有限公司,CD3McAb购于美国Corning 公司,MTT 试剂盒和苏木精–伊红染色(hematoxylin and eosin staining,HE 染色)试剂盒购于北京索莱宝生物科技有限公司,Annexin V–FITC/PI 细胞凋亡检测试剂盒购于南京诺唯赞生物科技股份有限公司,PVDF 膜购于美国Millipore公司,蛋白裂解液、BCA 蛋白检测试剂盒及ECL 增强化学发光液购于上海碧云天生物研究所,免疫组织化学染色(DAB 显色)试剂盒购于北京百奥莱博科技有限公司,PerCP–CD3、FITC–CD4、APC–CD8、FITC–CD56 抗体及兔抗人Ki–67 多克隆、兔抗人胱天蛋白酶(caspase)–3、兔抗人caspase–9、兔抗人GAPDH 多克隆抗体购于英国Abcam 公司。
1.2 方法
1.2.1 CIK 细胞的培养、扩增及鉴定 收集健康志愿者(伦理号:SX–NBEY–TY–2022–122–12)外周静脉血30ml 置于肝素抗凝管,Ficoll 密度梯度离心法分离外周血单个核细胞,置于37℃、5% CO2孵箱内培养,收集细胞,加入含1000U/ml INF–γ 与20%人血清白蛋白的无血清培养基,在孵箱内培养。24h后加入400U/ml IL–2 和50 ng/ml CD3McAb 继续培养,每隔2d 换液1 次,同时补足1000 U/ml IL–2。分别取分离的外周血单个核细胞和诱导培养第12 天的CIK 细胞,磷酸盐缓冲液(phosphate buffered solution,PBS)洗涤,以1000 转/min 离心5min,调整细胞浓度为5×106个/ml,取100μl 细胞悬液置于干净离心管,分别加入PerCP 荧光标记的CD3、FITC荧光标记的CD4、APC 荧光标记的CD8、FITC 荧光标记的CD56 抗体,充分混匀后,4℃避光静置30min,PBS 洗涤2 遍,加入4%多聚甲醛固定液重悬沉淀,应用流式细胞仪检测分析。
1.2.2 MTT法 将MDA–MB–231细胞添加至含10%胎牛血清和1%青–链霉素的DMEM 培养基,置于37℃、5%CO2孵箱中培养贴壁后,常规传代培养。通过BI–2536、CIK 细胞及BI–2536 联合CIK 细胞处理MDA–MB–231 细胞后,检测各处理组细胞存活率。①BI–2536 对MDA–MB–231 细胞存活率的影响:将对数生长期的MDA–MB–231 细胞用0.25%胰酶消化,制备成单细胞悬液,以1×103个/孔的密度植入96 孔培养板,在孵箱培养24h 后,分别换用含1、2.5、5、10、20μmol/L BI–2536 的培养基培养48h 后,每孔加入20μl MTT(5mg/ml)继续培养4h,弃原液,加入150μl DMSO 至细胞孔,充分振荡,待孔内蓝紫色结晶全部溶解后,采用酶标仪检测各细胞孔A490值,计算各组细胞存活率。②CIK 细胞对MDA–MB–231细胞存活率的影响:将消化后的MDA–MB–231 细胞调整密度至1×104个/ml 作为靶细胞,将CIK 细胞调整细胞密度至5×105个/ml 作为效应细胞;依次按照5∶1、10∶1、20∶1、40∶1 的效靶比例将CIK 细胞与MDA–MB–231 细胞共植入96 孔培养板,将培养板置于37℃、5%CO2孵箱内培养48h 后,根据MTT 法检测各细胞孔A490值,计算各组细胞存活率。③BI–2536 联合CIK 细胞对MDA–MB–231 细胞存活率的影响:将消化后的MDA–MB–231 细胞以1×103个/孔的密度植入96 孔培养板,设置对照组、BI–2536 组(5μmol/L BI–2536 处理MDA–MB–231 细胞48h)、CIK组(效靶比为10∶1的CIK细胞处理MDA–MB–231细胞48h)、BI–2536+CIK 组(5μmol/L BI–2536 与效靶比为10∶1的CIK细胞共同处理MDA–MB–231细胞48h),处理完成后,根据MTT 法检测各细胞孔A490值,计算各组细胞存活率。
1.2.3 流式细胞术 取1.2.2 ③处理后的各组MDA–MB–231 细胞,PBS 洗涤,0.25%胰酶消化,PBS 再洗涤后,使用染料结合缓冲液重悬制备成单细胞悬液,调整细胞密度为2×105个/ml,取100μl 细胞悬液移入干净离心管,依次加入5μl Annexin V–FITC 和5μl PI,涡旋混匀,室温避光孵育10min 后,通过流式细胞仪上机检测各组细胞凋亡水平。
1.2.4 蛋白质印迹法 通过蛋白裂解液提取各组MDA–MB–231 细胞的总蛋白,BCA 法蛋白定量后,加入SDS 上样缓冲液,沸水浴处理5min,制备12% SDS–PAGE 凝胶,将蛋白样品加入凝胶孔内,电泳分离蛋白,以220mA、120min 转膜条件电转印至PVDF 膜,并置于5%脱脂奶粉中室温封闭1h。分别加入稀释的一抗caspase–3(1∶1000)和caspase–9(1∶1000),4℃孵育过夜;次日,TBST 室温洗膜,再加入稀释的对应二抗(1∶5000),室温孵育1h,TBST 洗膜,将膜采用ECL 增强化学发光显影,暗室曝光,以GAPDH 作为内参,利用ImageJ 1.8.0 软件计算各蛋白相对表达水平。
1.2.5 裸鼠移植瘤模型的建立与分组处理 将正常培养的MDA–MB–231 细胞密度调整为1×108个/ml,将BALB/c 裸鼠右下腹部消毒,通过微量注射器取200μl 细胞悬液推注于裸鼠右侧腋窝处,夹紧针孔以防渗漏。接种后,每日观察裸鼠生长状态与肿瘤长出情况。待瘤体生长达到约100mm3时,选择32 只瘤体大小与形态较为一致的裸鼠,按数字表法随机分成4组,每组8 只。①对照组:与给药组等容积的生理盐水灌胃,尾静脉注射200μl 生理盐水;②BI–2536 组:以10mg/kg BI–2536(溶于含30%PEG–400、0.5%Tween–80和5%丙烯的生理盐水)灌胃,每2d 一次;③CIK 组:取200μl CIK 细胞(1×106个/ml)进行尾静脉注射,一周2 次;④BI–2536+CIK 组:以10mg/kg BI–2536灌胃,每2d 一次,并取200μl CIK 细胞(1×106个/ml)进行尾静脉注射,一周2 次。持续观察各组裸鼠肿瘤生长,用游标卡尺测量瘤体,每隔2d 测量一次;21d后处死所有裸鼠,无菌环境下解剖取出瘤体,清洗干净后电子天平称重,将一部分组织固定在10%福尔马林中,一部分置于液氮迅速冷冻后保存于-80℃冰箱。
1.2.6 HE染色 取10%福尔马林中固定好的裸鼠移植瘤组织,常规脱水透明,制备成石蜡块,在切片机上连续切成4μm 的组织切片,将其以二甲苯脱蜡与梯度酒精脱水处理后,置于Harris 苏木精中染色5min,流水冲洗干净,在切片上滴入1%盐酸/乙醇分化数秒,冲洗干净后,加入伊红染色3min,再经过脱水、透明处理,中性树胶封固,在光学显微镜下观察各肿瘤组织内肿瘤细胞生长状况,并摄取图像。
1.2.7 免疫组织化学染色 将制备的肿瘤组织切片在烤箱高温处理1h,常规脱蜡水化,滴加柠檬酸钠加热修复抗原,0.3%过氧化氢液室温孵育10min,PBS 冲洗浸泡,组化笔画圈标记,10%山羊血清室温封闭,分别滴加稀释后的兔抗人Ki–67 多克隆抗体(1∶100)、兔抗人caspase–3 多克隆抗体(1∶200)和兔抗人caspase–9 多克隆抗体(1∶200),4℃冰箱内孵育过夜;次日,弃原液,PBS 冲洗后,圈内滴加稀释后的对应二抗(1∶5000),室温继续孵育1h。再次洗涤切片后,利用DAB 进行显色,流水冲洗,苏木精复染,常规脱水透明,中性树胶封固,通过光学显微镜观察组织内细胞着色情况并拍摄图像,胞质、胞核染为棕色至棕褐色为阳性,随机选择5 个视野,通过ImageJ 1.8.0 软件分析蛋白阳性染色面积,以阳性染色面积与总面积之比表示各蛋白的阳性表达率。
1.3 统计学方法
采用SPSS 23.0 软件分析处理实验数据,GraphPad Prism 8.30 绘制统计图。计量资料以均数±标准差()表示,所有实验至少进行3 次。采用单因素方差分析进行多组重复测量数据比较,LSD–t检验进行组内两两数据比较。P<0.05 为差异有统计学意义。
2 结果
2.1 CIK 细胞鉴定
与诱导前比较,CIK 细胞经过14d 体外诱导扩增后,CIK 细胞亚群中CD3+CD8+和CD3+CD56+细胞比例均显著增加(P<0.05),而CD3+CD4+细胞比例显著减少(P<0.05),见图1。

图1 流式细胞术检测CD3+CD8+、CD3+CD56+ 及CD3+CD4+细胞比例
2.2 抑制PLK1 及CIK 细胞对TNBC 细胞的增殖抑制
与对照组比较,随着药物浓度的增加,细胞存活率明显下降,呈剂量依赖性,差异有统计学意义(P<0.05),见图2A。不同效靶比的CIK 细胞作用于MDA–MB–231 细胞后,细胞存活率随着效靶比的增加而降低,呈效靶比依赖性,差异有统计学意义(P<0.05),见图2B。

图2 MTT 法检测各组MDA–MB–231 细胞存活率
2.3 抑制PLK1 联合CIK 细胞对TNBC 细胞的增殖抑制作用
与对照组比较,BI–2536 组和CIK 组的MDA–MB–231 细胞存活率均显著下降(P<0.05);而与BI–2536 组和CIK 组比较,BI–2536+CIK 组的细胞存活率进一步显著下降(P<0.05),见图3。

图3 MTT 法检测各组的MDA–MB–231 细胞存活率
2.4 抑制PLK1 联合CIK 细胞对TNBC 细胞凋亡的影响
BI–2536 组和CIK 组的MDA–MB–231 细胞凋亡率均显著高于对照组(P<0.05);BI–2536+CIK 组的细胞凋亡率显著高于BI–2536 组和CIK 组(P<0.05),见图4。
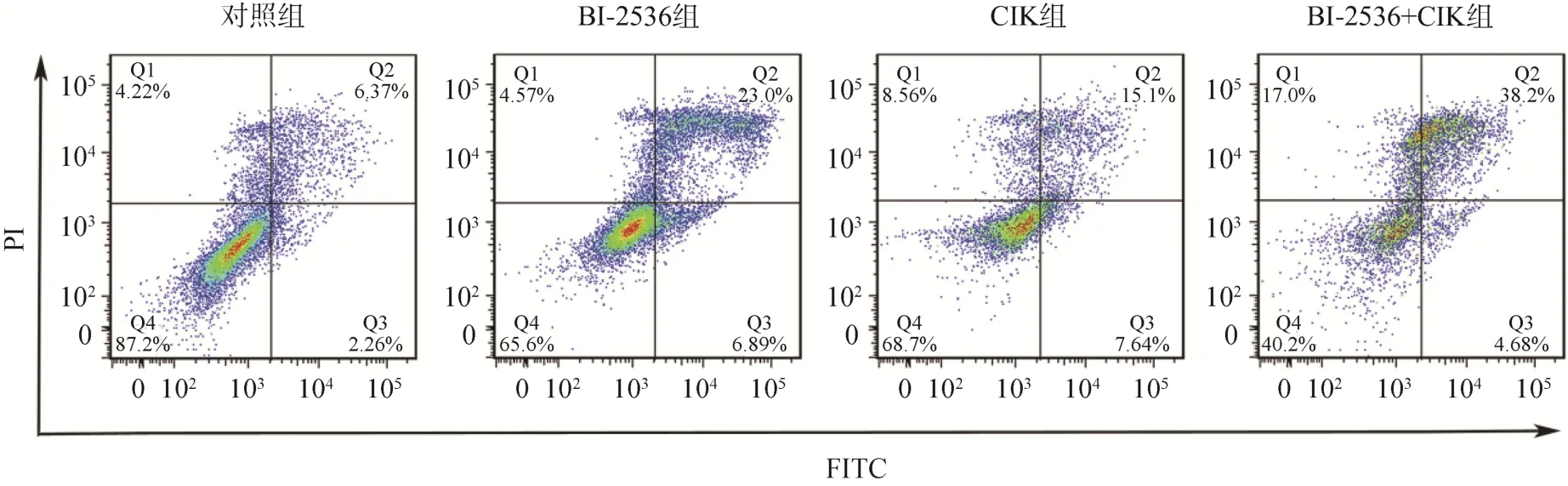
图4 流式细胞术检测各组的MDA–MB–231 细胞凋亡率
2.5 抑制PLK1 联合CIK 细胞对TNBC 细胞中caspase–3 与caspase–9 蛋白表达的影响
与对照组比较,BI–2536 组和CIK 组的MDA–MB–231 细胞中caspase–3、caspase–9 蛋白活性均显著增加(P<0.05);与BI–2536 组和CIK 组比较,BI–2536+CIK 组细胞中caspase–3、caspase–9 蛋白活性均进一步显著增加(P<0.05),见图5。
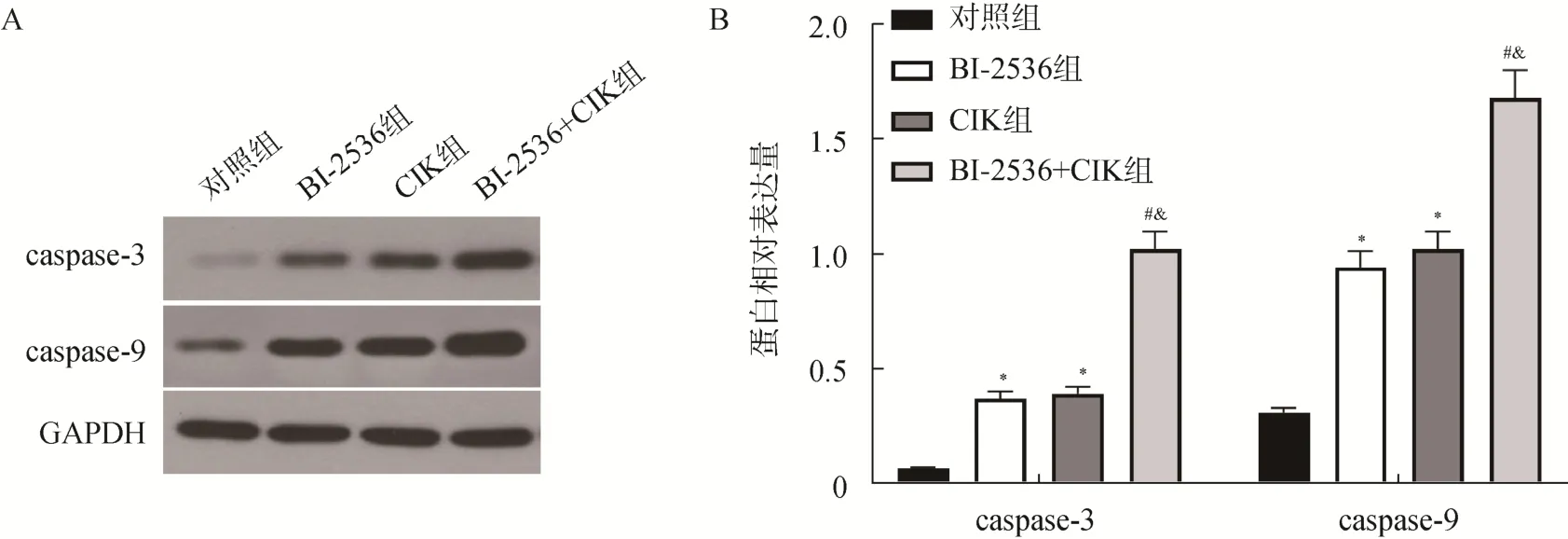
图5 蛋白质印迹法检测各组中的MDA–MB–231 细胞中的caspase–3 与caspase–9 蛋白水平
2.6 抑制PLK1 联合CIK 细胞对TNBC 裸鼠移植瘤生长的影响
在第6、9、12、15、18、21 天时,BI–2536 组和 CIK 组裸鼠肿瘤组织体积显著小于对照组(P<0.05),而相较于 BI–2536 组和 CIK 组,BI–2536+CIK 组裸鼠肿瘤组织体积进一步显著缩小(P<0.05),见图6A。与对照组比较,BI–2536 组和 CIK 组裸鼠肿瘤质量显著减少(P<0.05),BI–2536+CIK 组的肿瘤组织质量显著小于BI–2536组和CIK 组(P<0.05),见图6B、图6C。

图6 各组裸鼠肿瘤组织体积与质量测定
2.7 抑制PLK1 联合CIK 细胞对TNBC 裸鼠肿瘤组织内细胞生长的影响
通过HE 染色观察到对照组裸鼠肿瘤组织内染色均匀,细胞排列密集,生长状态良好;相较于对照组,BI–2536 组和CIK 组裸鼠肿瘤组织内细胞排列较为稀疏,数目明显减少;而与BI–2536 组和CIK组比较,BI–2536+CIK 组裸鼠肿瘤组织内细胞进一步减少,且形态不规则,见图7。

图7 各组大鼠肿瘤组织内细胞生长(HE 染色,×100)
Ki–67 蛋白阳性表达主要位于细胞核,caspase–3和caspase–9 蛋白阳性表达主要位于细胞质,部分定位于细胞核,呈弥漫分布。与对照组比较,BI–2536组和CIK 组裸鼠肿瘤组织内Ki–67 阳性率显著减少(P<0.05),caspase–3 阳性率和caspase–9 阳性率均显著增加(P<0.05);而与BI–2536 组和CIK 组比较,BI–2536+CIK 组裸鼠肿瘤组织内Ki–67 阳性率显著减少(P<0.05),caspase–3 阳性率和caspase–9阳性率则均显著增加(P<0.05),见图8。

图8 各组肿瘤组织内Ki–67、caspase–3 及caspase–9 表达
3 讨论
乳腺癌作为一种高度异质性的疾病,不同患者的临床治疗和预后差异较大。基于基因活性检测已确定10 余个不同的疾病亚型,TNBC 是一种特定的乳腺癌亚型,不表达雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor 2,HER2),临床特征表现为侵袭性强、转移潜能高、易复发和预后差[9]。由于TNBC 缺乏ER、PR 和HER2表达,对内分泌治疗不敏感且缺乏有效的治疗靶点,目前尚无标准化的TNBC 治疗方案。因此,开发新型TNBC 治疗策略迫在眉睫。
PLK1包含保守的N末端激酶催化域和Polo–box结构域,参与磷酸化的激活与亚细胞定位调节。PLK1几乎调节细胞分裂的各个阶段,此外,其还在调节微管动力学、染色体动力学、p53 活性、DNA 复制和损伤修复等方面发挥重要作用。目前,已揭示PLK1 在多种肿瘤中存在过表达现象,其表达水平与细胞增殖、转移和不良预后有关[4-6,10]。Maire 等[11]研究发现TNBC 中PLK1 的表达水平高于乳腺癌A型、B 型和HER2 过表达型,提示PLK1 是TNBC的潜在治疗靶点;Ren 等[12]研究表明PLK1 能促进TNBC 肿瘤细胞的增殖、侵袭、迁移和克隆形成,是TNBC 发生过程中的关键Hub 基因,推动乳腺癌恶性进展。鉴于此,研究者认为以PLK1 作为治疗靶点开发药物对个体化 TNBC 治疗具有很大前景。BI–2536 是PLK1 的ATP 结合域抑制剂,可在低纳摩尔浓度下与PLK1 的激酶域结合并抑制其活性,使肿瘤细胞有丝分裂和周期进程异常,进而抑制肿瘤发生发展[13]。本研究结果显示,经过不同剂量BI–2536 处理MDA–MB–231 细胞后,随着药物浓度的增加,细胞存活率明显下降;此外,BI–2536作用于移植瘤裸鼠后其肿瘤体积和质量均减小,肿瘤组织内细胞生长与增殖均受抑制,由此说明BI–2536 对体内外乳腺癌肿瘤细胞生长均表现出抑制作用。
CIK 细胞是从人外周血单核细胞中收获的异质免疫效应细胞,经几种细胞因子诱导而来,对肿瘤细胞显示出广泛的主要组织相容性复合体非限制性杀瘤活性,能够通过释放穿孔素、颗粒酶B、细胞溶解素等杀伤肿瘤细胞[8]。与其他免疫细胞相比,CIK细胞具有增殖能力强、抗肿瘤谱广及抗肿瘤活性强等特点。然而,CIK 在治疗TNBC 中仍面临诸多问题,由于TNBC 恶性程度高且转移快速,部分患者在确诊时已处于晚期,此时患者的免疫功能较低,激活抗肿瘤免疫反应的能力差,且由于肿瘤组织已建立免疫抑制环境,使得CIK 细胞难以发挥作用[14]。近年来,一些基础研究和临床研究都强调CIK 细胞与其他化疗药物、靶向药物或免疫疗法相结合,能够获得有效而持久的抗肿瘤效果。Chen 等[15]研究表明,卡培他滨节拍化疗联合自体CIK 细胞免疫疗法对治疗复发转移性TNBC 有效,可提高患者的免疫功能和生活质量,并延长无进展生存期;Li 等[16]研究揭示CIK 细胞免疫治疗与TNBC 预后之间的关系,表明CIK 细胞免疫治疗可提高TNBC 患者常规化疗的效果,且不良反应较少;孔娟等[17]研究说明CIK细胞联合肿瘤靶向药物西妥昔单抗对表皮生长因子受体阳性的野生型结直肠癌细胞与突变型结直肠癌细胞均显示出较强的杀伤效应。本研究中,通过将CIK 细胞与PLK1 抑制剂BI–2536 联合作用于体外MDA–MB–231 细胞后发现,联合作用下的肿瘤细胞活性更低,细胞凋亡率更高,体内乳腺癌裸鼠移植瘤实验结果也显示出CIK 细胞联合BI–2536 作用下的瘤体生长进一步减缓,抑瘤作用更强。由此推测,CIK 细胞联合PLK1 抑制剂BI–2536 可增强对肿瘤细胞的杀伤作用。
Caspase 是一个进化保守的半胱氨酸蛋白酶家族,主要参与细胞死亡和炎性反应,是由大小不一的氨基末端结构域和约20kDa、10kDa 的大、小催化亚基所组成的蛋白酶结构域,共包含15 个家族成员,其中caspase–3 是一种典型的凋亡执行者,在被启动子caspase–9 激活后裂解细胞内多个具有关键功能的蛋白质,从而导致细胞凋亡。目前,许多抗癌疗法,包括细胞毒性药物、放射疗法或免疫疗法,都能够通过激活caspase–3 来诱导肿瘤细胞凋亡或死亡[18,19]。本研究结果显示,经CIK 细胞联合BI–2536 处理的MDA–MB–231 细胞中caspase–3、caspase–9 蛋白活性均增加,同时,乳腺癌移植瘤裸鼠肿瘤组织内也表现出caspase–3、caspase–9 蛋白表达增加的现象,提示CIK 细胞联合BI–2536 可通过进一步诱导caspase 依赖性途径促进肿瘤细胞凋亡,进而发挥抑制肿瘤发展的作用。
综上,使用PLK1 抑制剂BI–2536 联合CIK 细胞能够在体内和体外增强对TNBC 肿瘤细胞的杀伤作用,该作用机制可能与进一步激活caspase 依赖性途径相关。靶向抑制PLK1 与CIK 细胞的联合应用有可能成为一种新型有效的抗肿瘤治疗方案用于TNBC 的临床应用中。
