补肾法中药调控ERK/MAPK信号通路对Aβ25-35诱导的阿尔茨海默病大鼠模型的神经保护作用研究*
2022-11-23徐家淳孙伟明曹艺萌王以申
刘 爽 徐家淳 孙伟明 曹艺萌 王以申
(天津中医药大学第二附属医院,天津 300250)
随着社会人口老龄化急剧发展,阿尔茨海默病(AD)发病率呈明显上升趋势[1-2]。AD是以进行性认知功能障碍和行为损害为特征的原发性中枢神经系统退行性疾病。因此,AD患者极易发生跌倒等意外事故,继而引发髋部骨折等一系列并发症。同时,有认知缺陷的AD患者患脑血管疾病的风险明显增加[3-4]。既往报告中指出大约2/3的AD患者为女性[5]。表明AD发病与中老年女性雌激素水平变化密切相关[6]。经研究发现,雌激素E2水平降低后会导致胞外信号调节激酶(ERK/MAPK)信号通路中各关键因子活化水平下降,进而激活一系列下游效应因子加重AD的病理变化[7]。基于此,本研究以ERK/MAPK信号通路关键靶点p-ERK1/2为切入点,探讨补肾法中药治疗AD的作用机制。
1 材料与方法
1.1 实验动物
选择SPF级3月龄雌性SD大鼠36只,体质量200~300 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。所有大鼠在SPF级隔离饲养环境下饲养,给予充足的饲料和饮水,22℃,光照为12 h光照/黑暗循环。
1.2 药物及试剂
1)补肾法中药制备:组成为淫羊藿10 g,补骨脂5 g,制首乌5 g,女贞子10 g(购于天津中医药大学第二附属医院中药房)。将上述药物150 g(共5剂)混匀,加1 000 mL蒸馏水浸泡12 h,再加水1 000 mL,以80℃超声30 min,过滤、提取,反复3次,混合滤液,以100℃水浴加热,浓缩至500 mL,最终生药质量浓度为0.3 g/mL。药液常温冷却后,置4℃冰箱内保存备用。2)Aβ25-35的制备:无菌生理盐水将Aβ25-35(Sigma公司)稀释成4 μg/μL,37℃孵育96 h变为聚集状态备用。
1.3 实验仪器
Morris水迷宫实验装置(北京硕林苑科技有限公司),SDS-PAGE电泳仪和转膜仪(BIO-RAD公司),凝胶成像系统(美国Bio Image system Gene公司),大鼠脑立体定位仪(BENCHmark公司)。
1.4 造模及分组
将36只雌性SD大鼠随机分为假手术组12只、模型组12只、中药组12只。模型组和中药组采用单侧侧脑室注射Aβ25-35方法制作AD大鼠模型。10%的水合氯醛3 mL/kg腹腔注射麻醉,将鼠头固定,备皮,碘伏消毒,头顶部正中切口,暴露前囟,按大鼠脑立体定位图谱进行侧脑室定位:前囟点后方1.5 cm,旁开1.0 cm,深度为4.0 cm。缓慢注射5 mL聚集态的Aβ25-35溶液,注射持续5 min,留针5 min,使Aβ充分弥散,缓慢出针耗时5 min。骨科蜡封堵,双氧水消毒,常规缝皮;假手术组向侧脑室注入生理盐水5 mL,操作与模型组一致。术后各组大鼠腹腔注射青霉素4万U/只,连续3 d预防感染。实验动物造模后1周,采用水迷宫实验评估AD模型是否建立成功。
1.5 干预方法
参照《药理实验方法学》[8]中“人和动物间体表面积折算的等效剂量比值表”进行给药剂量计算。中药组于造模成功后予以中药灌胃,按剂量10 mL/kg,每日1次,持续12周。假手术组及模型组于给药组相同时间点,给予中药相等剂量的蒸馏水灌胃,每日1次,持续12周。
1.6 观察项目
1.6.1 大鼠认知记忆能力检测 利用Morris水迷宫实验对AD模型大鼠认知记忆力能力进行检测。将水池分为4个象限,每个象限入水点的池壁上贴上不同的场景标记,平台置于第2象限区域中央,略低于水面2 cm。实验前将大鼠分别放入水迷宫中自由游泳2 min适应游泳环境。定位航行测试开始时,随机选取4个象限入水点之一,将大鼠头朝池壁放入水中,记录大鼠入水至找到平台时间为逃避潜伏期。若大鼠在2 min内未找到隐匿平台,则由实验者将其引向隐匿平台,其潜伏期记录为120 s,每次训练间隔为60 s,历时4 d,每天1次。摄像机位于水迷宫水池中央上方约200 cm,用于记录动物的位置、游泳的轨迹距离和时间(用于计算出游泳速度)。
1.6.2 大鼠海马神经元凋亡情况 取大鼠海马CA1区组织切片,采用尼氏(Nissl)染色方法,切片脱腊,蒸馏水冲洗;加1%甲苯胺蓝水溶液后置于54℃的温箱内浸染25 min,蒸馏水冲洗,95%的乙醇分化30 s;用无水乙醇脱水,二甲苯透明,加盖玻片,再用中性树胶封片,境下观察。
1.6.3 Western blotting检测p-ERK1/2蛋白的表达 取各组大鼠海马组织进行匀浆处理,按照核蛋白和胞浆蛋白提取试剂盒抽提总蛋白质,进行蛋白质定量。SDS-PAGE电泳分离,常规湿法转膜,封闭处理。加一抗(p-ERK1/2,1∶1 000),摇床上低温孵育过夜,TBS洗膜;加二抗(1∶5 000),摇床上常温孵育2 h后,TBS洗膜。利用超敏ECL化学发光试剂盒,借助荧光成像仪观察相关蛋白的表达,应用软件对所得图像结果测量灰密度值。
1.7 统计学处理
2 结 果
2.1 各组大鼠死亡情况
实验过程中共有3只动物死亡,其中假手术组2只,中药组1只。
2.2 各组大鼠认知记忆能力比较
见表1。与假手术相比,模型组大鼠平均速度无显著差异(P>0.05),潜伏时间明显延长,学习能力下降,差异具有统计学意义(P<0.05)。与模型组比较,中药组大鼠平均速度无显著差异(P>0.05),潜伏时间明显缩短,学习能力明显上升,差异具有统计学意义(P<0.05)。
表1 各组大鼠Morris水迷宫定位航行平均速度、学习能力比较(±s)
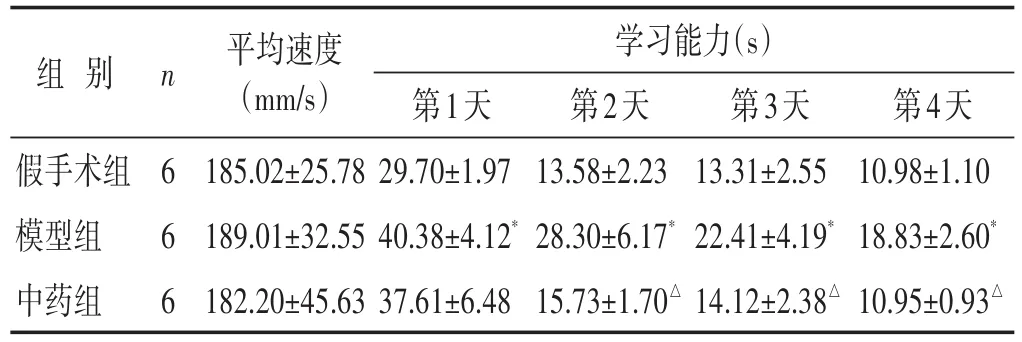
表1 各组大鼠Morris水迷宫定位航行平均速度、学习能力比较(±s)
注:与假手术组比较,*P<0.05;与模型组比较,△P<0.05。下同。
学习能力(s)组别假手术组模型组中药组n 6 6 6平均速度(mm/s)185.02±25.78 189.01±32.55 182.20±45.63第1天29.70±1.97 40.38±4.12*37.61±6.48第2天13.58±2.23 28.30±6.17*15.73±1.70△第3天13.31±2.55 22.41±4.19*14.12±2.38△第4天10.98±1.10 18.83±2.60*10.95±0.93△
2.3 各组大鼠海马神经元凋亡情况
见图1。大鼠海马CA1区尼氏染色结果显示,与假手术组相比,模型组神经元凋亡数量显著增加(P<0.01);与模型组相比,中药组神经元凋亡数量明显减少(P<0.01)。
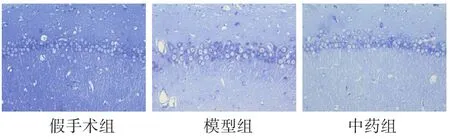
图1 各组大鼠神经元凋亡数量比较(尼氏染色,200倍)
2.4 各组大鼠海马组织p-ERK1/2蛋白表达比较
见表2,图2。Western blotting结果显示,与假手术组比较,模型组大鼠ERK/MAPK信号通路中关键靶点蛋白p-ERK1/2蛋白的表达明显降低,差异具有统计学意义(P<0.05)。与模型组相比,中药组p-ERK1/2蛋白的表达增加,差异具有统计学意义(P<0.05)

图2 各组大鼠海马组织p-ERK1/2蛋白表达
表2 各组大鼠海马组织p-ERK1/2蛋白表达比较(相对灰度值,±s)
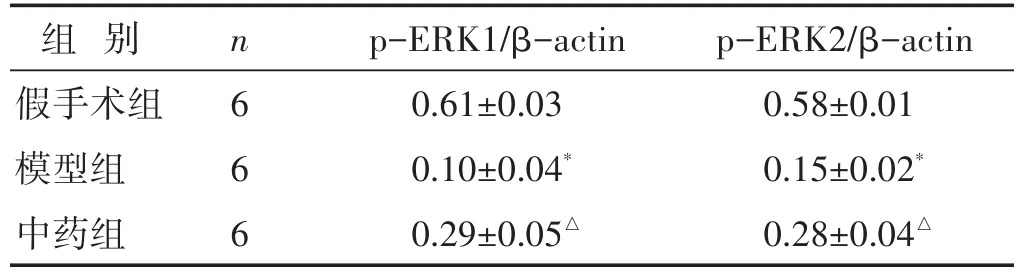
表2 各组大鼠海马组织p-ERK1/2蛋白表达比较(相对灰度值,±s)
组别假手术组模型组中药组n 6 6 6 p-ERK1/β-actin 0.61±0.03 0.10±0.04*0.29±0.05△p-ERK2/β-actin 0.58±0.01 0.15±0.02*0.28±0.04△
3 讨 论
随着社会人口老龄化的发展,AD等老年退行性疾病的发病率呈明显上升趋势[1],因其起病隐匿而被称为“沉默的杀手”。而AD患者发病后由于神经功能的退变,可引发视觉障碍、记忆障碍、行为模式等发生变化,降低了AD患者生活自理能力,增加了跌倒等意外事件发生的风险[9-10],极易引发骨折、出血等一系列并发症。因患者长期运动功能受限,卧床时间长,深静脉血栓形成,增加了肺部感染的概率。由Aβ引发的炎症反应可导致脑血管系统受损,使AD患者更易伴发脑血管病变[3],成为AD患者紧急就医治疗的主要原因,严重者可致残甚至致死[11],进一步威胁着AD患者的身心健康,增加了家庭生活和社会经济负担[12]。因此,有效防治AD发生与发展具有重要意义。
流行病学调查发现,绝经后妇女AD的发病率高出同年龄男性2~3倍[6],而绝经后妇女最显著的变化即为雌激素[主要为雌二醇(E2)]水平的明显降低。已有研究证明AD女性患者血清中E2水平同样明显降低,其记忆水平的改变与E2含量改变呈正相关[13]。而且临床上应用雌激素替代疗法(ERT)也确有明显降低AD发生与发展的作用,但因其副作用明显,而限制了该疗法的应用与推广[14]。因此,治疗AD更加安全有效的方法亟待发现。
研究显示,E2通过非基因组效应激活细胞内的ERK/MAPK信号通路,是丝裂原MAPK信号通路中重要的一员,对细胞的生长、分化、分裂、死亡以及细胞间的功能同步化等起主要调节作用。激活的ERK/MAPK信号通路能进一步激活多种下游效应因子,如蛋白激酶、转录因子等,并调控基因的表达,共同作用于神经系统,进而发挥减缓AD相关病理变化及抑制细胞凋亡的保护作用[7]。经典ERK/MAPK信号通路通过三级酶促级联反应激活,促使ERK磷酸化形成p-ERK,从而发挥神经保护作用[15]。
中医经典“肾藏精”脏象理论认为,“肾生髓,脑为髓之海”。《医学入门》指出,“脑者髓之海……髓则肾主之”。由此可见,脑与肾关系密切,肾精充盈,则髓海得养,神机运转正常。AD发病与中医五脏中肾的关系最为密切,脾、肝两脏亦受累,肾虚证型最为多见,肾虚精亏、髓海不足是AD形成的基本病机[16],并始终贯穿该病的全过程,补肾填精、充髓健脑是防止该病的根本大法[17]。基于此,本研究中医辨证论治以补肾法立法组方,选取淫羊藿、补骨脂、制首乌、女贞子4味补肾中药作为基础方。方中制首乌补肝肾,益精血,乌须发,强筋骨;女贞子滋补肝肾,明目;二者合用补肝肾,益精髓,肾阴得养则五脏安。淫羊藿补肾壮阳,祛风除湿,强筋骨;补骨脂补肾壮阳,温脾补肾益精;两者合用,温补脾肾,兴阳壮志,肾阳强则五脏得之温煦。四药合用取之“阴中求阳,阳中求阴”之意,相辅相成,共奏补肾填精、充髓健脑之功。
Morris水迷宫实验结果显示,中药组大鼠潜伏时间延长,穿越平台次数增加,提示补肾复方中药能显著提高AD模型大鼠学习及空间记忆能力,改善其空间记忆受损情况。同时,补肾复方中药可抑制AD模型大鼠海马神经元的凋亡,进而发挥神经保护的作用。补肾法中药干预后,可明显增加AD模型大鼠脑组织中ERK/MAPK信号通路中关键靶点蛋白p-ERK1/2蛋白的表达,说明补肾法中药具有激活ERK/MAPK信号通路的作用。而活化的ERK/MAPK信号通路,可能通过调控下游一系列效应因子继而发挥减缓AD相关病理变化及细胞凋亡发生的保护作用。
综上所述,补肾法中药对Aβ25-35诱导的AD模型大鼠海马神经元损伤具有保护作用,可明显改善AD模型大鼠认知和记忆能力,抑制海马神经元凋亡,其神经保护作用机制可能与调控p-ERK1/2蛋白表达,激活ERK/MAPK信号通路有关。
