2例小婴儿睾丸卵黄囊瘤的诊断及治疗
2022-11-23杨福江戴春娟赵绪稳王金虎杜晓斌马林胡博
杨福江,戴春娟,赵绪稳,王金虎,杜晓斌,马林,胡博
天津市儿童医院新生儿外科,天津 300074
儿童原发性睾丸肿瘤较少见,约占儿童实体肿瘤的2%左右。三个月内小婴儿的睾丸肿瘤更加少见,而三个月内小婴儿睾丸卵黄囊瘤(yolk sac tumor,YST)极为罕见,目前国内外对该年龄段睾丸肿瘤的临床特点、治疗及诊治方法尚无系统描述。为提高临床医师对三个月内小婴儿睾丸卵黄囊瘤的认知。现对我院收治的2例<3月龄睾丸卵黄囊瘤患儿的临床资料作回顾性分析,总结其有效诊断、治疗方法,现报告如下。
1 资料分析
患儿1,男,出生1 天,G3P2,足月顺产,出生体质量3 590 g,患儿出生后即被家属发现右侧阴囊内肿物并于我院就诊。父母体健,非近亲婚配,否认类似疾病史。查体可见患儿右侧阴囊内质韧、光滑、无压痛性肿物,边界清,可及沉重感,睾丸、附睾触诊不清。血清甲胎蛋白(AFP)水平升高(>1 000 ng/mL)。胸腹联合X 线检查提示右侧阴囊内软组织密度影。超声检查显示右睾丸无正常睾丸声像,可见约47 mm×29 mm×37 mm 混杂回声肿块,边界清晰,形态规整,内部可见多个大小不等无回声区,周边存在血流信号,双侧腹股沟区未见确切肿块。腹盆磁共振成像(MRI)检查提示右阴囊内混杂信号包块,呈不均匀强化,其内伴多发片状无回声区。拟诊为右侧睾丸肿瘤。术前相关检查未见淋巴结肿大。患儿行全麻下经阴囊切口行精索高位离断睾丸切除术,术中见右侧精索血管迂曲,右睾丸、附睾肿胀,自白膜表面大量迂曲血管,高位阻断精索血管后,保护术区避免肿瘤细胞种植,切开白膜可见大量黄色脂肪样组织伴粘稠液。术后病理组织检查诊断为右侧睾丸卵黄囊瘤,精索断端未见肿瘤侵犯;肿块约4.0 cm×4.0 cm×2.0 cm,切面淡黄色,似有黏液,镜下瘤细胞呈疏网状、巢状、腺泡样或乳突状排列(见图1);免疫组化检查可见:CK 阳性、AFP 阳性、vimentin 间质阳性、CD117 阳性、GPC3 阳性、CD30 阴性、inhibin 阴性,EMA 阴性,SYN 阴性,Ki67 比例55%。术后第7 天患儿出院,术后6 周复查血清AFP>1 000 ng/mL,X 线检查及腹部超声检查未见明显异常,术后8 周于外院复查血清AFP 仍>1 000 ng/mL,PET-CT 检查检查可见卵黄囊瘤骨转移,采用PVB(顺铂+ 长春新碱+ 博来霉素)化疗3 个周期,复查血清AFP 10.7ng/mL,随访至今24 个月。
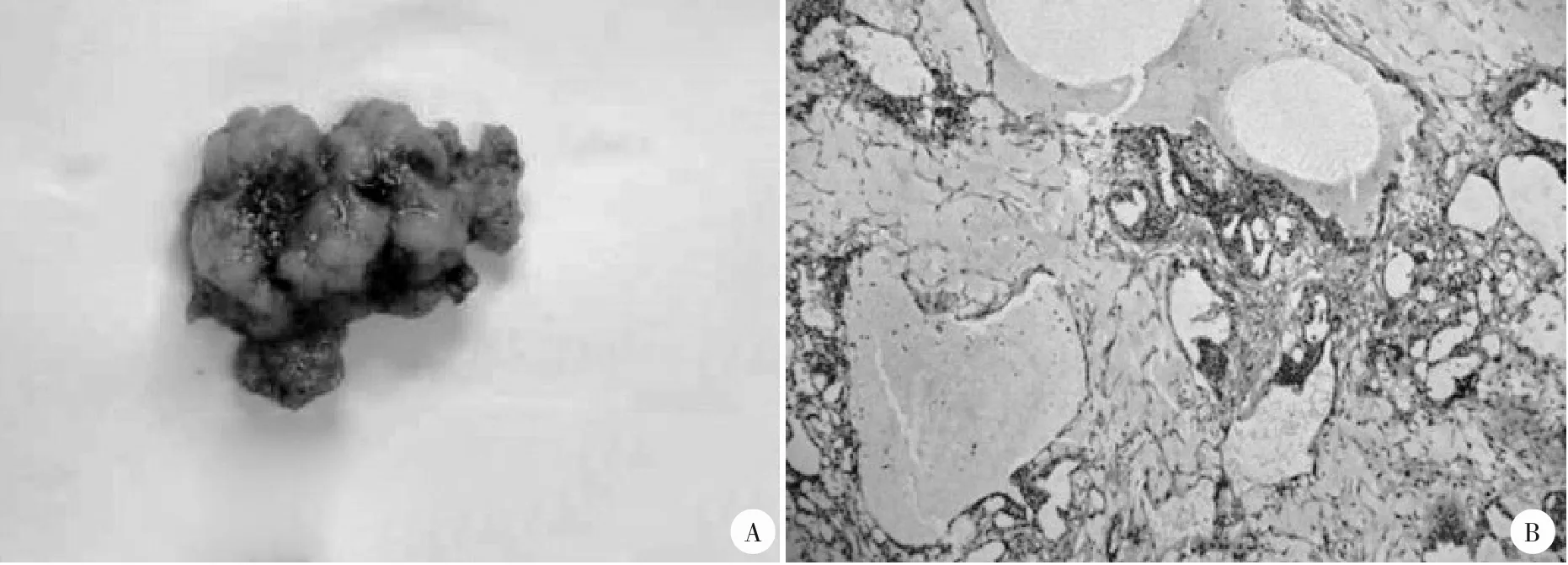
图1 患儿1右侧阴囊肿块手术切除标本剖面及睾丸卵黄囊瘤的病理组织图像
患儿2,男,出生65 天,G2P2,足月顺产,出生体质量3 050 g,父母体健,非近亲婚配,否认类似疾病史。出生第30 天家属发现患儿左侧阴囊内肿物,于当地基层医院就诊,考虑鞘膜积液,未行超声检查,家属继续观察,后因“发现左侧阴囊肿物35 d”就诊于我院。查体可见患儿左侧阴囊内质韧、光滑肿物,界清,可及沉重感,无压痛。血清AFP 538 ng/mL。胸腹联合X 线检查可见左阴囊内软组织密度影。超声检查示左阴囊内约45 mm×36 mm×27 mm 中等回声肿块,内可见多处片状及不规整无回声区,边缘清晰,形态规整,其边缘似可见少量残存睾丸声像,肿块内可检出较丰富血流信号,肿块内可见较粗大动静脉血管。MRI 检查示左阴囊内混杂信号包块,边界较清晰,呈明显不均匀强化,其内多发片状无回声坏死区。拟诊左睾丸肿瘤。完善术前相关检查后未见淋巴结受累,患儿2行全麻下经阴囊切口行精索高位离断睾丸切除术。术中见肿物大小约5.0 cm×4.5 cm×2.5 cm,呈浅黄灰色,质韧,其上端可见部分残留的附睾组织,未见正常睾丸组织,高位阻断精索血管后,保护术区避免肿瘤细胞种植后,切开白膜可见少量脂肪样组织。术后病理组织检查诊断为左侧睾丸卵黄囊瘤,精索断端未见肿瘤侵犯;肿物大小约4.2 cm×3.2 cm×2.6 cm,灰白色,质细腻,镜下瘤细胞呈网状、乳突状、腺管样、腺泡样排列(见图2);免疫组化检查可见CK 阳性、AFP 部分阳性、Glypican-3 少数阳性、EMA 少数阳性、S-100 阴性、desmin 阴性、syn 阴性、Ki-67 比例约60%~70%。术后1 周出院时复查血清AFP 360 ng/mL,术后6 周复查血清AFP102 ng/mL,后分别于术后12 周、24 周复查AFP 均在月龄组正常范围内,术后36 周复查血清AFP14 ng/mL,术后未予化疗,定期随访至今34 个月,无肿瘤复发迹象。
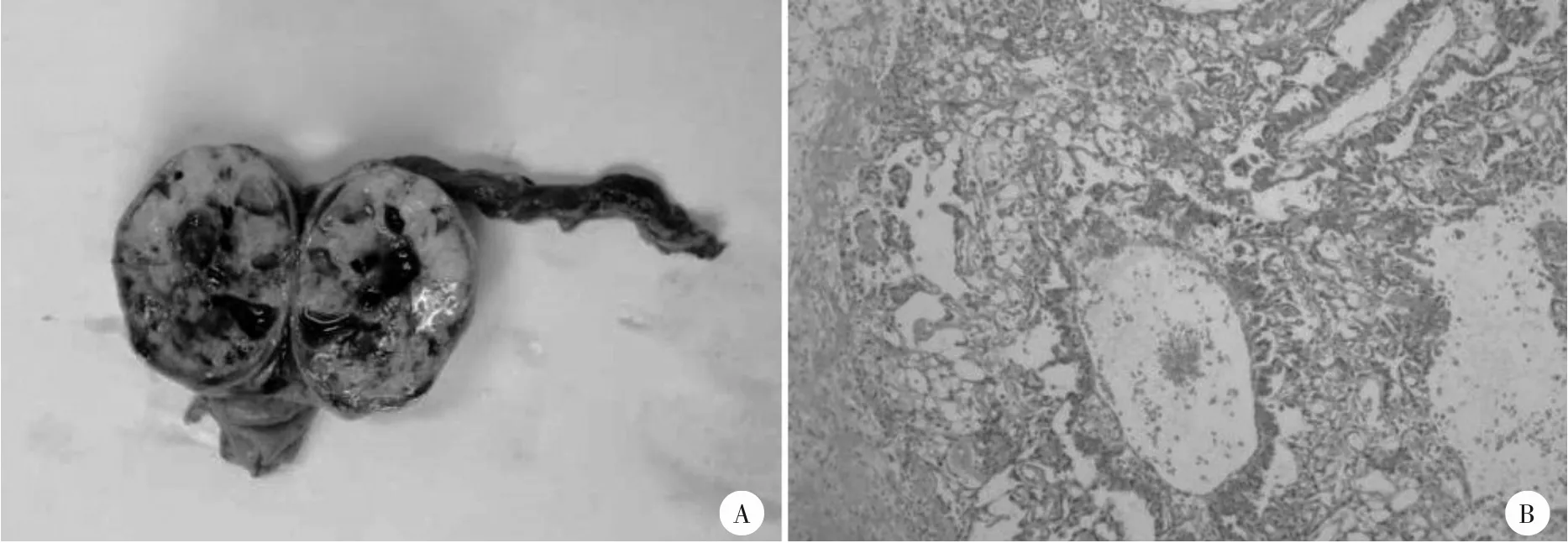
图2 患儿2左侧阴囊肿块手术切除标本剖面及睾丸卵黄囊瘤的病理组织图像
2 讨论
卵黄囊瘤又称内胚窦瘤,在儿童实体肿瘤中较少见,恶性度高,主要发生于性腺组织,亦可见于性腺外;发病原因不明,可能与遗传、内分泌障碍、外伤、感染等有关。儿童睾丸卵黄囊瘤多发生于三个月以上的儿童,高峰期在2 岁前,三个月以下小婴儿发生者极为少见[1-2]。根据既往文献报道及我院治疗经验,将该年龄段睾丸卵黄囊瘤特点总结如下。
儿童睾丸卵黄囊瘤多表现为患侧无痛性阴囊肿块或肿胀,若阴囊增大明显,可早期发现病变;同时可合并其它病变,如鞘膜积液、隐睾、腹股沟斜疝等,双侧均可发病,且无明显侧别差异[2]。小婴儿因其特殊的生长发育阶段,无法表述自身不适,家长亦可能疏于观察,同时,我国小儿外科医师数量有限,且基层医师缺乏相应诊疗经验,易导致误诊。本研究中,患儿2出生第30天曾于当地医院就诊,但临床考虑鞘膜积液,未进一步明确诊断,后于我院再次就诊时发现睾丸肿瘤。儿童睾丸卵黄囊瘤体征并不典型,小婴儿期也是如此,临床医生需仔细查体,通过透光试验、睾丸沉重感、触痛及包块能否还纳入腹腔等进行鉴别,同时结合超声检查结果,明确卵黄囊瘤诊断。
卵黄囊瘤是由全能性生殖细胞向胚外中胚层及内胚层分化而成,可产生AFP。血清AFP 是卵黄囊瘤的特异性诊断指标之一。虽然小婴儿APF 存在生理性增高,但并不影像其对卵黄囊瘤的诊断意义。血清AFP 的半衰期随月龄不同而改变,生后2周 内AFP 半 衰 期 为5.5 天,2 周~2 个 月 为11 天,2~4 个月为33 天,且血清AFP 水平生理性增高只表现为稍高于正常范围,随月龄增大逐渐下降,至生后8 个月时接近成人水平,足月儿血清AFP(48 406 ± 34 718)ng/mL,生后1 个月(2 654 ± 3 080)ng/mL,生后2 个月(323 ± 278)ng/mL,生后三个月(88±87)ng/mL,生后4 个月(74±56)ng/mL,生后6 个月(12.5 ± 9.8)ng/mL,生后8 个月(8.5 ± 5.5)ng/mL[3-4]。血清AFP 作为卵黄囊瘤特异性肿瘤标记物,对于小婴儿期卵黄囊瘤的诊断、疗效评估及术后监测具有同样重要的临床价值。术前血清AFP 水平明显升高提示睾丸卵黄囊瘤可能性较大,参考不同月龄血清AFP 范围,可作为鉴别睾丸成熟畸胎瘤、表皮样囊肿等其它睾丸肿物性质疾病的一项重要指标。术后血清AFP 值应于4~6 周后恢复正常,如术后连续监测血清AFP,4~6 周仍未降至正常范围或降低后再次升高,应考虑手术不彻底或已有肿瘤转移,需进一步进行转移灶切除及临床化疗[5]。
睾丸卵黄囊瘤彩超多表现为局限性均质肿块、囊实性肿块或伴囊性成分、不均质肿块,CDFI 显示肿块周边及内部有丰富血流信号;另外,彩超尚可用于鉴别睾丸畸胎瘤、表皮样囊肿、鞘膜积液等其它睾丸肿块性质疾病[6-7]。故对于小婴儿期阴囊肿物患儿,除进行必需的触诊、透光试验等,切勿简单的认为是鞘膜积液、腹股沟斜疝等常见病,建议常规检查睾丸彩超,以免遗漏此类恶性占位性疾病。
睾丸卵黄囊瘤的CT 可表现为睾丸白膜内圆形或类圆形混杂密度肿块,边界多清晰,部分可见包膜;增强扫描呈实质部分不均匀强化。MRI 检查中T1WI 可表现为混杂信号、等或等低信号;T12WI 病灶可呈稍高信号,等或等高信号;增强扫描可见肿块实质部分不同程度强化,病灶内出血、坏死、囊变部分无强化[8]。对于小婴儿睾丸卵黄囊瘤,CT 及MRI能够较好显示肿瘤的形态、血供情况、腹膜后淋巴结情况,有助于卵黄囊瘤的诊断及进行较为准确的临床分期和指导手术方式。但CT 检查因电离辐射对生殖系统的创伤,对于小婴儿睾丸肿瘤者,选择MRI进行术前评估更加无创。
临床治疗方案与肿瘤临床分期密切相关。卵黄囊瘤的临床分期多依据美国癌症联合委员会提出的睾丸肿瘤分期:Ⅰ期为局限病变,无区域淋巴结转移;Ⅱ期为伴有区域淋巴结转移,Ⅲ期为伴有远处转移,便于进行临床手术方式选择及预后评估[9]。对于Ⅰ期睾丸卵黄囊瘤的手术方式目前存在较多争议,因睾丸卵黄囊瘤为恶性肿瘤,且易早期发生腹膜后等转移,有学者建议行精索高位离断睾丸切除术并腹膜后淋巴结清扫术或以术后化疗替代腹膜后淋巴结清扫,但目前多数学者[5,10]认为,Ⅰ期睾丸卵黄囊瘤行精索高位离断睾丸切除术足够,预防性淋巴结清扫并不提倡,腹膜后淋巴结清扫与预后无关,且容易造成术后淋巴瘘或肠麻痹等并发症。早期的睾丸卵黄囊瘤经腹股沟行精索高位离断睾丸切除即可取得良好效果,但该术式需切开腹股沟管,破坏局部解剖结构,存在腹股沟疝风险。对于小婴儿期未发现转移的睾丸卵黄囊瘤,因该年龄段儿童腹股沟管很短,接近垂直走行[11],精索分离至同侧腹股沟内环口处较容易,无需切开腹股沟管即可达到高位精索离断的目的。近年,已有学者[12]尝试对≤3 岁早期睾丸卵黄囊瘤患儿,经阴囊切口手术治疗,肿瘤及精索切除范围确切,手术难度低,且创伤小,切口美观,疗效满意,无不良并发症。本研究中,2 例患儿均采用经阴囊切口高位精索离断,操作顺利,肿瘤及精索切除完整,愈合后近乎无瘢痕,故对于小婴儿期Ⅰ期睾丸卵黄囊瘤,提倡采用经阴囊入路精索高位离断睾丸切除术,以减少对下腹部解剖结构的破坏。对于Ⅱ~Ⅲ期病例,目前绝大多数学者认为行精索高位离断睾丸切除术切除肿瘤原发病灶外,仍需腹膜后淋巴结清扫并辅助化疗治疗[1]。
对于术后临床化疗,目前争议主要集中于对Ⅰ期睾丸卵黄囊瘤患儿是否进行术后化疗,有学者认为睾丸卵黄囊瘤具有恶性度高,易发生转移的特点,对Ⅰ期术后常规化疗,可改善其预后[13]。也有研究[14]指出常规化疗与发现复发危险后再行化疗对疾病预后无影响。多数学者[15]认为,睾丸卵黄囊瘤的预后与患儿发病年龄有关,年龄越小,肿瘤的生长越慢,恶性度也越低,患儿预后越好。对于三个月内小婴儿睾丸卵黄囊瘤,因该年龄段发病率低,病例数极少,缺乏系统研究,目前多数研究均集中在三个月以上儿童,按照目前研究结果推论,三个月内小婴儿期睾丸卵黄囊瘤的预后较稍大龄儿童略好,但仍需大量临床研究论证。本研究中2 例患儿通过术前检查综合评估,未发现局部淋巴结及腹膜后淋巴结肿大,考虑到该肿瘤恶性程度的年龄段特点及化疗对患儿身体状态的影响,仅行经阴囊行精索高位离断睾丸切除术,术后均未行常规临床化疗,采用严密监测胸片、腹部超声及AFP 的方法,1 例术后8 周血清AFP 水平无明显下降,后经PEC-CT 证实骨转移,开始规律化疗,效果良好,监测AFP 未见再次升高,另一例术后6 周AFP 恢复正常,随访至今,效果良好,未发现复发及转移的临床证据。卵黄囊瘤术后应严密监测胸片、腹部超声及AFP 的变化,对高危患儿仍需及时进行临床化疗,以免延误补救治疗的时机。
综上所述,三个月内小婴儿睾丸卵黄囊瘤主要临床表现为睾丸肿块,超声检查睾丸混杂回声肿块,血清AFP 水平升高。临床表现、实验室检查结合术后病理组织检查可明确睾丸卵黄囊瘤诊断。三个月内小婴儿睾丸卵黄囊瘤的治疗首选精索高位离断式睾丸切除术,后期可联合腹膜后淋巴结清扫术及临床化疗,从而改善患儿预后。
