CTLA4-Ig 腹腔注射对大鼠实验性自身免疫性重症肌无力的治疗作用及其机制
2022-11-23焦子洋梁培鑫薛占霞郑立卿董晓华吴苗苗武海霞侯勇
焦子洋,梁培鑫,薛占霞,郑立卿,董晓华,吴苗苗,武海霞,侯勇
河北北方学院药学院,河北省神经药理学重点实验室,河北 张家口 075000
重症肌无力(myasthenia gravis,MG)是一种慢性获得性自身免疫性疾病,其病因及发病机制尚未阐明,地塞米松是目前临床常用的MG 治疗药物[1]。研究[2-3]发现,胸腺淋巴细胞的凋亡失控可能是MG的主要发病机制之一。细胞凋亡(apoptosis)又称细胞程序化死亡(programmed cell death,PCD),是指机体为维持内环境稳定,由多基因严格控制的细胞主动死亡过程[4]。Fas、B 细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)和半胱氨酸天冬氨酸特异蛋白酶(cysteinyl aspartate specific protease,Caspases)基因是调控淋巴细胞凋亡的相关基因[5-6]。凋亡相关因子Fas 能促进胸腺细胞的阴性选择,影响自身反应性胸腺细胞的凋亡[7]。Bcl-2 可抑制细胞凋亡,而B细胞淋巴瘤-2相关X 蛋白(B-cell lymphoma-2 associated X protein,Bax)可促进细胞凋亡,二者均参与胸腺细胞成熟过程中的正负选择[8]。Bcl-2 基因表达的上调可导致胸腺组织T 细胞具备抗凋亡能力,最终诱发MG[9]。Bax/Bcl-2 变化与MG 的预后密切相关[10]。此外,研究[11]表明,Caspase 家族也参与MG或实验性自身免疫性重症肌无力(experimental autoimmune myasthenia gravis,EAMG)胸腺细胞凋亡障碍的发生。细胞毒性T 淋巴细胞抗原4(cytotoxic T lymphocyte antigen-4,CTLA4)是一种负性调控分子,可通过CD28/B7 介导的共刺激通路,防止细胞无序或过度活化,将免疫应答控制在可控范围[12]。细胞毒性T 淋巴细胞抗原4 免疫球蛋白(cytotoxic T lymphocyte antigen-4 immunolobulin,CTLA4-Ig)是由CTLA4 胞外区与IgG 的Fc 段融合构建而成的,可有效抑制初始T 细胞的活化,诱导T 细胞进入无能状态,表现为对特定抗原的不应答[13]。本研究组前期研究[14]结果表明,CTLA4-Ig 可通过抑制CD28/B7 信号通路,减缓MG 的发生发展;CTLA4-Ig 可抑制EAMG大鼠淋巴细胞的增殖。CTLA4-Ig是否通过影响胸腺组织相关凋亡基因的表达,发挥MG 治疗作用,目前尚未有相关报道。因此,我们观察了CTLA4-Ig 腹腔注射对大鼠EAMG 的治疗作用,并探讨其可能作用机制,现将结果报告如下。
1 材料与方法
1.1 动物、试剂及仪器 45 只雌性Lewis 大鼠(7~8 周龄,体质量140~160 g)购自南京大学模型动物研究中心,在无特定病原体(no specific pathogen,SPF)环境中饲养,室温(24±2)℃,12 h 光/暗循环,40%~70%相对湿度,自由获得食物和水。本研究期间动物实验均严格遵守动物伦理要求。乙酰胆碱受体(AchR)α97-116肽序列、完全弗氏佐剂(CFA)、不完全弗氏佐剂(IFA)、AChRab 及AChR ELISA 试剂盒购于美国Sigma 公司;磷酸盐缓冲液(PBS)购于湖北武汉华东生物科技有限公司;地塞米松购于中国天津医药集团有限公司;CTLA4-Ig 购于美国BD公司;TRIzol 购于美国Invitrogen 公司;TaKaRa RNA PCR Kit(AMV)Ver. 3.0 购于中国大连宝生物工程有限公司。Caspase-3、Caspase-8、Caspase-9 活性检测试剂盒购于南京凯基生物发展有限公司产品。PCR扩增仪(德国),低温超速离心机(北京安亭仪器设备厂,中国)。
1.2 EAMG 模型构建 取35 只大鼠,用AchR α 97-116 肽免疫法构建EAMG 大鼠模型。50 μg 的AChR α97-116 肽和CFA 混合制备200 μL 乳液,然后将其皮下注射至大鼠的颈部、背部和足垫区域(注射当天为第1 天)。第30、60 天分别在初次免疫注射部位等剂量进行强化免疫。另外10 只大鼠为正常对照(对照组),于同期予等量生理盐水。在第74 天评估EAMG 模型是否成功。依据大鼠临床表现判断EAMG 造模是否成功。与对照组比较,EAMG 模型大鼠造模2 周后出现爬行无力、背颈部皮毛松弛等MG 症状,4 周后症状明显加重,包括呼吸困难,头部震颤,背部出现肿块,毛发倒竖,行走困难,奄奄一息。最终30 只大鼠造模成功。
1.3 大鼠分组及CTLA4-Ig 给予方法 将30 只EAMG 模型大鼠随机分为CTLA4-Ig 组、EAMG 组及地塞米松组,每组各10 只。第74 天时CTLA4-Ig 组大鼠用2 mg/kg 的CTLA4-Ig 腹腔注射,地塞米松组用1 mg/kg的地塞米松腹腔注射,EAMG组及对照组大鼠腹腔注射同体积PBS,1 天1 次(间隔24 h),持续至第130 天。CTLA4-Ig 给予期间,EAMG 组大鼠死亡1只,对照组麻醉死亡1只。因此每组选取9只大鼠进行后续实验。
1.4 各组大鼠体质量及肌力观察 分别于第74、102、130 天记录各组大鼠体质量,观察并记录大鼠肌力。Lennon 评分0 级:没有显著的MG 症状,计0分;1 级:活动减少、轻微抓挠或哭声减少,计1 分;2级:前肢屈曲、低头、驼背、动作不协调,计2分;3级:严重的MG 表现,无哭无爬,震颤,处于垂死状态,计3分。如果大鼠的症状在上述4级之间,评分为0.5、1.5和2.5分。
1.5 标本留取及指标检测 分别于第74、102、130天采集各组大鼠尾静脉血,第130 天同时采集大鼠后肢肌肉组织和胸腺组织。
1.5.1 各组大鼠血清AChR IgG、AChR IgG 2b 及后肢肌肉组织AChR 含量检测 ①采用ELISA 法检测血清AChR IgG、AChR IgG 2b。所有操作均严格按照试剂盒说明书进行,采用酶标仪测定450 nm 处的光密度(OD)值,重复测定3 次取平均值。②取各组大鼠后肢肌肉组织,0.01 mol/L PBS 匀浆后离心20 min。弃上清,将沉淀物重新悬浮含有2% Triton X-100 的缓冲液中。根据说明书,使用大鼠AChR ELISA 试剂盒检测上清液AChR 含量,重复测定3 次取平均值。
1.5.2 各组大鼠胸腺组织凋亡相关基因mRNA 检测 采用RT-PCR 法检测各组大鼠胸腺组织Fas、FasL、Bcl-2、Bax、Caspases-3、Caspases-8和Caspases-9基因mRNA 表达。取各组大鼠胸腺组织,提取总RNA,紫外分光光度测定RNA浓度,参考文献[15]测定凋亡相关基因mRNA,以TATA 盒式蛋白编码基因(Tbp)为内参。根据试剂盒说明书加入各反应试剂进行逆转录及cDNA 扩增。逆转录反应程序:30 ℃、10 min,50 ℃、30 min,99 ℃、5 min,5 ℃、5 min;PCR扩增:94 ℃预变性2 min;94 ℃变性40 s;51 ℃~57.5 ℃,复性40 s;72 ℃延伸40 s,循环35~40次,72 ℃延伸加时10 min。琼脂糖凝胶电泳,Fluorochem 5500成像系统采集图像,以各凋亡相关基因mRNA吸光度和Tbp吸光度比值表示其mRNA相对表达量。凋亡相关基因和Tbp的引物序列见表1。

表1 凋亡相关基因和Tbp引物序列
1.5.3 各组大鼠胸腺组织Caspases-3、Caspases-8和Caspases-9 活性检测 采用紫外分光法检测各组大鼠胸腺组织Caspases-3、Caspases-8 和Caspases-9活性。所有操作均严格按照检测试剂盒说明书进行。测定405 nm时的最大吸收峰值即为Caspases-3、Caspases-8 和Caspases-9 活性值,重复测定3 次,取平均值。
1.6 统计学方法 采用SPSS21.0 统计软件进行数据处理。采用Shapiro-Wilk 检验进行正态性检验,正态分布的计量资料以±s表示,多组间比较采用方差分析,如组间比较差异有统计学意义则采用LSD-t检验进行两两比较;非正态分布的计量资料以M(P25,P75)表示,组间比较采用秩和检验。P<0.05为差异具有统计学意义。
2 结果
2.1 第74、102、130天各组大鼠体质量及Lennon评分比较 第74、102、130 天各组大鼠体质量及Lennon评分比较见表1、2。
表1 第74、102、130天各组大鼠体质量及Lennon评分比较(g,±s)

表1 第74、102、130天各组大鼠体质量及Lennon评分比较(g,±s)
注:与对照组比较,*P<0.05;与EAMG组比较,#P<0.05。
体质量组别CTLA4-Ig 组EAMG组地塞米松组对照组第74天151.66±4.72 150.43±3.32 149.76±4.31 147.21±4.52第102天222.15±11.68#176.44±10.87*221.34±9.01#212.43±13.71第130天230.28±11.46#184.32±12.43*232.06±10.52#222.73±12.09
表2 第74、102、130天各组大鼠Lennon评分比较(分,±s)
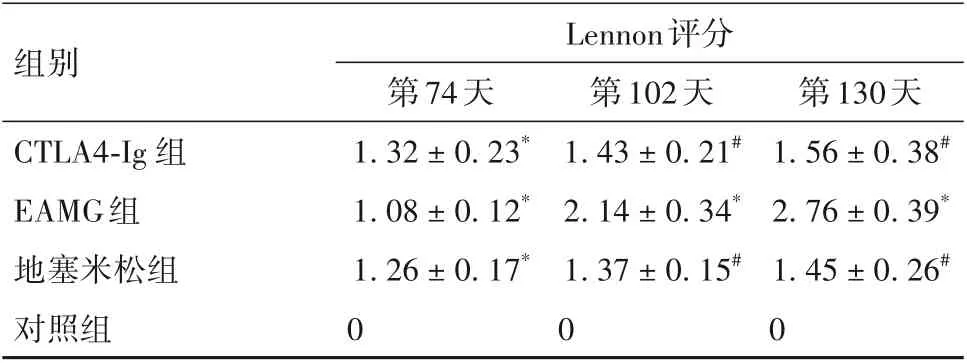
表2 第74、102、130天各组大鼠Lennon评分比较(分,±s)
注:与对照组比较,*P<0.05;与EAMG组比较,#P<0.05。
组别CTLA4-Ig 组EAMG组地塞米松组对照组Lennon评分第130天1.56±0.38#2.76±0.39*1.45±0.26#0第74天1.32±0.23*1.08±0.12*1.26±0.17*0第102天1.43±0.21#2.14±0.34*1.37±0.15#0
2.2 各组大鼠血清AChR IgG、AChR IgG 2b 及后肢肌肉组织AChR含量比较 第74、102、130天各组大鼠血清AChR IgG、AChR IgG 2b 水平比较见表3、4。第130天CTLA4-Ig 组、EAMG组、地塞米松组及对照组大鼠后肢肌肉组织中AChR 含量分别为(4.84 ±0.37)、(2.54 ± 0.24)、(5.69 ± 0.48)、(7.43 ±0.87)μg/L,与对照组比较,EAMG 组大鼠后肢肌肉组织中AChR 含量降低(P<0.05);与EAMG 组比较,地塞米松组和CTLA4-Ig组大鼠后肢肌肉组织AChR含量增加(P<0.05)。
表3 第74、102、130天各组大鼠血清AChR IgG水平比较(µg/L,±s)

表3 第74、102、130天各组大鼠血清AChR IgG水平比较(µg/L,±s)
注:与对照组比较,*P<0.05;与EAMG组比较,#P<0.05。
组别AChR IgG CTLA4-Ig 组EAMG组地塞米松组对照组第130天0.17±0.04#0.64±0.08*0.15±0.04#0.17±0.02第74天0.27±0.04*0.26±0.02*0.25±0.03*0.12±0.03第102天0.12±0.01#0.42±0.05*0.11±0.02#0.17±0.04
2.3 各组大鼠胸腺组织Fas、FasL、Bcl-2、Bax、Caspases-3、Caspases-8 和Caspases-9 mRNA 相对表达量比较 各组大鼠胸腺组织Fas、FasL、Bcl-2、Bax、Caspases-3、Caspases-8 和Caspases-9 的mRNA 相对表达量比较见表5、6。CTLA4-Ig 组、EAMG 组、地塞米松组及对照组Bax/Bcl-2 分别为(1.88±0.08)、(0.60±0.02)、(1.65±0.09)、(0.99±0.08),与对照组比较,EAMG 组大鼠Bax/Bcl-2 降低(P<0.05);与EAMG 组比较,地塞米松组和CTLA4-Ig 组大鼠Bax/Bcl-2 增加(P<0.05)。
表4 第74、102、130天各组大鼠血清AchR IgG 2b水平比较(µg/L,±s)

表4 第74、102、130天各组大鼠血清AchR IgG 2b水平比较(µg/L,±s)
注:与对照组比较,*P<0.05;与EAMG组比较,#P<0.05。
组别CTLA4-Ig 组EAMG组地塞米松组对照组AchR IgG 2b第130天0.14±0.02#0.58±0.07*0.11±0.03#0.09±0.02第74天0.19±0.02*0.18±0.01*0.20±0.03*0.06±0.01第102天0.12±0.04#0.35±0.02*0.13±0.02#0.11±0.03
表5 各组大鼠胸腺组织Fas、FasL、Bcl-2、Bax的mRNA相对表达量比较(±s)

表5 各组大鼠胸腺组织Fas、FasL、Bcl-2、Bax的mRNA相对表达量比较(±s)
注:与对照组比较,*P<0.05;与EAMG组比较,#P<0.05。
组别CTLA4-Ig 组EAMG 组地塞米松组对照组Bax mRNA 0.79±0.01#0.44±0.02 0.73±0.03#0.43±0.01 Fas mRNA 0.59±0.04*0.57±0.03*0.61±0.02*0.35±0.01 FasL mRNA 0.82±0.06#0.56±0.03 0.83±0.05#0.54±0.01 Bcl-2 mRNA 0.42±0.04#0.73±0.02*0.44±0.03#0.44±0.01
表6 各组大鼠胸腺组织Caspases-3、Caspases-8和Caspases-9的mRNA相对表达量比较(±s)

表6 各组大鼠胸腺组织Caspases-3、Caspases-8和Caspases-9的mRNA相对表达量比较(±s)
注:与对照组比较,*P<0.05;与EAMG组比较,#P<0.05。
组别CTLA4-Ig 组EAMG 组地塞米松组对照组Caspases-9 mRNA 0.88±0.07#0.52±0.02*0.86±0.05#0.84±0.06 Caspases-3 mRNA 0.68±0.03#0.43±0.01*0.72±0.03#0.71±0.02 Caspases-8 mRNA 0.88±0.07#0.51±0.01*0.87±0.06#0.83±0.05
2.4 第130 天时各组大鼠胸腺组织Caspases-3、Caspases-8 和Caspases-9 活性比较 第130 天各组大鼠胸腺组织Caspases-3、Caspases-8 和Caspases-9活性比较见表7。
表7 第130天各组大鼠胸腺组织Caspases-3、Caspases-8和Caspases-9活性比较(±s)

表7 第130天各组大鼠胸腺组织Caspases-3、Caspases-8和Caspases-9活性比较(±s)
注:与对照组比较,*P<0.05;与EAMG组比较,#P<0.05。
组别CTLA4-Ig 组EAMG 组地塞米松组对照组Caspases-9 10.58±0.44#9.72±0.64*10.36±0.49#13.78±0.92 Caspases-3 5.39±0.48#2.38±0.15*5.73±0.37#4.63±0.62 Caspases-8 9.22±0.46#4.83±0.42*9.57±0.63#9.37±0.54
3 讨论
CD28/B7 介导的共刺激是淋巴细胞活化的重要辅助信号,并在MG 初次免疫反应中起着至关重要的作用[16]。CTLA4是B7分子的另一种天然受体,其介导的共刺激信号可防止细胞无序或过渡活化,将免疫应答控制在可控的范围内[12]。研究[13]证明,CTLA4 以比CD28 更大的亲和力结合B7-1 和B7-2,从而使其能比CD28 竞争其配体,最终将抑制信号传递给T 细胞。CTLA4 作为负性调控分子,其在自身免疫性疾病发生发展中的作用受到广泛关注[17]。将CTLA4 作为免疫靶点来治疗自身免疫性疾病的新途径已渐成趋势[14]。 CTLA4-Ig 是由CTLA4 其胞外区与IgG 的Fc 段融合构建而成。本研究结果表明,CTLA4-Ig 腹腔注射可明显改善EAMG 大鼠临床症状,并显著降低AChR IgG 和AChR IgG 2b 血清水平同时恢复后肢肌肉中AChR 含量。CTLA4-Ig发挥MG 治疗作用的机制可能与细胞凋亡机制密切相关。
研究[18]证实,Fas 及FasL 基因突变可导致T 细胞凋亡障碍,使某些自身反应性淋巴细胞无法被清除,从而导致Fas 及FasL 基因缺陷的大鼠易感EAMG。合并胸腺瘤的MG 患者胸腺组织Fas 表达升高[19];但另有研究[20]报道,MG 患者胸腺淋巴样滤泡组织中Fas 抗原表达降低。MG 患者胸腺组织Fas表达异常已达成共识,但其表达水平至今仍有争议,尚需进一步研究证实。该研究结果显示,与对照组比较,EAMG 组大鼠胸腺Fas mRNA 表达上调,但FasL mRNA表达无显著变化;Caspases-3和Caspases-8的mRNA 表达均下调且活性下降;与EAMG 组比较,CTLA4-Ig 组和地塞米松组FasL mRNA 表达上调;Caspases-3 和Caspases-8 的mRNA 表达均上调且活性增加。Caspases-8 是由Fas/FasL 家族介导,参与外源性细胞凋亡信号的传导[21]。研究[22]报道,Fas与FasL 结合,Fas 通过胞内区的死亡结构域(death domain,DD)招募有死亡结构域的Fas 相关蛋白(Fas-associated protein with death domain,FADD),FADD 氨基端的死亡效应域(death effector domain,DED)与Caspase-8氨基端原域(prodomain)中的DED相互作用,把Caspase-8 酶原募集到Fas 区域,形成死亡诱导信号复合体(death-inducing signal complex,DISC)。从而导致Caspases-8 自身水解活化,活化的Caspases-8 进一步激活其下游Caspases-3[23]。本研究结果显示,EAMG大鼠胸腺Fas mRNA表达上调,FasL mRNA 表达无显著变化,Caspases-8 mRNA表达下调,活性下降。推测Fas mRNA 表达以可溶型Fas(soluble Fas,sFas)表达上调为主。sFas 是由细胞膜表面Fas 分子从膜表面脱落而形成,sFas 与Fas 竞争结合FasL,干扰Fas/FasL 途径,导致“凋亡缺损”,其下游基因Caspases-8 因无激活信号而表达下调,活性下降[24]。CTLA4-Ig 干预后重新激活Fas/FasL 介导的细胞凋亡通路,进而Caspases-8 和Caspases-3的mRNA表达上调,活性增加。
生理条件下,胸腺组织T 淋巴细胞的阳性选择过程中Bcl-2 表达下降,促进CD4+CD8+双阳性细胞凋亡,而CD4+及CD8+单阳性T 淋巴细胞中的Bcl-2表达水平上升,抑制细胞凋亡,促进T淋巴细胞的进一步发育成熟,从而建立稳定的人体正常免疫系统[25]。Caspases-9是由Bcl-2家族介导的线粒体凋亡通路的启始因子。当细胞受到一些体内外信号刺激时,Bcl-2 家族相关蛋白活化,使线粒体膜通透性增加,细胞色素C(cytochrome c,Cytc)释放增加,其与Caspases-9 及凋亡活化因子-1(apoptosis activating factor -1,Apaf-1)结合,形成凋亡体,凋亡体再水解并释放Cytc,后者使Apaf-1进一步聚集,形成七聚复合物,具有较强的Caspase-9 激活活性,最终促进Caspase-9 自我剪切并活化。活化的Caspase-9 启动Caspase 级联反应激活Caspase-3,从而启动细胞调亡,Caspase-3 是执行细胞凋亡的关键因子[26-27]。研究[28]证明,Bax 与Bcl-2 的比例决定了线粒体膜的完整性及细胞凋亡的易感性。本研究结果显示,与对照组比较,EAMG 组大鼠胸腺Bcl-2 mRNA 表达上调,Bax mRNA 表达无明显变化,Bax/Bcl-2 显著降低;Caspases-3 和Caspases-9 的mRNA 表达均下调且活性下降;与EAMG 组比较,CTLA4-Ig 组和地塞米松组Bax mRNA 表达上调,Bcl-2 mRNA 表达下调,Bax/Bcl-2 升 高,Caspases-3 和Caspases-9 的mRNA表达均上调且活性增加。ALAKOU 等研究[6]表明,在接受胸腺切除术的MG 患者Bax/Bcl-2 增加,进而上调Caspase-3表达,最终调节与疾病进展相关的细胞凋亡,且Bax/Bcl-2 的大小可以预测MG 患者病情改善的情况,可视为一个独立的预后因素[6]。
综上所述,CTLA4-Ig 腹腔注射可改善EAMG 大鼠的临床症状。CTLA4-Ig 可能通过上调胸腺组织FasL mRNA、Bax mRNA 、Bcl-2mRNA、Caspases-3 mRNA、Caspases-8 mRNA 和Caspases-9 mRNA 表达,发挥MG治疗作用。
