每天予1 200 IU 维生素D 滴剂早产儿血清25-(OH)D水平、钙磷代谢及代谢性骨病发生情况观察
2022-11-23刘丽巧余建华米弘瑛王静刘庆瑜王立伟
刘丽巧,余建华,米弘瑛,王静,刘庆瑜,王立伟
1 云南省第一人民医院/昆明理工大学附属医院儿科,昆明 650100;2 安宁市第一人民医院儿科
近年来,早产儿的出生率及存活率逐年提高,早产儿代谢性骨病(metabolic bone disease of prematurity,MBDP)发生率也越来越高。早产儿的胎儿期钙(Ca)、磷(P)、维生素D 可能储备不足,出生后维生素D 摄入不足及追赶性生长等因素,常导致早产儿骨矿物质含量降低,骨皮质变薄,发生MBDP。MBDP 患儿身材矮小,病情严重者可出现佝偻病样表现,甚至骨折。MBDP 可能甚至影响患者成年期、老年期的骨骼状态[1-2]。合理补充维生素D 能有效预防MBDP,目前国内外对早产儿维生素D 的补充剂量建议较为宽泛,国内多根据2015 年《维生素D 缺乏及维生素D 缺乏性佝偻病防治建议》[3],即建议早产儿出生后尽早开始补充800~1 000 IU/d 维生素D。目前,早产儿的胎龄跨度较大,对所有胎龄<37周的早产儿均予一个标准的维生素D剂量似乎不够合理;且在上述推荐维生素D 补充剂量后仍有较多早产儿处于维生素D 不足状态。近年研究认为,早产儿出生后补充1 200 IU/d 维生素D 可能效果较好,但尚未得到证实,探讨早产儿合理的维生素D补充方案具有重要临床意义。我们观察了每天给予1 200 IU 维生素D 滴剂的早产儿血清25-羟维生素D25-(OH)D 水平、钙磷代谢及代谢性骨病发生情况,为建立早产儿补充维生素D 个体化诊疗方案提供一定理论依据。
1 资料与方法
1.1 临床资料 选取2020 年11 月—2021 年11 月期间在云南省第一人民出生并在NICU 住院治疗7天以上的早产儿127例。纳入标准:①我院NICU 住院治疗的胎龄<37 周早产儿;②家长对研究内容知情,并签署知情同意书;③本研究经医院伦理委员会批准通过(KHLL2020-KY061)。排除标准:①严重先天畸形或染色体异常;②患严重疾病如重度窒息、严重呼吸窘迫综合征、休克、坏死性小肠结肠炎BellⅡ期以上或消化道穿孔等;③母亲患有慢性肝、肾功能衰竭疾病或甲状旁腺疾病,孕期服用抗癫痫药物;④出现漏服维生素D 或自行停药等情况;⑤临床资料不完整。127 例早产儿中胎龄28~31+6周39 例,胎龄32~33+6周36 例,胎龄34~36+6周52 例。127例患儿分为A 组78 例、B 组49 例,两组性别、体质量、胎龄具有可比性。
1.2 早产儿分组及维生素D 补充方法 A 组从出生第8天起每天补充800 IU的维生素D滴剂,B组从出生第8天起每天补充800 IU的维生素D滴剂。
1.3 观察指标及方法 分别于出生第7、30、90 天清晨喂奶前抽取早产儿静脉血3 mL。①血清25-(OH)D水平 采用化学发光免疫法检测25-(OH)D。根据血清25-(OH)D 水平将早产儿分为四种营养状况:维生素D 缺乏(<10 ng/mL),维生素D 不足(10~30 ng/mL),维生素D 适宜(30~100 ng/mL),维生素D中毒(≥100 ng/mL)。②血清骨代谢指标检测 采用偶氮胂Ⅲ法检测血清钙(Ca),参考范围为2.11~2.52 mmol/L,采用磷钼酸紫外终点比色法检测血清磷(P),参考范围为1.25~2.50 mmol/L;采用磷酸对硝基苯法检测血清碱性磷酸酶(ALP),参考范围35~104 U/L。③观察两组MBDP 发生情况 MBDP 诊断标准为[4]:血清ALP>500 U/L 同时P<1.5 mmol/L。
1.4 统计学方法 采用SPSS 17.0 统计软件进行数据处理。采用分位数图和概率图进行正态性检验,符合正态分布的计量资料以-x ± s表示,两组间比较采用独立样本t检验,多组间均数比较采用单因素方差分析,组间两两比较时采用LSD检验,等级资料及不符合正态分布的采用秩和检验;计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 出生不同时间两组血清25-(OH)D 水平及维生素状况比较 出生第7、30、90 天时A 组的血清25-(OH)D 分别为(14.66±3.52)、(18.14±4.48)、(27.12 ± 7.23)ng/mL,B 组分别为(14.82 ± 3.58)、(19.30 ± 6.41)、(30.55 ± 8.95)ng/mL。与A 组比较,出 生 第90 天B 组 血 清25-(OH)D 水 平 高(P<0.05)。
A 组出生第7 天时维生素D 缺乏6 例、维生素D不足72 例,出生第30 天时维生素D 不足77 例、维生素D 适宜1 例,出生第90 天时维生素D 不足46 例、维生素D 适宜32 例。B 组出生第7 天时维生素D 缺乏1例、维生素D不足48例,出生第30天时维生素D缺乏2 例、维生素D 不足39 例,出生第90 天时维生素D 不足18 例、维生素D 适宜31 例。与A 组比较,出生第30、90 天时B 组早产儿维生素D 适宜比例高(χ2分别为2.139,5.954;P均<0.05)。
2.2 两组不同时间血清Ca、P、ALP 水平比较 出生第7、30、90 天时两组血清Ca、P、ALP 水平见表1。出生第7、30、90天时,两组血清Ca、P、ALP水平间差异均无统计学意义。
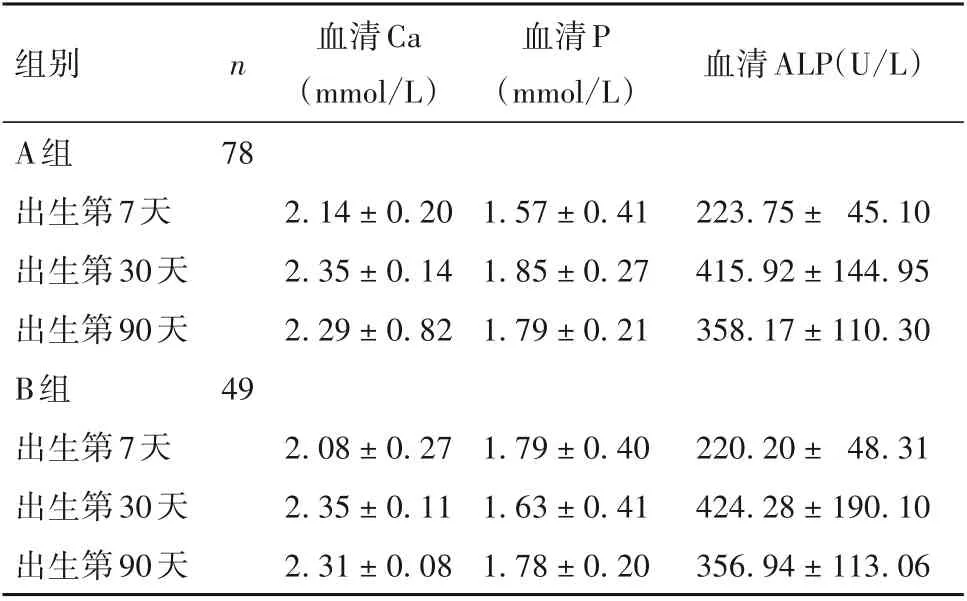
表1 出生第7、30、90天时两组血清Ca、P、ALP水平比较(-x±s)
2.3 不同胎龄早产儿出生第7 天血清Ca、P、ALP及25-(OH)D 水平比较 不同胎龄早产儿出生第7天血清Ca、P、ALP 及25-(OH)D 水平见表2。与其他各胎龄比较,28~31+6周早产儿血清Ca、P 水平低(P均<0.05)。

表2 不同胎龄早产儿出生第7天血清Ca、P、ALP及25-(OH)D水平(-x±s)
2.4 不同胎龄早产儿第90 天时维生素D 营养状况比较 补充800 IU/d 的早产儿中,28~31+6周早产儿第90 天维生素D 不足16 例、维生素D 适宜4 例,32~33+6周早产儿第90 天维生素D 不足14 例、维生素D 适宜9 例,34~36+6周早产儿第90 天维生素D不足16例、维生素D适宜19例。与28~31+6周早产儿比较,补充800 IU/d 的34~36+6周早产儿维生素D适宜比例高(χ2=5.980,P均<0.05)。
补充1200IU/d 的早产儿中,28~31+6周早产儿第90 天维生素D 不足11 例、维生素D 适宜8 例,32~33+6周早产儿第90 天维生素D 不足3 例、维生素D 适宜10 例,34~36+6周早产儿第90 天维生素D不足4 例、维生素D 适宜13 例。各胎龄早产儿第90天时维生素D营养状况间差异没有统计学意义。
2.5 两组MBDP 发生情况 出生第90 天A、B 组MBDP 分别为20、16例,两组MBDP 发生情况间差异无统计学意义(χ2=0.729,P>0.05)。
A 组MBDP 患 儿 出 生 第7、30、90 天 时 血 清25-(OH)D 分 别 为(14.78 ± 3.48)、(117.74 ±3.73)、(24.49±5.61)ng/mL,非MBDP 早产儿分别为(14.62±3.57)、(19.30±6.13)、(28.30±7.34)ng/mL。与非MBDP 早产儿比较,A 组MBDP 患儿出生 第90 天 时 血 清25-(OH)D 水 平 低(t=2.406,P<0.05)。
B 组MBDP 患 儿 出 生 第7、30、90 天 时 血 清25-(OH)D 分别为(14.89±1.93)、(15.62±3.79)、(23.77 ± 8.92)ng/mL,非MBDP 早 产 儿 分 别 为(14.80 ± 4.18)、(21.08 ± 6.69)、(33.84 ± 6.97)ng/mL。与非MBDP 早产儿比较,B 组MBDP 患儿出生 第90 天 时 血 清25-(OH)D 水 平 低(t=3.028,3.996;P均<0.05)。
3 讨论
MBDP 作为早产儿常见的并发症之一,是多种因素共同作用的结果。在早产、长期静脉营养、机械通气、各种并发症、合并症及药物治疗等的综合作用下,MBDP 高发,其在低出生体重儿中发病率约32%,极低出生体重儿中发病率高达55%,严重影响早产儿的骨骼健康,但本病起病隐匿,前期常无特异性临床表现,而临床诊断本病时常已产生不可逆的损伤[5-6],故早发现、早干预尤为重要[7]。
维生素D 在体内是一种具有生物活性的脂溶性类固醇衍生物,体内维生素D 的合成及分泌均受25-(OH)D 的调节,且因25-(OH)D 在血液中水平最高,最稳定,半衰期最长,因此是反映体内维生素D营养状况的最佳指标,也是骨代谢异常早期可靠的诊断指标[8-9]。同时作为一种神经内分泌—免疫调节激素,其还参与了肺发育、免疫系统成熟、神经系统分化等重要生理调节过程[10-12]。既往研究[13-14]显示维生素D 缺乏增加新生儿患败血症、坏死性小肠结肠炎、呼吸窘迫综合征及支气管肺发育不良等疾病的风险。维生素D 的主要作用是调节钙磷代谢,通过肠道吸收-肾脏排泄-回吸收这一过程进行调节,同时可调控PTH 的分泌、影响骨转化、调节骨骼多种基因表达、促进骨骼矿化,因此其是保持骨骼健康最为重要的内分泌激素之一。机体99%以上的钙以及85%以上的磷都是以羟基磷灰石的形式存在于骨骼中,维生素D 能维持骨骼中矿盐浓度在理想范围,有助于羟基磷灰石在骨基质中的沉积,保证骨骼的正常矿化,这与MBDP密切相关[5]。
RAMON 等[7]发现,血清25-(OH)D 水平较低时早产儿MBDP风险明显增加,且25-(OH)D水平高于70 nmol/L 时可以预防严重MBDP 的进展。本研究分析MBDP 与25-(OH)D 水平时发现,A 组3 月龄时MBDP 组与非MBDP 组25-(OH)D 间有统计学差异,B 组1 月龄及3 月龄时差异有统计学意义,并且两种补充剂量的MBDP 组25-(OH)D 水平均低于非MBDP 组,3 月龄时25-(OH)D 水平均值处于维生素D仍处于不足状态,由此可见,充足的维生素D 对于钙、磷的吸收以及维持正常的骨钙化至关重要,及时补充维生素D,保证25-(OH)D 在适宜范围,对促进早产儿骨骼发育和预防MBDP 具有重要意义,但是我们在分析补充维生素D 剂量与MBDP 的关系时发现,A 组MBDP 的发生率为25.64%,B 组的发生率为32.65%,两组间无统计学差异,这可能与本研究纳入样本量较少有关,未来应扩大样本量深入研究验证。
诸多指南建议早产儿出生后应尽快补充维生素D,但全球方案尚不统一。2010 年欧洲儿科胃肠病和营养学会建议早产儿每天补充800~1 000 IU 维生素D[15];2013 年美国儿科学会推荐早产儿每天补充200~400 IU 维生素D,上限是1 000 IU/d[16];2015年中国《维生素D 缺乏及维生素D 缺乏性佝偻病防治建议》中建议早产儿、低出生体重儿及双胎儿应在生后尽早开始补充800~1 000 IU/d 维生素D[3];2016 年《全球营养性佝偻病共识建议》[17]认为维生素D 水平>50 nmol/L 对骨骼健康有益,控制在250 nmol/L 以下不会导致高钙血症,每日补充维生素D 剂量800、1 200 IU 并未额外增加骨密度。然而,对于建议提出的补充剂量能否有效改善早产儿维生素D营养状况仍在调查分析中。
本研究在保证补充剂量安全的前提下,生后第8天予早产儿补充不同剂量维生素D(800、1 200 IU/d)。补充维生素D 之前,不同胎龄早产儿的ALP 及25-(OH)D 两组无统计学意义,而Ca、P 有统计学差异,对具有统计学意义的Ca、P 组分别进行组内比较,发现胎龄小于32周组与32~33+6周、34~36+6周组间有统计学差异,但32~33+6周与34~36+6周组之间无统计学差异。研究[18]认为胎儿期约80%的钙、磷储备发生在妊娠24~40 周,妊娠25 周始,体内矿物质每天增加60 mg,而到了妊娠的第35周,矿物质含量剧增至每天300 mg,到这一时期,母体内大量的矿物质如钙、磷、镁和维生素D等可经胎盘输送给胎儿,但由于临床中84%早产出生胎龄在32~36周,导致其错过从母体获取钙磷储备的最佳时期,形成先天的维生素D储备不足,并且胎龄越小,从母体中获得的钙、磷越少。
本研究中,生后7 天内、1 月、3 月龄时两种补充剂量组的血清Ca、P、ALP 水平均无统计学差异,25-(OH)D水平在7天及1月无统计差异,3月龄时有统计学意义,并且3 月龄时B 组的25-(OH)D 水平为(30.55±8.95)ng/mL,均值处于维生素适宜水平,而800 IU/d 为(27.12 ± 7.23)ng/mL,处于维生素D 不足水平;对4 项骨代谢指标的3 次结果进行重复测量方差分析,结果显示补充1 200 IU/d 可显著提高25-(OH)D水平,而且整个过程中两组均未发现维生素D 中毒病例,由此可见补充1 200 IU/d 是安全有效的。
分别分析补充不同剂量维生素D时不同胎龄早产儿3 月龄时的维生素D 营养状况,在A 组中,胎龄小于32 周与胎龄在34~36+6周间有统计学差异,提示生后同样补充800 IU/d 的维生素D,胎龄越小的时候,越难达到维生素D充足水平,这是否说明对于胎龄越小的早产儿,需要补充更大剂量的维生素D 才能保证适宜的维生素D 水平。本研究中补充1 200 IU/d 组的维生素D 营养状态在胎龄之间并没有统计学差异,提示补充较大剂量的维生素D 可使早期早产儿在3 月龄时达到中晚期早产儿的维生素D 水平,但由于本研究中补充1 200 IU/d组样本量少,存在一定局限性,未来需要更深入、更大样本量的研究加以验证。
本研究还发现,给予补充指南推荐的800 IU/d维生素D,3月龄时适宜比例仅为41.03%,仍有较大部分早产儿处于维生素D不足水平,而B组维生素适宜比例达63.27%,且两组之间差异有统计学意义,说明所有早产儿出生时均维生素D不足,即使生后持续补充3 个月维生素D 滴剂,3 月龄时维生素D 营养状况仍未完全充足。因此我们认为,对于国内指南推荐[3]的早产儿应补充800~1 000 IU/d维生素D 持续3个月后下调为补充400 IU/d,需检测Ca、P、ALP、25-(OH)D 等骨代谢指标,再根据其水平变化决定下调补充剂量;同时通过动态监测ALP、P、Ca、及25-(OH)D 等水平,动态评估骨代谢情况,达到早期发现、早期干预MBDP,减少本病对早产儿的远期不良影响。
综上所述,相比于800 IU/d,补充1 200 IU/d 维生素D 滴剂的早产儿血清25-(OH)D 水平高,且该剂量安全有效。与补充800 IU/d 相比,补充1 200 IU/d维生素D 可使胎龄较小早产儿在出生3个月时达到胎龄较大早产儿维生素D 水平。MBDP 早产儿的维生素D 水平偏低,应更积极足量补充维生素D,以保证其正常的骨代谢水平。
