转谷氨酰胺酶家族与肾透明细胞癌的关系研究
2022-11-22高小敏何春娟吴利东
胡 彬,高小敏,何春娟,吴利东
(1.南昌大学第二附属医院急诊科,南昌 330006; 2.南昌医学院基础医学院,南昌 330052; 3.贵州盘江煤电集团有限责任公司医院检验科,贵州 盘江 553537)
肾细胞癌(RCC)是起源于肾实质泌尿小管上皮系统的恶性肿瘤,占肾恶性肿瘤的80%~90%,其中肾透明细胞癌(KIRC)是最常见的一种肾癌亚型(占60%~85%)。目前肿瘤靶向治疗已成为研究热点,作为一种免疫原性很强的肿瘤,KIRC患者可以从免疫治疗中获益。然而,肿瘤微环境(TME)中具有免疫抑制作用的细胞亚群和分子可导致KIRC对免疫治疗不敏感[1-3]。因此,研究影响KIRC患者免疫微环境的分子标志物可为其治疗提供更准确的方向。转谷氨酰胺酶,又称谷氨酰胺转胺酶(TG),是一种可催化转酰基反应从而导致蛋白质(或多肽)之间发生共价交联的酶,转谷氨酰胺酶家族(TGMs)由9个成员组成,这些TGM保持着相似的序列和结构同源性,通过调节翻译后蛋白修饰发挥其功能[4-5]。已有研究[6-12]发现TGM2与肿瘤关系密切,然而TGMs在肾透明细胞癌的表达特征尚不完全清楚,因此本研究拟对TGMs与KIRC的关系进行探讨。
1 资料与方法
通过TCGA数据库(https://portal.gdc.cancer.gov/)和UCSCXena数据库(http://xena.ucsc.edu/)收集18种肿瘤患者的TGMs表达和临床相关信息,采用R语言(https://cran.r-project.org/src/base/R-4/R-4.1.2.tar.gz)进行生物信息学及统计学分析。重点探讨TGMs在KIRC患者中的表达水平差异,以及与生存时间、免疫亚型、临床分期的关系。以P<0.05为差异有统计学意义。
2 结果
2.1 TGMs在18种肿瘤中的表达
为了解TGMs的表达状况,从UCSC Xena数据库下载了18种肿瘤表达谱数据,首先分析TGM1、TGM2、TGM3、TGM4、TGM5、TGM6和TGM7在肿瘤中的表达情况(图1)。结果显示,TGMs在癌组织的表达大部分高于癌旁组织。其中,TGM1—TGM7在KIRC均有差异表达(P<0.01),TGM1和TGM7为低表达,而TGM2—TGM6为高表达。
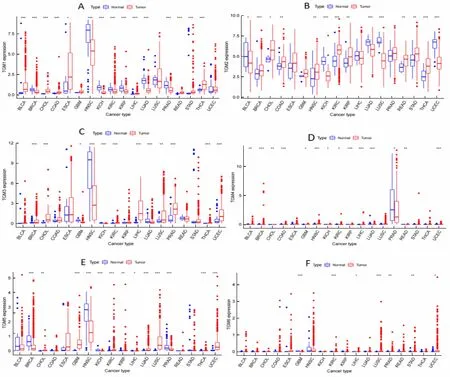
A—F依次为TGM1—TGM6在各种肿瘤中的表达。BLCA:膀胱癌;BRCA:乳腺癌;CHOL:胆癌;COAD:结肠癌;ESCA:食管癌;GBM:胶质母细胞瘤;HNSC:头颈鳞状细胞癌;KICH:肾嫌色细胞癌;KIRC:肾透明细胞癌;KIRP:肾乳头状细胞癌;LIHC:肝细胞肝癌;LUAD:肺腺癌;LUSC:肺鳞状细胞癌;PRAD:前列腺癌;READ:直肠腺癌;STAD:胃癌;THCA:甲状腺癌;UCEC:子宫内膜癌。*P<0.05,**P<0.01,***P<0.001。
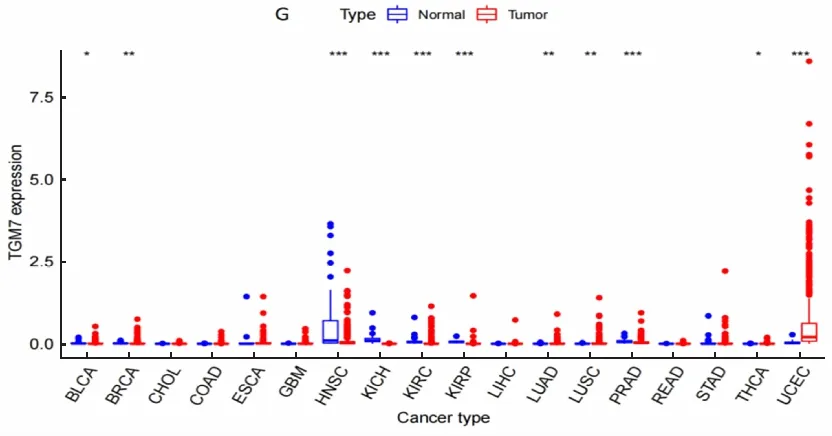
G:TGM7在各种肿瘤中的表达。*P<0.05,
2.2 TGMs与KIRC患者生存时间的关系
绘制的TGMs与KIRC患者生存曲线如图2。结果显示,TGM1—TGM6的表达与KIRC患者的生存时间呈负相关,差异有统计学意义(P<0.05),而TGM7与KIRC患者的生存时间没有相关性。
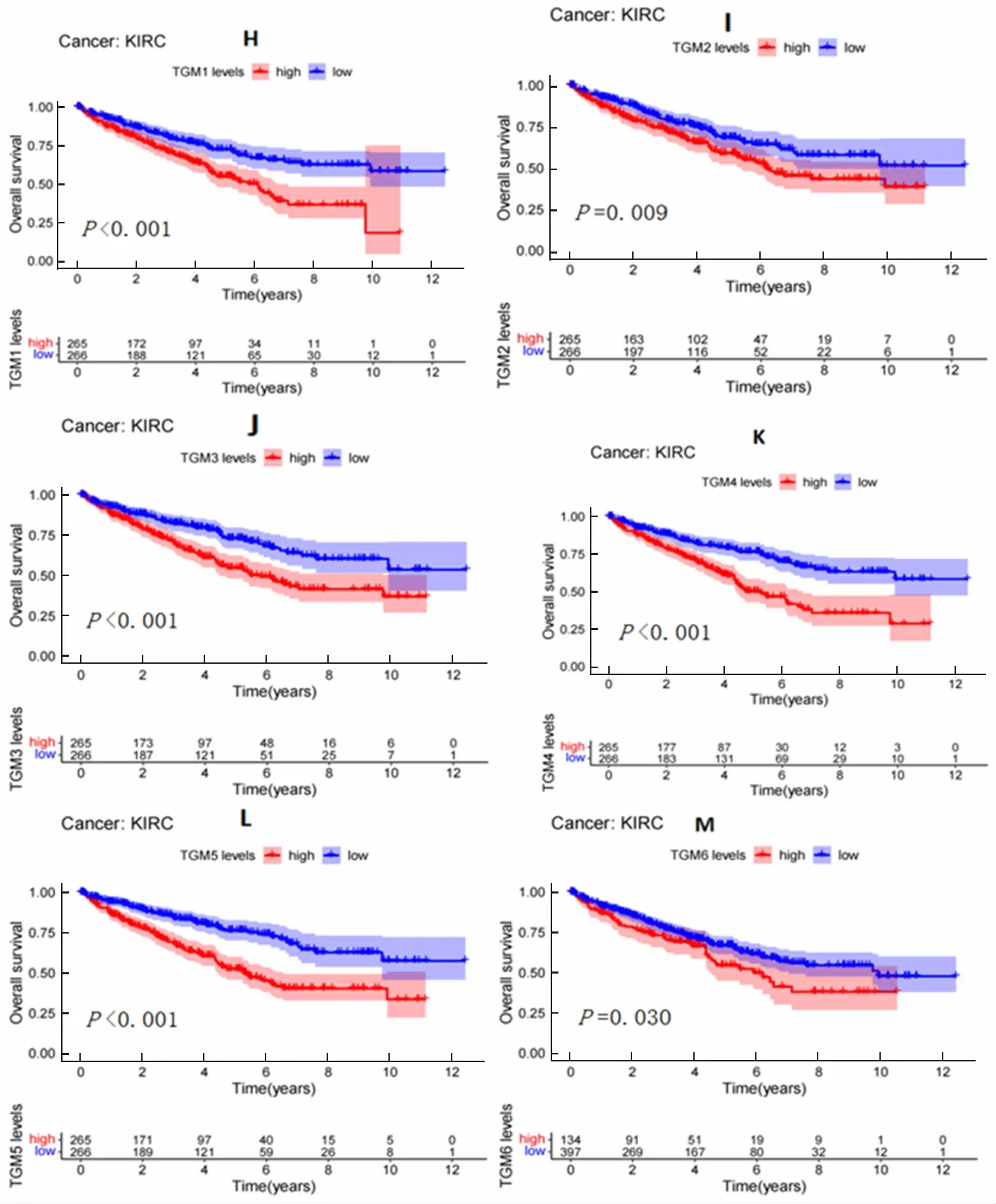
图2 TGMs与KIRC患者的生存曲线分析(各图下方为目标基因的表达)
2.3 TGMs在KIRC各免疫亚型中的表达
基于免疫亚型的数据,采用R语言绘制箱线图(图3)。结果显示,TGM1—TGM6在KIRC各免疫亚型中均存在表达差异(P<0.05)。其中,TGM2在C1和C6亚型中高度表达,C2、C3和C4中度表达,C5低度表达,提示TGM2可能与KIRC的免疫机制相关。
2.4 TGMs在KIRC不同临床分期中的表达情况
从TCGA数据库中收集KIRC患者共981例,其中Ⅰ期481例、Ⅱ期102例、Ⅲ期237例、Ⅳ期161例。采用R语言绘制箱线图(图4),结果显示,TGM2—TGM5在KIRC各临床分期中均有表达差异(P<0.05),其中TGM2的表达量最大。
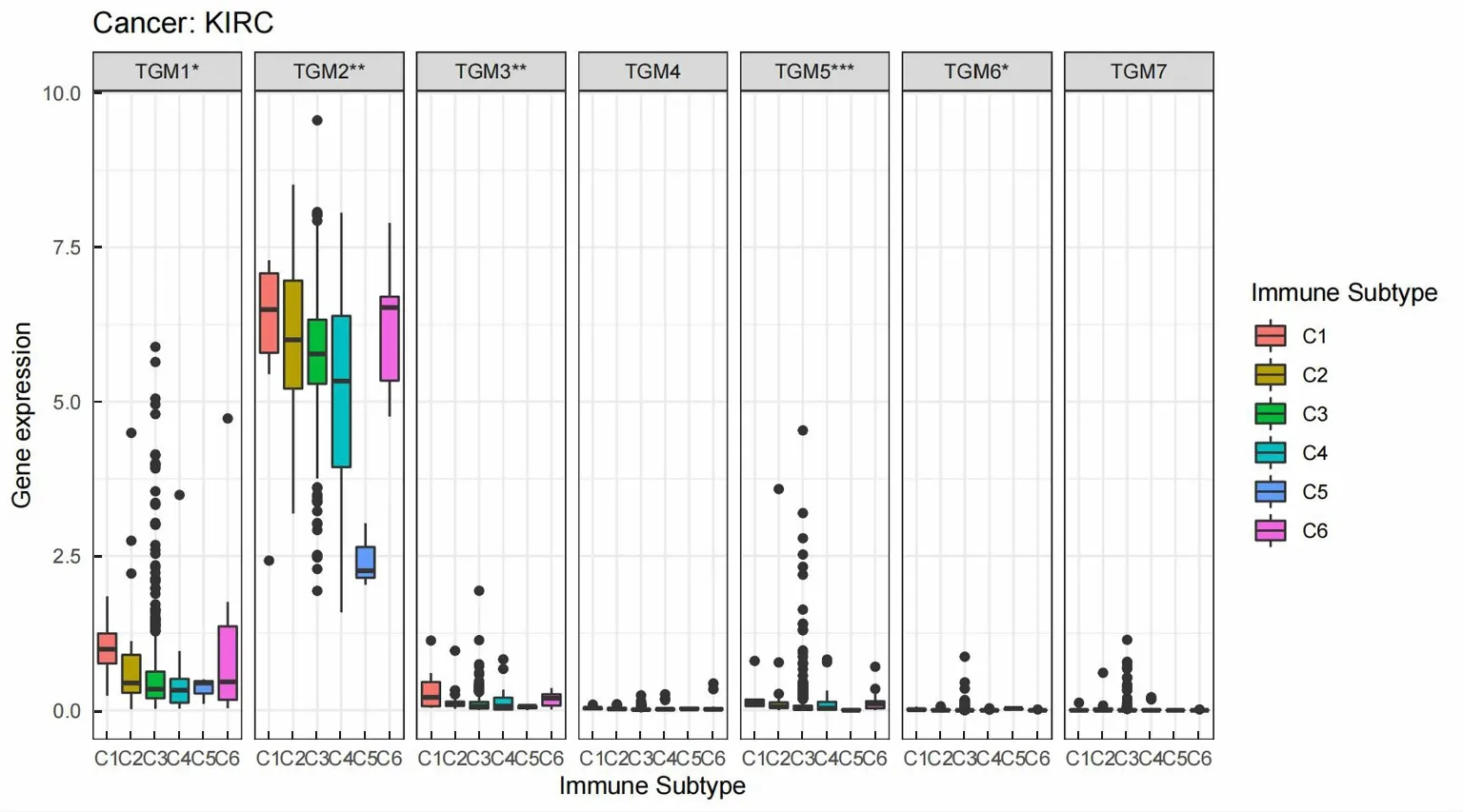
C1:伤口愈合;C2:干扰素γ显性;C3:炎症;C4:淋巴细胞减少;C5:免疫安静;C6:TGF-β显性。
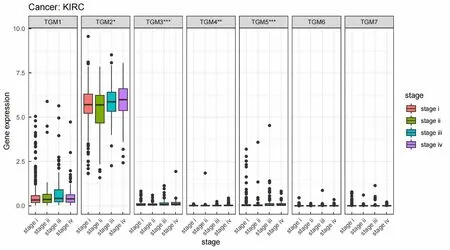
*P<0.05,**P<0.01,***P<0.001。图4 TGMs在KIRC不同临床分期中的表达
3 讨论
近年来对KIRC病因及发病机制的深入研究发现,表观遗传学的改变与其致病密切相关,其中DNA甲基化异常、组蛋白修饰及非编码RNA调节可能是KIRC发生发展的重要分子机制[13-15]。RASSF1A、VHL和p16等抑癌基因表达的下调或沉默与肾癌发生紧密联系,特别是正常VHL基因的功能缺失[16],VHL基因通过介导降解HIF-1间接对各生长因子的转录起到抑制作用,而90% RCC存在VHL失活,这将间接导致血管内皮生长因子(VEGF)、转化生长因子-α(TGF-α)、葡萄糖转运因子-1(GLUT-1)、血小板来源生长因子β(PDGFβ)和促红细胞生成素(EPO)等分泌增加[17],间接的促进肿瘤的发生、发展和转移[18]。JAK/STAT通路的异常激活在KIRC中起着重要作用[19],此外,KIRC本质上是一种代谢性疾病,癌细胞的增长需要大量的能量支持,VHL失活后高水平的HIF-α会驱动那些参与糖酵解的酶和代谢物如己糖激酶、甘油三磷酸脱氢酶、磷酸甘油酯激酶、丙酮酸激酶2等上调,促进糖酵解、脂肪酸代谢以及色氨酸、谷氨酰胺和精氨酸的利用,以供给肿瘤生长所需能量,其中谷氨酰胺是循环中最丰富的游离氨基酸,其不仅为肿瘤提供生长所需能量,还参与肿瘤细胞的免疫逃逸和抗氧化反应[20-21]。
本研究结果显示,TGM2—TGM5与KIRC关系紧密,其中TGM2或许占主导性的作用。TGM2在KIRC细胞TGF-β免疫亚型中高表达,可能与KIRC的发生发展有关。TGF-β能够上调TGM2,而TGM2也可以将非活性TGF-β转化为其活性形式,TGF-β是一种多功能细胞因子,在肿瘤发生的早期可作为抑癌基因抑制细胞的增殖和分化,但在肿瘤的进展期则可抑制免疫功能、增加血管的生成、诱导细胞外基质的产生而促进肿瘤的侵袭和转移[22]。TGM2的表达可增强TGF-β/SMADs信号通路传导,造成转录因子核因子-κB(NF-κB)的激活使细胞增殖增强,导致球体的形成和转移[23];同时TGM2的过表达会激活NF-κB信号传导以增加STAT3和IL-6信号传导,从而增强自噬依赖性细胞存活能力,而且自噬反应对IL-6和TG2信号传导有正反馈影响[24-25];有研究[26]表明,在发生应激时,细胞自噬防止有毒或致癌的损伤蛋白质和细胞器的累积,抑制细胞癌变;然而肿瘤一旦形成,细胞自噬就能为癌细胞提供更丰富的营养,促进肿瘤生长。
肾细胞癌中,TGM2也被证明可以通过p53的降解促进血管生成,从而导致HIF1α活化和VEGF的产生增加[27]。此外,TGM2通过涉及改变半胱天冬酶-3和Bax活性的机制抑制细胞凋亡,强调了TGM2介导的复杂系统对细胞环境的重要性,事实上,TGM2细胞亚定位和同种型似乎都是决定其如何介导细胞命运的关键因素,而TGM2本身是半胱天冬酶-3的靶标[28-30]。
综上所述,TGMs在KIRC患者中均有差异表达,其中表达量最大的为TGM2,作为一种潜在的免疫调节因子,或许可成为KIRC诊疗中有一定价值的生物标记物。
