阿克曼氏菌缓解胰腺炎所致肠道损伤的研究
2022-11-22黄伊雯任正楠宋东筱潘礼龙
黄伊雯,任正楠,宋东筱,潘礼龙,孙 嘉*
(1 江南大学食品学院 江苏无锡 214122 2 江南大学无锡医学院 江苏无锡 214122)
急性胰腺炎(Acute pancreatitis,AP)是一类急性消化类疾病,发病原因主要有酗酒、胆结石、代谢异常等。据估计,全球每10 万人中AP 的发病率达33.74 例,死亡率达1.6 例,表明AP 具有很高的发病率与死亡率[1]。根据严重程度,AP 可分为轻症胰腺炎(Mild acute pancreatitis,MAP)与重症胰腺炎(Severe acute pancreatitis,SAP),主要取决于胰腺及其周围局部损伤的程度,同时也取决于对远端器官的全身性损伤[2]。在MAP 发生时,没有严重的局部和全身性并发症,而约20%的MAP 患者会发展为更严重的SAP,并伴有坏死等明显的局部并发症,以及全身炎症反应综合征和多器官功能障碍综合症[3]。
在SAP 动物模型和临床患者中均发现肠屏障损伤。在大鼠中,SAP 诱导后的早期,肠道通透性增加,肠道吸收能力降低,并伴有系统性血容量不足和肠道局部缺血[4]。肿瘤坏死因子-α(Tumor necrosis factor,TNF-α) 等炎性因子的瀑布式释放,会导致肠黏膜缺血再灌注损伤,最终产生严重的氧化应激、半胱氨酸蛋白酶-3(Caspase-3)途径的激活和肠黏膜的严重凋亡[5-6]。同时,肠道生物屏障也遭到破坏,并进一步引起肠道细菌和内毒素发生移位。这不仅会加速败血症的进程,引起坏死组织感染,还会诱发和加重全身炎症反应综合症及多器官功能障碍,甚至引起死亡[7]。有研究证明,SAP 疾病发生前使用益生菌保护肠道屏障,可有效缓解SAP 发病进程[8],因此在治疗原发病的同时,对肠道损伤的保护至关重要。
人体和动物肠道内存在数量庞大的微生物群,它们黏附在肠黏膜表面,构成生物屏障,宿主与肠道微生物群之间的相互作用一直是生命健康领域的研究热点[9]。肠道菌群主要由专性厌氧菌、兼性厌氧菌和需氧菌组成,其中专性厌氧菌占99%以上[10]。阿克曼氏菌(Akkermansia muciniphila,A.muciniphila)是一种革兰氏阴性的严格厌氧菌,可在降解宿主黏蛋白的同时释放氨基酸或单糖,产生短链脂肪酸(Short chain fatty acids,SCFAs),为肠道中共生菌群提供营养[11],这提示阿克曼氏菌摄入对肠道菌群具有调节作用。此外,阿克曼氏菌可调节Toll 样受体(TLR)通路,通过增强肠道屏障减少内毒素脂多糖(Lipopolysaccharide,LPS)泄露进入循环[12-13]。有研究表明,阿克曼氏菌在缓解或治疗肥胖、2 型糖尿病和酒精性脂肪肝等疾病时,具有显著作用[13-16]。还有研究表明,外源给予SCFAs 及生产SCFAs 的益生菌,可缓解小鼠AP发病进程[8,17]。作为SCFAs 生产菌,阿克曼氏菌是否对AP 具有潜在调节作用,尚不清楚。此外,有大量研究证明巴氏消毒后的阿克曼氏菌,可以保留一些阿克曼氏菌活菌中活性分子的有益作用。例如,阿克曼氏菌的外膜蛋白Amuc_1100 在70 ℃加热处理后仍有热稳定性,它几乎能够复制所有的阿克曼氏菌活菌的作用[18-19]。本文旨在探究阿克曼氏菌活菌及灭活菌制剂对雨蛙素诱导的小鼠SAP 的保护作用。
1 材料与方法
1.1 动物、菌株与试剂
实验动物C57BL/6J,江苏集萃药康生物科技公司,动物实验已获得江南大学动物伦理委员会批准(伦理号JN.No20190915c0401020[204]),并严格遵循国家以及国际动物实验伦理原则,由江南大学提供饲养条件。阿克曼氏菌(A.muciniphila)MucT(ATTC BAA-835),美国的模式培养物集存库;脑心浸液培养基,中国青岛海博公司;Ⅲ型粘蛋白、雨蛙素、异硫氰酸酯-葡聚糖,美国Sigma-Aldrich 公司;α-淀粉酶测试盒、脂肪酶测试盒,中国南京建成生物研究所;AB-PAS 染色试剂盒,北京索莱宝公司;TRIzol 试剂、Super Script Ⅱ逆转录酶,加拿大Invitrogen 公司;SYBR Green Supermix 染料,上海翌圣生物科技有限公司;苏木精、伊红染色剂,中国南昌雨露实验器材有限公司;p-NF-κB p65 抗体,美国Cell Signaling Technology公司;NF-κB p65 抗体,美国Bioss 公司;乙醇、氯仿、异丙醇,国药集团化学试剂有限公司。
1.2 仪器与设备
厌氧工作站,英国DWS 公司;4 ℃冷冻离心机、全波长酶标仪,美国Thermo Fisher Scientific公司;切片电子扫描仪,匈牙利3DHISTECH 公司;超声波破碎仪,美国Sonics 公司;电子数显恒温水浴锅,中国深仪科技公司;高通量组织研磨机,宁波新芝生物科技股份有限公司;石蜡包埋机、手动轮转切片机,德国徕卡公司;多功能酶标仪Infinite M200 仪器,瑞士Tecan 公司。
1.3 实验方法
1.3.1 菌株制备 阿克曼氏菌MucT(ATTC BAA-835) 被严格厌氧培养在添加20 g/L Ⅲ型粘蛋白的脑心浸液培养基中。将对数生长期的菌液,4℃,8 000×g 离心10 min,去上清,用无菌生理盐水将菌泥洗涤2 次,重悬菌泥于30%甘油中,-80 ℃冰箱保存。使用前将菌液用无菌生理盐水稀释至含3%甘油的5×109CFU/mL 的菌液后水浴锅37℃,活化30 min 备用。灭活阿克曼氏菌制剂于灌胃前进行70 ℃,30 min 巴氏杀菌处理。
1.3.2 动物模型 将8 周龄左右的雄性C57BL/6J小鼠随机分为对照组、模型组、活菌和灭活菌组。每组6 只。为了验证阿克曼氏菌的生物学作用,在建立SAP 模型前,采用连续10 d 灌胃的方式给予活菌组小鼠200 μL 含3%甘油的5×109CFU/mL阿克曼氏菌液,灭活菌组小鼠200 μL 含3%甘油的5×109CFU/mL 经70 ℃,30 min 巴氏杀菌处理的阿克曼氏菌液。其余两组每日灌胃200 μL 含3%甘油的无菌生理盐水。第11 天建立SAP 模型:小鼠连续13 次腹腔注射雨蛙素(50 μg/kg),每次注射间隔1 h,注射完第13 针雨蛙素后立即注射1 针LPS(20 mg/kg)。3 h 后处死小鼠,并迅速收集血液、胰腺、结肠等样本。
1.3.3 胰腺组织水肿测定 取部分胰腺组织,称量新鲜胰腺样品湿重(Wet weight,ww)及80 ℃烘干48 h 后胰腺样品干重(Dry weight,dw),评估胰腺组织水肿程度。计算胰腺组织水含量的百分比(ww/dw)。
1.3.4 血清淀粉酶、脂肪酶测定 收集新鲜血液于采血管,室温静置1 h,经3 000×g,15 min 离心后得到血清样品,冻存于-80 ℃备用。血清淀粉酶采用α-淀粉酶测试盒进行测定。使用比色法在660 nm 波长处检测其吸光值,根据给定公式计算血清淀粉酶的含量。血清脂肪酶按说明书步骤测定,使用酶标仪于420 nm 波长处比浊,测定脂肪酶的活性。
1.3.5 组织形态学分析 剪取一定大小、长度的新鲜胰腺组织,迅速置于4%的中性多聚甲醛中固定12~24 h 左右,经常规流程对组织使用浓度梯度乙醇脱水和二甲苯透明。然后用切片石蜡进行包埋后制成蜡块,随后将组织进行切片,逐级脱蜡复水后进行续染色。本实验采用苏木精-伊红染色(Hematoxylin-eosin staining,H&E)法来观察结肠及胰腺组织形态,观察腺泡细胞损失及炎性细胞浸润情况。使用阿利新蓝-过碘酸雪夫氏染色(Alcian blue-periodic acid Schiff,AB-PAS) 观察结肠组织中杯状细胞及黏液层情况。
1.3.6 肠道通透性测定 小鼠肠道通透性检测通过荧光素异硫氰酸酯-葡聚糖 (Fluorescein isothiocyanate-Dextran,FITC-Dextran)来检测。小鼠处死前,禁食4 h,随后灌胃500 mg/kg 的FITC-Dextran。灌胃4 h 后处死,避光快速收集血液并离心得到血清。使用多功能酶标仪在激发波长492 nm,发射波长525 nm 下测定吸光度。通过连续稀释FITC-Dextran 溶液制作标准曲线,并换算血清中的FITC-Dextran 浓度。
1.3.7 胰腺RNA 提取与实时荧光定量PCR 分析 采用TRIzol 提取方法提取小鼠胰腺、结肠中的总RNA,使用PrimeScript 1st Strand cDNA Synthesis Kit 反转录试剂盒将所提RNA 反转为cDNA,测定RNA 和cDNA 的浓度。以cDNA 为模板,骨架蛋白β-actin 为内参,Fast SYBR Green Master Mix 混合体系,进行实时定量PCR 实验。引物设计见表1。反应体系为:2×SYBR Green Supermix,10 μL;上游引物(10 μmol/L)、下游引物(10 μmol/L),1 μL;模板1 μL;ddH2O 7 μL。反应条件为:95 ℃预变性3 min;95 ℃变性15 s;58 ℃退火30 s;72 ℃延伸1 min;72 ℃延伸2 min;2~4步循环40 次,4 ℃降温5 min。

表1 实时荧光定量PCR 使用的特异性引物Table 1 Specific primers for qRT-PCR
1.3.8 Western blot 分析 将胰腺组织置于RIPA裂解液中制备组织匀浆,4 ℃,14 000×g 条件下离心15 min,取上清液用于免疫印迹分析。采用BCA蛋白定量试剂盒进行蛋白浓度分析。等量蛋白样品经SDS-PAGE 凝胶电泳分离后,电转印到硝酸纤维素膜上,封闭后,用NF-κB p65、p-NF-κB p65 抗体进行过夜孵育。随后用辣根过氧化物酶偶联的抗兔抗体室温孵育1.5 h,采用ECL 试剂盒进行显色,于Bio-Rad 凝胶成像系统中曝光观察。
1.3.9 统计分析 所有数据均表示为“平均值±标准差”。使用单因素方差分析(One-way ANOVA)对各组之间的显著性差异进行评估,将数据导入GraphPad Prime 7 统计学软件进行专业统计分析(*.P<0.05,**.P<0.01,***.P<0.001)。
2 结果与分析
2.1 阿克曼氏菌保护重症急性胰腺炎引起的肠屏障损伤
肠道菌群紊乱与多种胃肠道相关疾病的发病机制都存在一定关联性,例如,肠炎疾病和肠易激综合征[20],以及一些其它疾病,如代谢综合征、肥胖、糖尿病和胰腺相关的疾病,肠道菌群的干预可以作为预防或治疗这些疾病的有效方法[21-24]。以往研究已经表明,SAP 小鼠的肠道屏障会发生一定程度的损伤。结肠病理学切片显示(图1a),SAP 组小鼠肠黏膜上皮变宽,绒毛顶端上皮脱落。这种结肠损伤在阿克曼氏菌干预的活菌及灭活菌小鼠中得到缓解。通过灌胃FITC-dextran 检测小鼠结肠黏膜通透性。如图1b 所示,模型小鼠血清中FITC-dextran 浓度大幅度增加,活菌和灭活菌组与模型组小鼠相比,小鼠血清中FITC-dextran 浓度则显著降低。表明阿克曼氏菌的干预可以保护屏障,减少泄露。此外也通过测定小鼠结肠上皮中紧密连接(Tight junctions,TJs)蛋白ZO-1(Tjp1)和ZO-2(Tjp2)的表达,探究阿克曼氏菌是否能调节小鼠SAP 模型中的肠屏障功能。结果表明(图1c 和图1d),ZO-1 和ZO-2 在雨蛙素诱导的SAP小鼠中的基因表达水平出现不同程度的降低。阿克曼氏菌活菌干预后,大幅度上调了ZO-1 和ZO-2 的表达,灭活的阿克曼氏菌也使得ZO-2 的基因水平上升。这些结果表明,阿克曼氏菌可以增强SAP 结肠中小鼠的TJs,保护肠道机械屏障损伤。
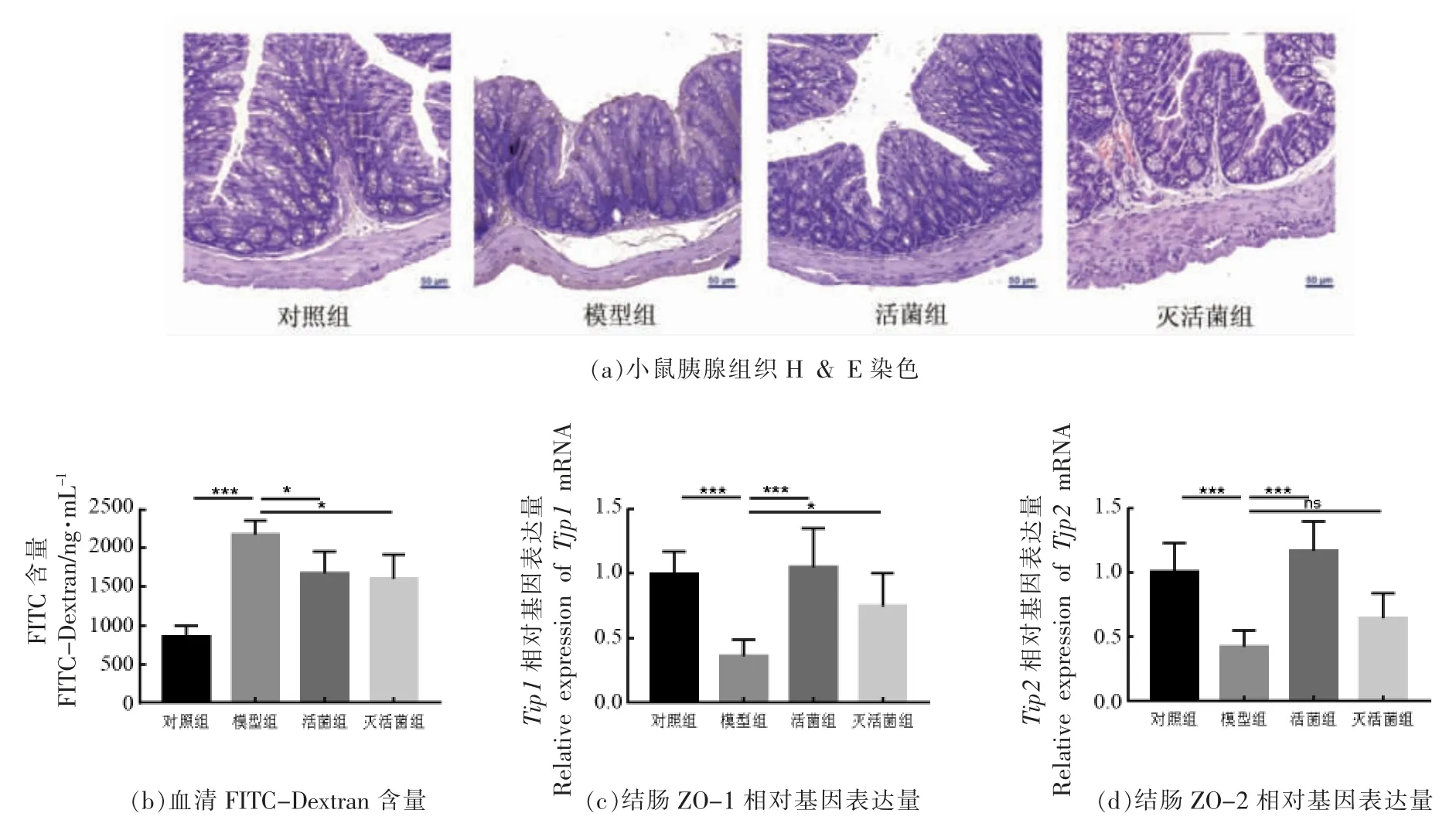
图1 阿克曼氏菌干预对SAP 相关的肠屏障影响Fig.1 Effect of A.muciniphila treatment on the SAP-associated intestinal barrier
2.2 阿克曼氏菌恢复肠道黏液层破坏
阿克曼氏菌能刺激杯状细胞,增加黏蛋白MUC2 和三叶因子 (Recombinant trefoil factor 2,TFF2)的表达,同时增加肠黏液层的厚度[25]。本实验使用AB-PAS 染色结肠组织(图2),结果显示SAP 造模组杯状细胞和黏液层破坏严重。阿克曼氏菌活菌干预后,可增加杯状细胞数量,恢复黏液层含量。灭活菌也具有一定的作用,活菌组效果更为显著。
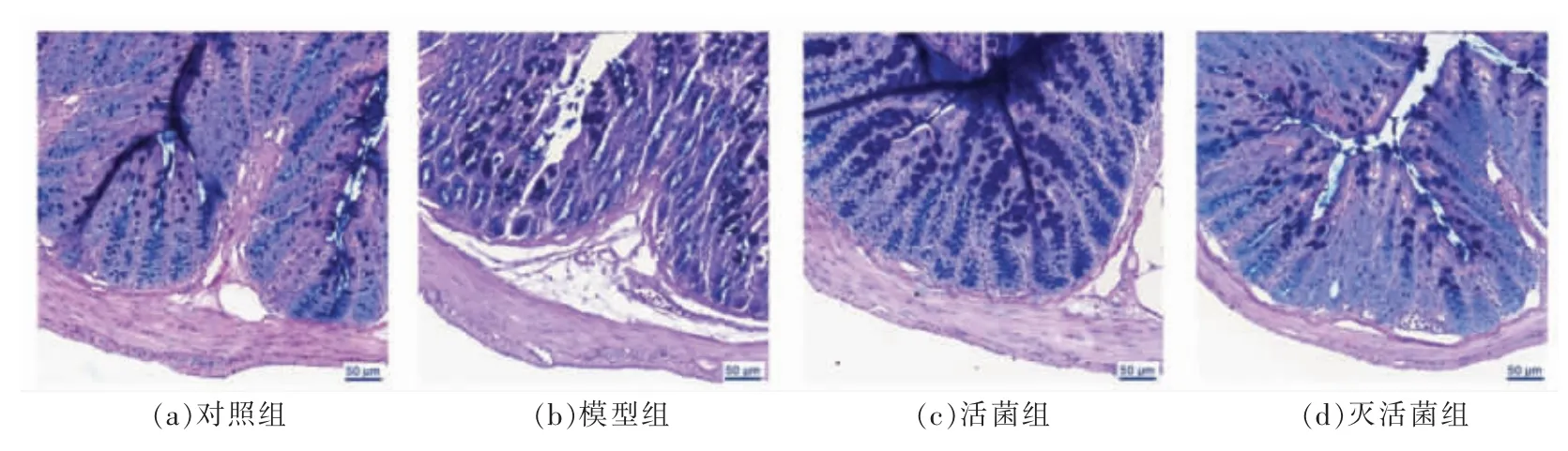
图2 阿克曼氏菌干预对结肠黏液层影响Fig.2 Effects of A.muciniphila treatment on colonic mucous layer
2.3 阿克曼氏菌无法缓解重症急性胰腺炎症状
发生SAP 时,包括中性粒细胞在内的免疫细胞的募集和浸润,引起胰腺组织水肿。为了探究阿克曼氏菌预处理在SAP 发生时是否发挥作用,首先检测了雨蛙素与LPS 联合建立的SAP 小鼠模型中胰腺组织的水肿情况。利用H&E 染色观察胰腺组织的形态(图3a),发现对照组小鼠胰腺形态完整,实质率高,未出现水肿、坏死及免疫细胞浸润的情况;与之相比,SAP 组小鼠胰腺组织间质间隙增大,内部结构紊乱,胰腺腺泡细胞明显肿胀并出现部分坏死,组织间隙及实质内出现明显的免疫细胞浸润,胰腺组织损伤严重。阿克曼氏菌活菌与灭活菌预处理后,与模型组小鼠相比,腺泡细胞坏死程度、免疫细胞浸润及胰腺组织的间质水肿均未得到改善。如图3b 所示,使用胰腺组织湿重与干重比值,评估胰腺组织水肿程度。模型组小鼠与对照组相比,胰腺水肿程度显著增加,阿克曼氏菌活菌与灭活菌干预均无法改善小鼠的水肿程度。
同时,由于胰蛋白酶原异常激活,胰腺腺泡细胞遭到破坏,胰腺分泌的淀粉酶和脂肪酶大量进入血液,导致血清淀粉酶和脂肪酶升高。图3c 和3d 所示,在SAP 模型建立后,血清淀粉酶及脂肪酶活力显著升高,活菌和灭活菌组较模型组而言,并未降低二者在血清中的水平。总之,研究认为阿克曼氏菌的活菌与灭活菌预处理均不能缓解SAP的症状。

图3 阿克曼氏菌无法缓解重症急性胰腺炎症状Fig.3 A.muciniphila cannot relieve severe acute pancreatitis symptoms
2.4 阿克曼氏菌无法调节重症急性胰腺炎过程中炎症因子的释放
SAP 发生后引起一系列炎症级联反应。在这个反应过程中,受损的腺泡细胞释放大量炎症因子,并募集大量免疫细胞浸润至病灶中。而这些浸润的细胞则会产生更多的炎症因子,加重局部和整体性的炎症反应[26-27]。利用实时荧光定量PCR测定了胰腺组织中几种常见炎症因子。如图4所示,模型组小鼠胰腺组织中的炎症因子白细胞介素-1β (Interleukin-1β,IL-1β)、TNF-α 和白细胞介素-6(Interleukin-6,IL-6)基因表达水平显著升高,约为对照组的4~10 倍,说明SAP 小鼠出现了明显的系统性炎症反应。两组阿克曼氏菌的活菌与灭活菌预处理均无法调节胰腺局部炎症因子。

图4 小鼠胰腺组织中IL-1β、TNF-α 和IL-6 的基因表达水平Fig.4 The levels of IL-1β,TNF-α and IL-6 in mouse pancreas tissue
2.5 阿克曼氏菌无法抑制胰腺组织中NF-κB 的激活
在AP 发生的早期阶段,核转录因子-κB(Nuclear factor-κB,NF-κB)立即作出应答,并导致下游炎症因子大量释放。组织中大量分泌的炎症介质同时又作为NF-κB 的诱导剂,由此形成恶性循环,加重胰腺损伤[28]。检测了NF-κB(p-NF-κB p65)的表达情况,如图5所示,模型组p-NF-κB p65 高表达,活菌和灭活组NF-κB p65 磷酸化水平较模型组没有显著性差异。这证明阿克曼氏菌的干预不能通过调控NF-κB 信号通路,从而调节胰腺的炎症进程。

图5 阿克曼氏菌的干预对胰腺NF-κB 信号的影响Fig.5 The effect of A.muciniphila treatment on NF-κB in pancreas
3 结论
本文通过反复注射雨蛙素并佐以LPS 的方式建立模型,灌胃阿克曼氏菌活菌及灭活菌制剂。小鼠灌胃阿克曼氏菌后,与模型组相比,小鼠肠道屏障得到保护,紧密连接蛋白表达量增加,肠屏障泄露减少,杯状细胞及黏液层增多,活菌的保护效果较灭活菌更为显著。然而,胰腺的水肿情况、血清淀粉酶及血清脂肪酶升高的情况并未改善,也未能逆转SAP 发生时,炎症因子的增加及NF-κB 信号的激活。
在本研究中,发现阿克曼氏菌虽然能够增强肠道屏障功能,但未能表现出对SAP 的缓解作用。SAP 作为一种急性炎症性疾病,已经证明能通过肠道屏障的恢复以及SCFAs 的补充来缓解发病进程。阿克曼氏菌作为一种可增加肠道黏液层厚度且产SCFAs 的益生菌,在T1D 及T2D 中已被验证有益效果,然而需要长期干预才能发挥作用。延长阿克曼氏菌的预防干预时间或干预慢性疾病,如慢性胰腺炎,或许能进一步挖掘阿克曼氏菌的有益作用。
