牡蛎低分子肽LOPs对短期免疫抑制小鼠的免疫调节作用
2022-11-22李晋祯郑惠娜任鼎鼎曹文红林海生秦小明章超桦
李晋祯,郑惠娜,3,4*,任鼎鼎,杨 文,曹文红,3,4,林海生,3,4,秦小明,3,4,章超桦,3,4
(1 广东海洋大学深圳研究院 广东深圳 518108 2 广东海洋大学食品科技学院 广东湛江 524088 3 国家贝类加工技术研发分中心(湛江) 广东省水产品加工与安全重点实验室广东省海洋生物制品工程实验室 广东湛江524088 4 海洋食品精深加工关键技术省部共建协同创新中心 大连工业大学 辽宁大连 116034)
免疫系统是机体的一种防御系统,可清除细菌、真菌、病毒等有害物质,并预防癌细胞的生长发育[1]。免疫系统主要分为两大类:非特异性免疫和特异性免疫。非特异性免疫通过皮肤、黏膜、巨噬细胞、NK 细胞、炎症因子等提供机体免疫的第1 道防线[2]。特异性免疫中最重要的细胞是T 淋巴细胞和B 淋巴细胞,其中B 淋巴细胞与抗原相互作用后产生特异性抗体,T 淋巴细胞与病原体结合后产生免疫调节因子。Th 细胞作为T 淋巴细胞的1 个亚群,主要分泌干扰素-γ(IFN-γ)、白细胞介素(IL-)2 等细胞因子,激活免疫细胞参与免疫反应[3]。
临床上,用于免疫疗法的免疫调节剂是通过改变免疫系统的非特异性和特异性免疫来治疗疾病。目前,匹多莫德[4]、左旋咪唑[5]、环孢素[6]等药物被成功应用于调节人体免疫反应,然而,大多数免疫调节药物具有毒性和副作用,并不适合慢性或预防性使用[7]。此外,许多肿瘤患者化疗后易出现营养不良、免疫力低下等现象,患者通过改善食谱难以达到恢复效果,降低了治疗的有效性。营养干预是一种具有吸引力的治疗策略,可通过营养和功能性食品的摄入以改善机体的免疫功能[8]。在马氏珠母贝[9]、青蛤[10]、扇贝[11]、牡蛎[12]等经济贝类中,存在具有免疫调节功能的海洋源多肽,没有副作用且成本较低,可作为特殊医学用途食品营养基料进行营养干预。
牡蛎是世界上养殖最多的经济海水贝类,必需氨基酸占其总氨基酸的40%,是优质的蛋白质来源[13]。牡蛎肽是将酶解、微生物发酵、化学合成、重组等多肽生物分子技术应用于牡蛎加工的产物,且容易被机体消化吸收[14]。研究表明,牡蛎肽具有多种潜在的生物活性,如抗氧化[15]、抗菌[16]、降血压[17]、促性功能[18]、抗炎[19]等。本课题组前期研究发现,牡蛎酶解产物可促进脾淋巴细胞增值,腹腔巨噬细胞吞噬中性红和生成NO[12],然而,对具有免疫调节功能的物质是多肽,还是多糖,仍未知。本研究在前期体外研究基础上,通过建立环磷酰胺诱导的短期免疫抑制小鼠模型,从小鼠的体质量、免疫脏器指数、免疫组织形态学结构、免疫球蛋白、细胞因子、体液免疫等方面探究牡蛎低分子肽(Low-molecular-weight oyster peptides,LOPs)对短期免疫抑制小鼠的免疫调节作用,为开发以海洋蛋白肽为基料的特殊医学用途配方食品提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物 健康SPF 级雄性KM 小鼠,4周龄,体质量18~20 g,购自珠海百试通生物科技有限公司。许可证号:SCXK(粤)2020-0051。动物实验的开展由广东海洋大学实验动物伦理委员会批准许可。实验垫料、饮用水经高压灭菌处理,饲料经辐照杀菌处理。
1.1.2 实验材料 LOPs,海南盛美诺生物技术有限公司,浅褐色固体粉末,主要成分为分子质量<5 ku 的多肽,蛋白质含量68.7 g/100 g(以干基计),低聚肽含量41.6 g/100 g(以干基计)。参考李婉等[12]方法,使用氨基酸自动分析仪测定LOPs 中16 种氨基酸含量(表1)。

表1 LOPs 氨基酸组成及其含量Table 1 Amino acid composition and content of LOPs
1.1.3 实验试剂 乳清蛋白粉,浙江一诺生物科技有限公司;环磷酰胺(Cyclophosphamide,CTX),德国Baxter Oncology GmbH 公司;γ-干扰素(Interferon-γ,IFN-γ)、白细胞介素(Interleukin,IL)-2、免疫球蛋白(Immunoglobulin)A、IgM、IgG 酶联免疫吸附测定试剂盒、绵羊红细胞 (Sheep red blood cells,SRBC)、豚鼠血清(补体),南京森贝伽生物科技有限公司;SA 缓冲液(pH 7.4),上海源叶生物科技有限公司;都氏试剂,河南云子羽生物有限公司;苏木精-伊红(Hematoxylin-eosin,HE)染色液,上海碧云天生物技术有限公司;其它试剂均为国产分析纯级。
1.2 仪器与设备
BSA224S-CW 电子分析天平,德国Sartorius公司;3-30KS 台式高速冷冻离心机,美国Sigma公司;Varioskan Flash 全波长扫描式多功能酶标仪,美国Thermo 公司;脱水机、冷冻石蜡包埋机,湖北贝诺医疗科技有限公司;KD-P 组织摊片机,浙江金华科迪仪器设备有限公司;Eclipse E100显微镜,上海尼康仪器有限公司。
1.3 方法
1.3.1 实验分组与处理 120 只SPF 级雄性KM健康小鼠饲养于动物房屏障区,温度保持(22±2)℃,相对湿度为50%~60%,昼夜照明时间为12 h/12 h,实验期间动物自由饮水和进食。适应性饲养7 d 后,按照体质量随机分为6 组(n=20),每组分为A、B 亚组,分别为空白(Control)组、环磷酰胺(CTX)模型组、乳清蛋白对照(WP)组及LOPs 低(LOPs-L)、中(LOPs-M)、高(LOPs-H)剂量组。分组后,记录小鼠初始体质量,实验过程中每3 d 测量1 次小鼠体质量,记录每只小鼠体质量的变化。实验第1~3 天于早上9:30 开始腹腔注射,空白对照组每天腹腔注射生理盐水10 mL/kg bw,其余组每天腹腔注射等体积CTX 80 mg/kg bw,建立短期免疫抑制小鼠模型[20]。第4 天起,于早上9:30开始灌胃,乳清蛋白组经口灌胃给予0.4 g/kg bw乳清蛋白,LOPs 低、中、高剂量组分别经口灌胃给予0.2,0.4,0.8 g/kg bw 的LOPs,同时,空白对照组和模型组经口灌胃等体积蒸馏水。
1.3.2 免疫脏器指数计算 A 亚组小鼠共60 只,采用颈椎脱臼法处死小鼠,解剖分离脾脏和胸腺,并置于生理盐水中洗净血,用滤纸吸干器官表面水分后,称量脏器质量。免疫脏器指数根据公式(1)计算[21]。

1.3.3 脾脏和胸腺组织形态学观察 无菌取脾脏和胸腺,按照0.05 g/mL 在4%多聚甲醛固定液中充分固定,石蜡包埋,冰冻切片机将脾脏、胸腺组织切片,HE 染色,脱水封片。最后在光学显微镜下观察脾脏和胸腺组织的形态学变化并获取相应的图像。
1.3.4 血清溶血素水平测定 参考Yang 等[22]的方法,稍作修改。B 亚组小鼠摘除眼球取血于离心管内,室温自然凝固1 h,4 ℃2 000 r/min 离心10 min,收集血清。取血清用SA 缓冲液稀释200 倍。将稀释后的血清50 μL 置96 孔板样品孔中,依次加入体积分数10%的SRBC 25 μL,补体50 μL(用SA 按1∶8 稀释,V/V)。另设不加血清的对照孔(以SA 缓冲液代替)。置于37 ℃恒温水浴中保温30 min 后,冰浴终止反应。1 500 r/min 离心10 min。取上清液50 μL 加入另一个96 孔板中,加都氏试剂150 μL。设半数溶血孔,加体积分数10%的SRBC 12.5 μL,再加都氏试剂187.5 μL,充分混匀,放置10 min 后,用酶标仪于540 nm 波长处测定各孔光密度值,溶血素的量以半数溶血值HC50表示,根据公式(2)计算。

1.3.5 外周血免疫球蛋白含量测定 A 亚组小鼠摘取眼球取血于离心管内,室温自然凝固15 min,1 200×g 离心20 min[23]。仔细收集上清液于-80 ℃保存备用。取120 μL 血清,外周血免疫球蛋白IgA、IgG、IgM 质量浓度的测定严格按照酶联免疫吸附测定试剂盒说明书进行。
1.3.6 血清细胞因子质量浓度测定 另取A 亚组小鼠血清80 μL,血清中IFN-γ、IL-2 质量浓度的测定严格按照酶联免疫吸附测定试剂盒说明书进行。
1.4 统计分析
用IBM SPSS Statistics 26 软件对数据进行分析,实验结果以“平均值±标准差”表示。采用单因素方差分析(One-Way ANOVA)和LSD 法比较组间差异,P<0.05 被认为具有统计学上的差异。数据不符合正态分布或方差不齐时,可进行变量转换后再分析;变量转换仍不满足要求,进行秩和检验。
2 结果与分析
2.1 体质量和免疫脏器指数的变化
如表2所示,各组小鼠初始体质量无统计学差异(P>0.05),环磷酰胺造模3 d 后,5 个造模组小鼠体质量与空白组相比极显著降低(P<0.01),连续给药27 d 后的终末体质量各组间无显著差异(P>0.05)。各组小鼠胸腺指数之间无显著差异(P>0.05);与空白组相比,模型组、乳清蛋白组、LOPs 低、中、高剂量组脾脏指数增大(P<0.01);与模型组相比,乳清蛋白组的脾脏指数有所降低,LOPs 低、中、高剂量组脾脏指数随LOPs 剂量增加而降低,然而无统计学意义(P>0.05)。

表2 LOPs 对短期免疫抑制小鼠体质量和免疫脏器指数的影响(n=10)Table 2 Effect of LOPs on body mass and immune organ indices of short-term immunosuppressed mice (n=10)
2.2 脾脏和胸腺组织形态学观察结果
空白组的红髓和白髓之间有明显的分界线,脾小结近似圆形且发育良好,脾脏组织结构清晰(图1a)。与空白组相比,模型组的白髓和红髓边界模糊,脾小结不完整(图1b);乳清蛋白组可见完整的脾小结(图1c);LOPs 低剂量组可见脾小结的大体结构,而红髓与白髓边界仍不明显(图1d);LOPs 中、高剂量组可见多个完整的脾小体,可见明显的红白相间的髓质,白髓边缘增宽 (图1e、1f)。

图1 LOPs 对短期免疫抑制小鼠脾脏组织的影响(×200)Fig.1 Effect of LOPs on spleen tissues of short-term phase immunosuppressed mice (×200)
空白组皮质和髓质结构清晰,髓质内可见明显的胸腺体,皮质区染色深且面积大(图2a)。与空白组相比,模型组皮质区面积变小,髓质区面积变大,皮质与髓质分界视野不清,T 淋巴细胞数量明显减少(图2b);乳清蛋白组和LOPs 低、中、高剂量组皮质区面积变大,皮质与髓质分界视野恢复至空白组水平(图2c~2f)。

图2 LOPs 对短期免疫抑制小鼠胸腺组织的影响(×200)Fig.2 Effect of LOPs on thymus tissue of short-term phase immunosuppressed mice (×200)
2.3 血清溶血素水平的变化
如图3所示,与空白组相比,模型组、LOPs低、中剂量组的血清溶血素水平有所提高(P>0.05),乳清蛋白组的血清溶血素水平极显著提高(P<0.01),LOPs 高剂量组的血清溶血素水平显著提高(P<0.05);与模型组相比,乳清蛋白组的血清溶血素水平显著提高(P<0.05),LOPs 各剂量组的血清溶血素水平有所提高,然而无统计学意义(P>0.05)。

图3 LOPs 对短期免疫抑制小鼠血清半数溶血值的影响(n=10)Fig.3 Effect of LOPs on serum half hemolytic values in short-term immunosuppressed mice (n=10)
2.4 外周血免疫球蛋白含量的变化
如图4所示,与空白组相比,模型组的外周血IgA、IgG 质量浓度均增加,而IgM 质量浓度有所降低(P>0.05),乳清蛋白组的外周血IgA 质量浓度极显著增加(P<0.01),IgG、IgM 无明显变化(P>0.05);LOPs 低、中、高剂量组的外周血IgG、IgM 质量浓度和LOPs 高剂量组的外周血IgA 质量浓度极显著增加(P<0.01),LOPs 低剂量组的外周血IgA 质量浓度无明显变化 (P>0.05),LOPs 中剂量组的外周血IgA 质量浓度显著增加 (P<0.05);与模型组相比,乳清蛋白组和LOPs 高剂量组的外周血IgA 质量浓度极显著增加 (P<0.01),LOPs 低、中、高剂量组的IgG、IgM 质量浓度极显著增加(P<0.01)。
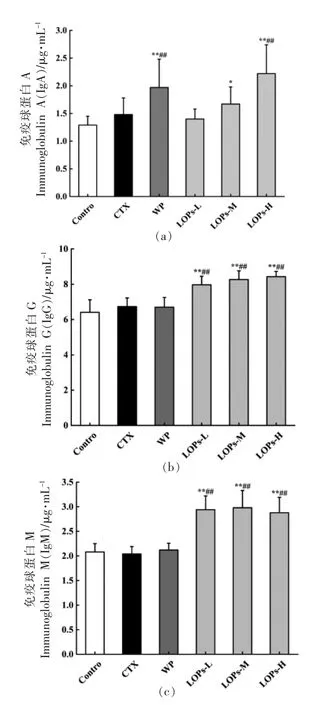
图4 LOPs 对短期免疫抑制小鼠外周血免疫球蛋白IgA(a)、IgG(b)、IgM(c)质量浓度的影响(n=10)Fig.4 Effect of LOPs on peripheral blood immunoglobulin IgA (a),IgG (b),and IgM (c)mass concentrations in short-term immunosuppressed mice (n=10)
2.5 血清中细胞因子水平的变化
如图5所示,与空白组和模型组相比,乳清蛋白组小鼠血清中IL-2 质量浓度无明显变化(P>0.05),LOPs 低、中、高剂量组小鼠血清中IL-2 质量浓度均极显著提高(P<0.01)。与空白组相比,模型组和LOPs 中剂量组小鼠血清中IFN-γ 质量浓度虽有所增加,但无统计学意义(P>0.05),乳清蛋白组、LOPs 低、高剂量组小鼠血清中IFN-γ 质量浓度均极显著增加(P<0.01);与模型组相比,LOPs低、高剂量组小鼠血清中IFN-γ 质量浓度均极显著增加(P<0.01),乳清蛋白和LOPs 中剂量组小鼠血清中IFN-γ 质量浓度虽有所增加,但无统计学意义(P>0.05)。

图5 LOPs 对短期免疫抑制小鼠血清细胞因子(a)IL-2、(b)IFN-γ 浓度的影响(n=10)Fig.5 Effect of LOPs on serum cytokine (a) IL-2,(b) IFN-γ concentrations in short-term immunosuppressed mice (n=10)
3 讨论
目前,多种食品源开发的免疫活性肽已成为研究热点,而酶解技术是从蛋白质中提取活性肽的重要方法之一[24]。研究表明,多种海洋源贝类多肽具有增强免疫力的作用。青蛤酶解多肽能够明显提高巨噬细胞的吞噬能力、NO 分泌能力和细胞因子分泌能力[25]。等边浅蛤酶解产物对免疫功能具有一定的调节作用[26]。文蛤寡肽对CTX 诱导的免疫抑制小鼠的免疫功能具有改善作用[27]。
牡蛎经粉碎、脱脂酶解、过滤、浓缩、喷雾干燥后得到的LOPs 是一种蛋白质含量高,氨基酸齐全的产物,其小分子多肽被酶切割后可释放出特有的活性肽序列。因此检测LOPs 的免疫活性,可为特殊医学用途配方食品的应用提供理论基础。具有免疫调节作用的食源性蛋白肽常见的残基是疏水性氨基酸,如Ala、Val、Met、Ile、Leu、Tyr、Phe、Pro等[28]。本研究中所用LOPs 富含16 种氨基酸(表1),必需氨基酸占总氨基酸含量的37.10%,其中Ala、Val、Met、Ile、Leu、Tyr、Phe、Pro 等疏水性氨基酸含量为37.53%。也有研究进一步表明,带正电荷的氨基酸含量与多肽免疫调节功能呈正相关[29],本研究中的Lys、His 和Arg 等带正电荷的氨基酸含量为18.13%。因此,本研究中LOPs 的免疫活性可能与这些疏水性氨基酸和带正电荷的氨基酸组成及其含量有关。
环磷酰胺作为一种具有广谱抗肿瘤的化疗药物,其介导的细胞毒性作用是化学反应代谢产物通过产生交联来烷基化并损伤DNA[30]。在动物模型中,短期内给予一定剂量的CTX 可显著降低小鼠的体质量,抑制免疫器官功能,引起血清免疫球蛋白和细胞因子的失衡[31]。本研究通过连续3 d腹腔注射CTX,建立短期免疫抑制小鼠模型,给予LOPs 灌胃干预27 d,从细胞免疫、体液免疫、非特异性免疫3 个方面评价LOPs 的免疫调节作用。考虑到KM 小鼠自身具有一定的免疫调节能力,故设模型组以消除可能由于CTX 对小鼠自身免疫力造成的影响。
药物对免疫器官的影响可作为研究动物模型免疫调节作用的初步指标[32],脾脏和胸腺是机体最重要的免疫器官,其形态结构和功能状态在一定程度上反映了机体的免疫情况[33]。本研究结果显示,连续3 d 腹腔注射CTX 后,与空白组相比,其它组小鼠出现脱毛现象,粪便干涩,精神涣散,小鼠体质量下降显著,说明CTX 可短期抑制小鼠的免疫调节功能,具有明显毒性。模型组小鼠的脾脏指数较空白组显著增加,形态学观察结果提示脾脏颜色加深、水肿肥大;与模型组相比,乳清蛋白组和LOPs 低、中、高剂量组的脾脏指数降低,且LOPs 组呈剂量依赖性。这些数据表明CTX 可导致胸腺和脾脏肿大,这与Shen 等[34]的研究结果一致,提示LOPs 可能通过减轻脾脏颜色加深,缓解水肿肥大症状,从而改善异常的免疫脏器指数。
HE 染色可用于观察免疫脏器的病理学形态,受到CTX 的毒作用损伤后,脾脏的脾小结发育不良且存在破损现象,白髓、红髓边界模糊不清;胸腺的皮质、髓质边界难以区分,且可观察到皮质面积减小和髓质面积增大[27]。本研究结果显示,与空白组相比,模型组脾脏和胸腺组织结构损伤严重;与模型组相比,乳清蛋白质组的免疫器官组织结构损伤得到修复,LOPs 低、中、高剂量组免疫器官组织结构随着质量浓度的增加逐渐恢复到正常水平,且LOPs 中、高剂量组的恢复水平高于乳清蛋白组。这些病理学观察结果表明,CTX 可对免疫脏器造成一定的损害作用,这与Huang 等[35]的研究结果一致,提示LOPs 通过保护并修复CTX 对免疫器官的损伤,从而提高机体的免疫调节能力。
体液免疫是机体一种重要的免疫反应,由B淋巴细胞介导,SRBC 免疫后小鼠血清中溶血素(SRBC 抗体) 的形成可以有效反映体液免疫的作用[36]。本研究中,模型组小鼠血清溶血素水平与空白组无明显差别,乳清蛋白和LOPs 高剂量组小鼠血清溶血素水平均显著升高,提示LOPs 可能通过改善血清中补体的溶血活性,从而增强体液免疫。
浆细胞分泌的免疫球蛋白是机体在感染方面的重要屏障,分泌型IgA、IgG、IgM 作为血清中主要抗体成分[37],其中IgG 是机体血清免疫球蛋白中含量最高的,是机体主动对抗外来抗原产生的抗体,在体液免疫中发挥着重要作用,而IgM 是机体血清免疫球蛋白分子质量最大的,是机体初始免疫中发挥抗感染作用的抗体[33],因此,它们在机体血清中的质量浓度可以反映体液免疫功能。研究结果显示,与空白组和模型组相比,LOPs 干预组小鼠血清中IgA、IgG、IgM 质量浓度明显升高,提示LOPs 可能通过增加免疫球蛋白浓度来增强机体的体液免疫,并通过缓解免疫抑制症状来维持稳态。
IL-2 是诱导淋巴细胞分化并发挥免疫调节作用的最重要免疫因子之一[38]。IFN-γ 可介导细胞免疫功能,通过调节巨噬细胞、NK 细胞的生长,增强免疫调节作用[22]。本研究中,相比空白组和模型组,LOPs 干预组小鼠的IL-2、IFN-γ 质量浓度明显升高,而不呈剂量依赖性;提示LOPs 可能通过上调IL-2、IFN-γ 等细胞因子的表达而影响其介导的免疫反应,从而改善机体的免疫功能。
4 结论
LOPs 具有一定的免疫调节能力,可显著改善环磷酰胺对小鼠脾脏、胸腺免疫脏器的损伤,提高小鼠血清中溶血素水平,增加免疫球蛋白质量浓度,并通过上调IL-2、IFN-γ 等细胞因子的表达,提高小鼠免疫功能。此外,由于LOPs 中含有高比例的低分子肽,具有作为特殊医学用途配方食品高端蛋白基料的潜在价值,在消化吸收方面具有显著优势。
