依托咪酯减轻LPS诱导的小鼠急性肺损伤
2022-11-22景建闯张志军
景建闯,张志军
(安阳市人民医院 麻醉科, 河南 安阳 455000)
急性肺损伤(acute lung injury,ALI)是由大量炎性细胞浸润、中性粒细胞聚集以及炎性介质的产生而导致肺组织出现炎性反应为主的病理改变[1]。虽然对ALI的研究和治疗取得了突破性进展,但ALI病死率仍高达30%~50%[2]。因此研究高效的防治ALI药物具有重要的临床意义。依托咪酯是咪唑类衍生物,属于临床常见的静脉麻醉药物之一,对内毒素急性肺损伤小鼠具有保护作用[3]。依托咪酯对该信号通路影响以及减轻急性肺损伤的作用机制却鲜有报道。因此,本实验以脂多糖(lipopolysaccha-ride,LPS)气管滴注法建立ALI小鼠,探讨依托咪酯对ALI小鼠信号通路的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物:120只清洁级、雄性、C57bL/6小鼠,体质量20~22 g[北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2020-0004]。
1.1.2 实验试剂:依托咪酯(江苏恒瑞医药股份有限公司);LPS(默克公司);白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒(武汉默沙克生物科技有限公司);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(上海纪宁实业有限公司);HE染色试剂盒(北京索莱宝科技有限公司);TXNIP、NLRP3一抗(Abcam公司)。
1.2 方法
1.2.1 小鼠分组及处理:将90只小鼠随机分为对照组、模型组(气管滴注10 mg/kg LPS溶液建立ALI小鼠模型)[4]、依托咪酯低(5.0 mg/kg)、中(10.0 mg/kg)、高剂量(20.0 mg/kg)组[5]、阳性对照(血必净注射液,100 μL)组[6],每组15只。为明确TXNIP/NLRP3信号通路在ALI治疗过程中的作用,给予依托咪酯高剂量组治疗同时加入TXNIP过表达载体(pcDNA3.1-TXNIP,5 nmol/L),组别设置为依托咪酯高剂量+TXNIP空载体(pcDNA3.1)组、依托咪酯高剂量+pcDNA3.1-TXNIP组[7],每组15只。腹腔注射相应剂量药物,皮下注射相应载体,每天1次,连续给药10 d。末次给药结束2 h后,对照组气管滴注等体积的0.9% NaCl溶液,其余各组均采用气管滴注10 mg/kg LPS溶液建立ALI小鼠模型。
1.2.2 检测小鼠呼吸功能:用Buxco小动物呼吸肺功能检测仪检测小鼠呼吸功能,待波形稳定后记录呼吸频率(breath/min)、气道阻力(cmH2O)、动态肺顺应性(L/cmH2O)。
1.2.3 ELISA检测血清中炎性因子水平:取腹部主动脉血液,分离血清,严格按照ELISA试剂盒说明书进行操作,检测血清中IL-6、TNF-α含量。
1.2.4 测定肺脏湿/干重(W/D)比值:各组随机选取5只小鼠,称量并记录湿重;置于80 ℃恒温箱中干燥48 h以上,称量并记录干重,计算肺脏W/D比值。
1.2.5 HE染色观察小鼠肺组织病理学及损伤评分:各组剩余10只小鼠麻醉并处死,取出肺组织,制备切片,于显微镜下随机选取5个视野进行病理学观察。肺组织损伤评分标准主要观察肺泡壁增厚以及炎性细胞浸润情况,无损伤是0分,轻度损伤是1分,中度损伤是2分,严重损伤是3分。
1.2.6 Western blot检测肺组织中TXNIP、NLRP3蛋白表达:加入裂解液制备肺组织匀浆,离心提取总蛋白,ABC法对蛋白进行定量。蛋白进行SDS-PAGE分离,转膜,牛奶封闭。加入稀释后的TXNIP、NLRP3一抗,4 ℃冰箱孵育过夜。加入稀释后的二抗(1∶10 000)室温孵育1 h,TBST洗涤,ECL显色、拍照。以β-actin为内参,测定吸光度值,定量分析TXNIP、NLRP3蛋白表达水平。
1.3 统计学分析
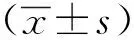
2 结果
2.1 依托咪酯对ALI小鼠呼吸功能的影响
与对照组相比,模型组肺顺应性、呼吸频率显著降低(P<0.05),气道阻力显著增加(P<0.05);与模型组相比,依托咪酯低、中、高剂量组肺顺应性、呼吸频率均呈现剂量依赖性增加(P<0.05),而气道阻力下降(P<0.05)(表1)。

2.2 依托咪酯对ALI小鼠血清中炎性因子水平的影响
与对照组相比,模型组小鼠血清中IL-6、TNF-α水平显著增加(P<0.05);与模型组相比,依托咪酯低、中、高剂量组小鼠血清中IL-6、TNF-α水平呈现剂量依赖性降低(P<0.05)(表2)。

表2 各组小鼠血清中IL-6和TNF-α水平
2.3 依托咪酯对ALI小鼠肺脏W/D比值影响
与对照组相比,模型组小鼠肺脏W/D显著增加(P<0.05);与模型组相比,依托咪酯低、中、高剂量组小鼠肺脏W/D呈现剂量依赖性降低(P<0.05)(表3)。
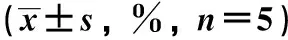
表3 各组小鼠肺脏W/D比值
2.4 依托咪酯对ALI小鼠病理学变化及肺组织损伤评分的影响
对照组小鼠肺组织结构完整清晰,无炎性细胞浸润和肺泡壁增厚;与对照组相比,模型组小鼠肺组织损伤严重, 出现炎性细胞浸润、 水肿、 肺泡壁增厚现象,肺组织损伤评分显著增加(P<0.05);与模型组相比,依托咪酯低、中、高剂量组随着剂量的增加,炎性细胞浸润、水肿、肺泡壁增厚均得到不同程度的缓解,肺组织损伤评分逐渐下降(P<0.05)(图1,表4)。

图1 各组小鼠肺组织病理学变化Fig 1 Lung tissue pathology change of mice in each group(HE, ×400)
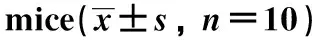
表4 依托咪酯对ALI小鼠肺损伤评分的影响
2.5 依托咪酯对小鼠肺组织中TXNIP、NLRP3蛋白表达的影响
与对照组相比,模型组小鼠肺组织中TXNIP、NLRP3蛋白表达均增加(P<0.05);与模型组相比,随着依托咪酯剂量的增加,TXNIP、NLRP3蛋白表达逐渐降低(P<0.05)(图2,表5)。

A.control; B.model; C.L-etomidate; D.M-etomidate; E.H-etomidate; F.positive图2 Western blot检测各组小鼠肺组织中TXNIP和NLRP3蛋白表达Fig 2 TXNIP and NLRP3 protein expression in lung tissue of mice by Western blot
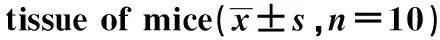
表5 各组小鼠肺组织TXNIP和NLRP3蛋白表达
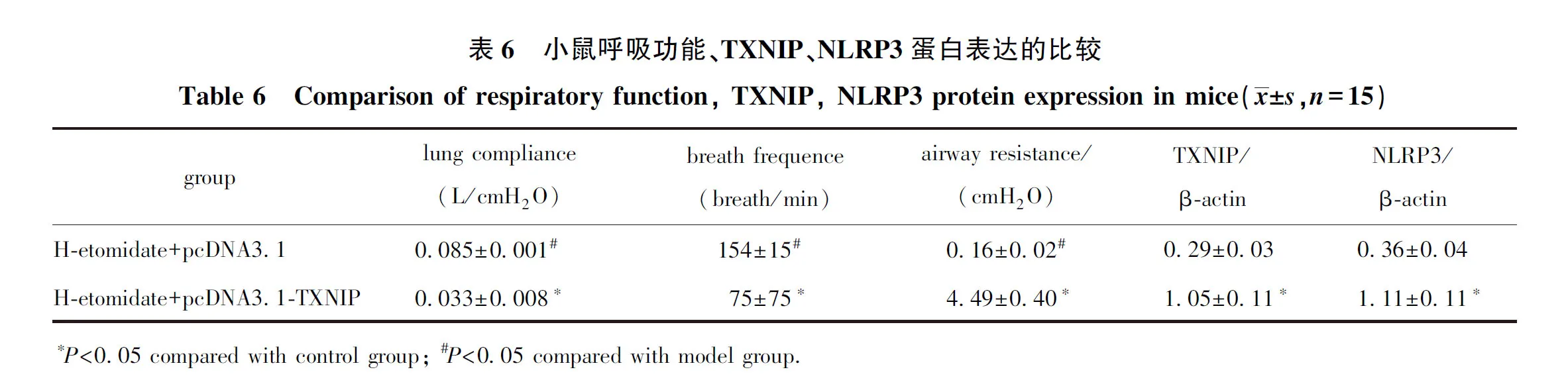
2.6 过表达TXNIP对ALI小鼠呼吸功能及TXNIP、NLRP3蛋白表达的影响
与依托咪酯高剂量+pcDNA3.1组相比,依托咪酯高剂量+pcDNA3.1-TXNIP组小鼠肺顺应性、呼吸频率显著降低(P<0.05),气道阻力、TXNIP、NLRP3表达显著增加(P<0.05)(图3,表6)。
3 讨论
ALI为严重的急性呼吸窘迫综合征(ARDS),主要是肺部炎性反应引起肺间质水肿、肺顺应性恶化, 病情发展迅速, 病死率高, 且ALI发病机制复杂,尚无有效安全的药物治疗[8]。因此,明确其发病机制、寻找高效防治ALI药物成为国内外研究者关注的焦点。LPS可使机体先天性免疫功能受损,引发ARDS、全身炎性反应以及致命性多器官功能衰竭,常被用作制备ALI动物模型[9]。本实验采用气管滴注LPS溶液建立ALI小鼠模型,。
依托咪酯作为非巴比妥类静脉麻醉药的一种,具有强而短效的特点,降低患者躁动发生的概率和程度,在许多疾病治疗以及大型手术中疗效显著,具有广阔的应用前景[10]。研究发现依托咪酯可以抑制LPS诱导的神经胶质细胞中IL-1β的表达,保护中枢神经系统[11]。本实验结果发现依托咪酯随着剂量变化,可以不同程度地改善炎性细胞浸润、肺泡壁增厚,增加肺顺应性、呼吸频率,降低肺组织病理评分、气道阻力、肺脏W/D,提示依托咪酯可减轻LPS诱导的ALI,但具体机制需进一步探讨。
气管滴注LPS建立ALI小鼠模型时,LPS会破坏巨噬细胞、嗜中性粒细胞的活化,从而导致促炎因子如TNF-α、IL-6等的大量释放,进而募集中性粒细胞进入肺部,引起炎性瀑布反应,进而造成组织损伤。本实验研究发现依托咪酯干预后,IL-6、TNF-α水平显著降低,表明依托咪酯可能通过抑制IL-6、TNF-α水平改善LPS诱导的ALI小鼠症状。研究表明,TXNIP/NLRP3信号通路与炎性反应密切相关。NLRP3炎性反应小体在ALI炎性反应中发挥着重要作用,可以诱导TXNIP从硫氧还蛋白中解离,与NLRP3结合形成炎性复合物,促进炎性因子的释放, 产生炎性反应, 导致ALI的发生[12]。实验结果发现模型组肺组织中TXNIP、NLRP3蛋白表达均增加,经依托咪酯干预后,TXNIP、NLRP3蛋白表达降低。表明LPS通过激活TXNIP/NLRP3信号通路,促进炎性因子的释放,而依托咪酯可有效抑制炎性反应,这可能与抑制TXNIP/NLRP3信号通路有关,为进一步验证该结论,实验引入pcDNA3.1-TXNIP,结果发现pcDNA3.1-TXNIP可逆转依托咪酯对小鼠的保护作用。
综上所述,依托咪酯可以减轻炎性反应,减轻LPS诱导的ALI小鼠症状,其机制可能与抑制TXNIP/NLRP3信号通路有关,但由于依托咪酯改善LPS诱导的ALI的机制较为复杂,仍需要进一步探索。
