胰岛素治疗在PDX-1 诱导胰岛β 细胞再生中的作用
2022-11-21魏玲玲张丽洁杨龙艳赵冬
魏玲玲,张丽洁,杨龙艳,赵冬
(首都医科大学附属北京潞河医院内分泌代谢与免疫性疾病中心,糖尿病防治研究北京市重点实验室,北京 101149)
诱导胰岛β 细胞体内再生是一种新兴的治疗糖尿病的方法。[1-3]。研究发现,在胰腺的发育过程中有许多决定其命运的特异性转录因子[4]。多项研究表明,瞬时表达多种转录因子能够将成年的胰腺外分泌细胞转化为类似于功能性β 细胞的细胞[5-8]。通过这种基因治疗技术可以在糖尿病动物的胰腺中诱导出分泌胰岛素的细胞。然而,由于需要多种转录因子,且重编程得到的分泌胰岛素的细胞在调节葡萄糖代谢方面的功能较弱,因此该方法的临床应用仍然受到限制。胰腺十二指肠同源盒因子-1(pancreatic and duodenal homeobox gene 1, PDX-1)是促进胰腺β 细胞发育和成熟的关键转录因子。研究证实,单独转染PDX-1 能够成功促使肝细胞等其他类型细胞向胰岛素分泌细胞转分化[9-12]。还有研究证实,通过小鼠腹腔注射PDX-1蛋白质,可以逆转小鼠糖尿病[13]。本研究中,我们尝试PDX-1 转染联合胰岛素治疗的方法,诱导糖尿病小鼠胰腺中再生胰岛素分泌细胞,形成了类似于正常小鼠的胰岛样结构,且小鼠血糖水平恢复正常,探索此种基因治疗方法在糖尿病治疗中的应用价值。
1 方 法
1.1 腺病毒构建:首先构建目标基因(PDX-1 或LacZ 基因)的穿梭载体,然后再构建pAd/CMV/V5腺病毒载体(Invitrogen 公司)。采用Stratagene 公司的AdEasy 试剂盒在293 细胞中构建重组腺病毒并纯化获得高滴度病毒(>1×1010pfu/ml)。
1.2 糖尿病模型的建立:通过腹腔内注射浓度为200 mg/kg 的链脲佐菌素(streptozocin,STZ)(Sigma)在成年雄性C57BL/6J 小鼠中建立糖尿病模型。5 ~ 7 d 后,通过每日用Roche Diagnostics ACCU-CHEK活性葡萄糖监测仪测量血糖(blood glucose,BG)水平,连续2 d BG >16.7 mmol/L 被认为糖尿病模型建立成功。 然后将糖尿病小鼠分为4组(每组10只):① Ad-LacZ 组。②Ad-PDX-1 组。③Ad-LacZ 加胰岛素治疗组。④Ad-PDX-1 加胰岛素治疗组。
1.3 胰腺内注射腺病毒载体:在全身麻醉(腹腔内注射5%氯胺酮,100 mg/kg)下,开腹向糖尿病小鼠胰腺内多点注射共计100 μl(1×109pfu)腺病毒载体(Ad-LacZ 或Ad-PDX-1)。
1.4 胰岛素治疗:联合胰岛素治疗组的小鼠每只每天皮下注射1 个单位的人胰岛素(50%常规和50%NPH 的混合液)。 每天胰岛素注射前测定小鼠血糖,一旦血糖水平恢复正常(BG <11.1 mmol/L),即停止胰岛素注射。
1.5 组织学和酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)分析:获取小鼠胰腺组织,然后进行HE 染色和免疫组织化学(胰岛素、胰高血糖素和PDX-1 染色)分析。利用ELISA 试剂盒(Millipore)检测胰腺中的胰岛素含量。
2 结 果
2.1 转基因在胰腺中的表达:为了证明转基因的表达,在腺病毒注射后3 d 获取胰腺。 X-gal 染色检测Ad-LacZ 载体注射后β-半乳糖苷酶表达情况,表明LacZ 在腺泡组织和一些相互连接的组织中均有表达(图1A),但PDX-1 基因的表达似乎仅限于一些主要位于导管或连接组织区域的分散细胞(图1B)。
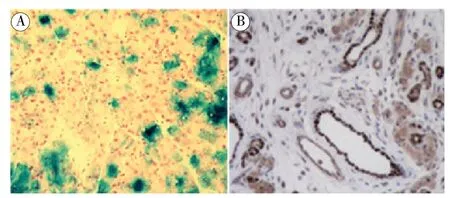
图1 胰腺组织学检测显示LacZ 基因(X-gal 染色,×200)
2.2 PDX-1 联合胰岛素治疗可逆转糖尿病:为了确定转基因和胰岛素治疗的效果,用血糖仪测量各组小鼠血糖水平30 d。如图2 所示,未经胰岛素治疗,第1 组(Ad-LacZ 组)和第2 组(Ad-PDX-1 组)中的所有动物血糖水平均未变为正常。在整个30 d 的实验期间,血糖均保持在较高水平,两组之间未观察到明显差异(P >0.05)。这表明单独的PDX-1 不能逆转糖尿病。但是,随着胰岛素的引入,Ad-PDX-1 组动物的血糖水平逐渐降低,在2 ~ 3 周内恢复正常(BG <11.1mmol/L)。而且在停用胰岛素(治疗开始后第20 天)后血糖仍保持正常水平。相比之下,Ad-LacZ 对照组的动物在实验期间即使注射胰岛素也仍然具有高血糖,两组具有显著性差异(P <0.05)(图2)。这些结果表明,Ad-PDX-1基因转染与胰岛素治疗相结合可逆转小鼠糖尿病,这可能是诱导胰岛素分泌细胞再生的结果。
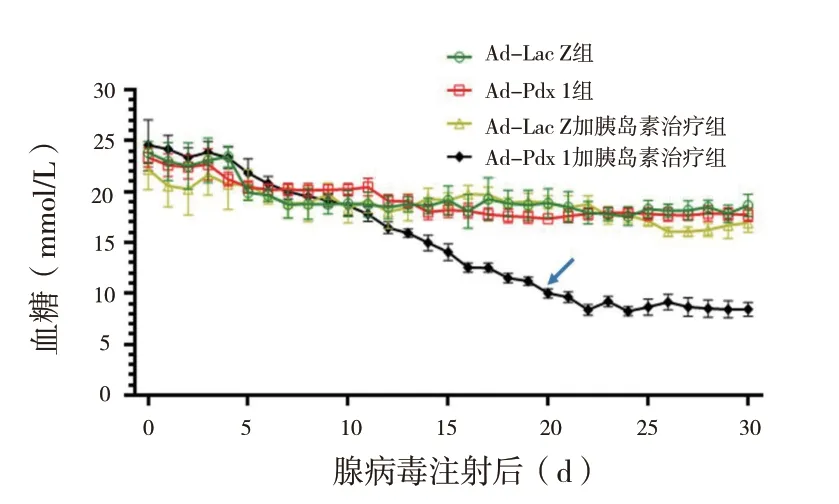
图2 转基因和胰岛素治疗后糖尿病小鼠的血糖变化
2.3 PDX-1 联合胰岛素治疗诱导胰岛再生:为了确定PDX-1 是否与胰岛素治疗联合诱导产生了胰岛素分泌细胞并形成了新的胰岛,研究对实验动物进行了组织学检测。在对照小鼠的胰腺中未观察到胰岛素阳性细胞或只有很少的胰岛素阳性细胞。在用Ad-PDX-1 联合胰岛素治疗的小鼠胰腺中观察到大量新形成的胰岛素分泌细胞,而未观察到分泌胰高血糖素的细胞(图3A),与正常小鼠胰岛(图3B)不同。HE 染色显示,这些新生的分泌胰岛素的细胞形成胰岛样结构(图3C),新形成的胰岛的形态与正常小鼠的形态非常相似(图3C 和 3D),只是它们似乎起源于导管区域(图 3D),其胰岛大小比正常胰腺和对照组胰腺的胰岛相对更大。

图3 胰腺组织学检测显示Ad-PDX-1 加胰岛素治疗组小鼠
为了确定新形成的胰岛是否正常起作用,通过ELISA 定量评估了胰腺中的胰岛素含量。结果表明,Ad-PDX-1 加胰岛素治疗组小鼠胰腺中的胰岛素含量〔微克/克胰腺,(7.8±1.3) μg/g〕比Ad-LacZ 加胰岛素治疗组小鼠高出5 倍以上〔(1.5±0.6) μg/g,P <0.05,图4〕,表明新诱导的胰岛具有分泌胰岛素的能力,与上述观察结果相似,即在终止胰岛素应用后血糖水平保持正常(图2B)。这些结果表明,PDX-1 结合胰岛素治疗可诱导糖尿病小鼠胰腺中功能性分泌胰岛素细胞的产生并形成新的胰岛组织样结构。
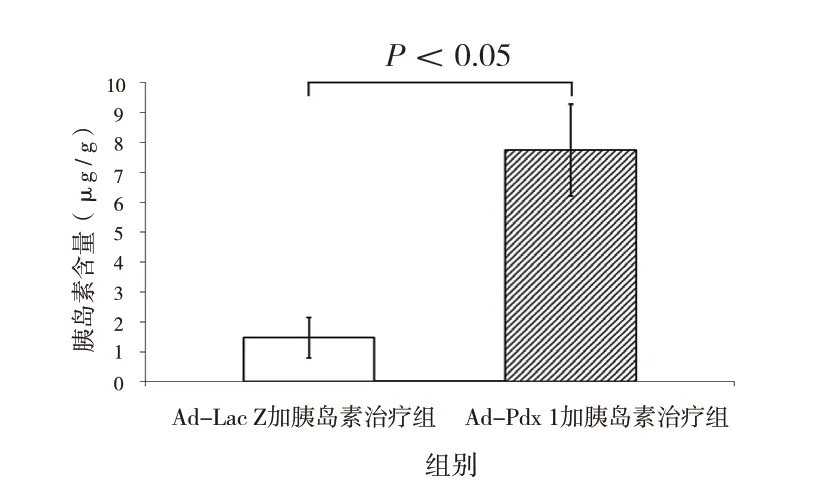
图 4 ELISA 检测小鼠胰腺中胰岛素含量(n=10)
3 讨 论
以往的研究表明,异位表达PDX-1 可以诱导肝细胞等多种细胞转化为分泌胰岛素的细胞,并逆转糖尿病小鼠的血糖水平至正常[9-10]。PDX-1 的高表达能够诱导某些胰腺基因的特异性表达,然而,这些诱导产生的分泌胰岛素的细胞通常不能形成胰岛样结构,并且不具备强的调节葡萄糖代谢的功能。同时表达多个转录因子(如PDX-1、Ngn3和Mafa)的研究,能将完全分化的外分泌细胞重编程为与成熟胰岛β 细胞非常相似的胰岛素分泌细胞[8,14]。但这些重编程的分泌胰岛素的β 细胞缺乏胰岛样组织结构,削弱了它们的功能,且需要同时转染3 个转录因子的要求也阻碍了这种方法的临床推广应用。另有一些研究表明,生长因子促进了胰腺腺泡细胞中分泌胰岛素的β 细胞的再生[15-16]。将生长因子引入基因转染过程中可能是简化以及克服前述障碍的关键。
本研究中,我们将胰岛素治疗与单个转录因子PDX-1 结合使用。 这种组合有效地诱导了胰岛β 细胞的再生,从而逆转了糖尿病小鼠的高血糖。作为生长因子,胰岛素可以增强,促进和完成由PDX-1 表达引发的胰岛再生过程。 同时,它还可以将高血糖症的严重程度减轻到刺激或至少不损害胰岛再生过程的程度。 胰腺切除的小鼠中胰岛再生的研究表明,PDX-1 的表达水平与胰岛素信号传导中间体IRS2 和Akt 相关[17]。尽管利用腺病毒转染PDX-1 几乎不受胰岛素信号的影响,但其翻译和翻译后修饰可能受这些中间体的影响。
胰腺的组织形态学检测结果显示,再生的胰岛素分泌细胞具有3 个特征:分泌胰岛素的细胞很好的组织成类似于正常胰岛的结构;这些细胞大部分位于导管区附近;新形成的胰岛仅由产生胰岛素的β 细胞组成,没有产生胰高血糖素的α 细胞。这些数据表明,新的胰岛是通过胰岛再生过程而不是重编程机制形成的。我们推测这些新形成的胰岛细胞很可能起源于胰腺内导管样前体细胞[18],但这还需要进一步的研究来证明。总之,利用本研究的方法再生的胰岛功能正常且能够逆转小鼠高血糖,有可能成为糖尿病治疗的理想策略之一。
