双重血浆分子吸附系统治疗肝衰竭患者发生血管迷走神经反应相关因素分析及其处理对策研究*
2022-11-21贺锦帆白津佳赵凝慧
贺锦帆,姚 佳,赵 强,王 娟,白津佳,赵凝慧
肝衰竭(liver faiure,LF)是多种因素引起的严重肝损害,导致肝脏合成、解毒、代谢和生物转化功能严重障碍或失代偿,出现以黄疸、凝血功能障碍、肝肾综合征、肝性脑病、腹水等主要表现的一组临床症候群,病死率极高[1]。人工肝是治疗LF的重要手段[2]。近年来,双重血浆分子吸附系统(double plasma molecular adsorption system,DPMAS)在临床上应用越来越多。前期的研究表明,DPMAS的应用提高了LF患者的生存率[3]。但是,在DPMAS治疗过程中,易诱发一些新的并发症,值得关注。血管迷走神经反应(vasovagal reaction,VVR)是由迷走神经介导的异常自主神经失衡[4, 5],表现为进行性心率(heart rate,HR)降低和血压(blood pressure,BP)降低[6],其特征是低BP后出现矛盾性心动过缓[4, 5, 7]。既往研究发现VVR多见于献血[8]、脊柱注射[9]、经股动脉导管插入脑血管造影[5]、皮肤科手术[10]、经皮冠状动脉介入治疗[11]和静脉插管[12]等。本文总结分析了近1年来我院消化内科采用DPMAS治疗LF和LF前期患者的临床资料,就VVR发生特点、相关影响因素和处理情况报道如下。
1 资料与方法
1.1 病例来源 2021年1月~2022年3月山西白求恩医院消化内科诊治的LF患者82例,男性43例,女性39例,平均年龄为48.7±10.9岁,体质指数(body mass index,BMI)为22.9±4.4kg/m2;LF前期患者17例,男性12例,女性5例,平均年龄为51.1±10.8岁,BMI为24.6±4.2kg/m2。LF诊断符合《肝衰竭诊治指南(2018年版)》[1],其中LF前期的诊断依据[1]为:(1)伴有极度乏力、纳差、恶心呕吐、腹胀等消化道症状;(2)血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)两者或其中一项大幅升高,血清总胆红素(total bilirubin,TBIL)进行性升高(85.5≤TBIL<171μmol/L)或每日上升≥17.1μmol/L;(3)40%<凝血酶原活动度(prothrombin activity,PTA)≤50%,且国际标准化比值(international normalized ratio,INR)<1.5。病因包括乙型肝炎29例、药物性肝损伤27例、酒精性肝病22例、自身免疫性肝炎8例、原发性胆汁性肝硬化5例和病因不明8例;82例LF患者临床分型包括亚急性肝衰竭(subacute liver failure,SALF)17例和慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)65例。临床分期包括LF前期17例,早期47例,中期35例。排除标准:(1)急性和慢性肝衰竭患者;(2)采用DPMAS联合血浆置换、DPMAS联合血浆灌流或DPMAS联合血液透析滤过治疗患者;(3)合并严重的心脑肺肾疾病和血流动力学不稳定患者;(4)PTA<20%。VVR诊断标准:患者在仰卧位时出现心动过缓(HR<60次/分)和低收缩压[(systolic blood pressure,(SBP)<100 mmHg],并伴有恶心、出汗、腹部不适、视力模糊、胸闷、排便、头晕、晕厥等相关症状[4, 5, 7],排除心力衰竭和心肌梗死等其他并发症。本研究经山西白求恩医院医学伦理委员会批准(伦理号:YXLL-2019-016),患者签署知情同意书。
1.2 基本治疗 常规给予药物护肝、输注血浆改善凝血功能、补充人血白蛋白、抗病毒和抗感染等治疗。
1.3 DPMAS治疗方法 采用股静脉置管,使用Plasauto ∑机器(Asahi Kasei)进行DPMAS治疗。使用旭化成OP-08W血浆分离器分离血浆,使用珠海健帆BS330胆红素吸附器和HA330-II血液灌流器。治疗前,根据凝血功能和血小板(platelet,PLT)计数,给予首剂量肝素抗凝。根据跨膜压、静脉压、动脉压等变化,行个体化肝素剂量抗凝维持。DPMAS治疗参数设置:血流速度为100~150 mL/min,分浆比为20%~30%。血浆分离速度为20~45 mL/min。治疗2~5次/w,每例治疗3~6次。每次治疗2~3 h,处理血浆5.5 L。术中,严密监测和记录神志、HR、BP、血氧饱和度、体温、血流量、跨膜压、静脉压、动脉压、血浆处理量和肝素使用量。
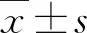
2 结果
2.1 基线资料 见表1。
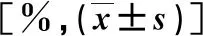
表1 两组基线资料
2.2 VVR发生情况 在99例LF和LF前期患者417例次DPMAS治疗过程中,8例患者发生VVR 13例次(3.1%)。
2.3 VVR与非VVR组临床资料比较 在DPMAS治疗前,VVR组SBP、HR和静脉压显著低于非VVR组,差异有统计学意义(P<0.05,表2)。
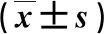
表2 VVR组与非VVR组临床资料比较
2.4 治疗前SBP对VVR发生的影响 治疗前,在24例次SBP≤92mmHg的患者中,发生VVR 2例次(8.3%);在107例次SBP>123 mmHg的患者中,发生VVR 0例次(0.0%);在174例次SBP≤110mmHg的患者中,发生VVR 10例次(5.7%),占发生VVR总例次(13例次)的76.9%;在243例次SBP>110mmHg的患者中,发生VVR 3例次(1.2%),占发生VVR总例次(13例次)的23.1%。
2.5 VVR发生特点 在VVR发生时,所有8例(100%)患者表现为SBP和HR进行性下降,最低SBP为66.8±11.9 mmHg,最低HR为43.5±7.3 bpm,伴有恶心(38.5%)、出汗(38.5%)、腹部不适(30.8%)、视力模糊(23.1%)、胸闷(15.4%)、排便(7.7%)、头晕(7.7%)、晕厥(7.7%)等症状。VVR发生时间为自治疗开始到第20~91 min,持续时间为10~105 min(表3)。

表3 DPMAS相关VVR具体信息与DPMAS治疗相关参数
2.6 针对VVR的治疗措施与效果 在所有发生VVR的患者,停止分浆泵,给予羟乙基淀粉氯化钠注射液500 ml静脉滴注,以提高循环血容量;给予2例次患者阿托品0.5mg静脉推注治疗。在经过处理后,患者SBP、DBP和HR逐渐上升,不适症状消失,无死亡病例。在DPMAS治疗前,23例SBP偏低(≤110 mmHg)或治疗过程中发生过VVR的患者,预防性给予羟乙基淀粉氯化钠注射液静脉滴注,将SBP提高至120 mmHg以上,在后续DPMAS治疗过程中未再发生VVR。
3 讨论
VVR是一种由迷走神经介导的自主神经失调引起的症状,起始由肾上腺素引起HR和BP的初始升高,继而出现迷走神经的激活和交感神经的快速抑制,导致心动过缓和血压下降,从而导致脑血流量减少[7, 13, 14]。在本研究中,DPMAS治疗相关VVR是一种较为少见的并发症,但症状明显,表现为进行性的BP和HR减低,并伴有恶心、出汗、腹部不适、视力模糊、胸闷、排便、头晕、晕厥等症状。在一项关于献血相关的VVR研究中,献血者发生VVR时最常见的症状是乏力(64%)、出汗(47.6%)、苍白(38.2%)、晕厥(20.5%)、头痛(14%)、头晕(11.2%)和恶心(8.4%)[8]。当发生VVR时,患者BP下降,导致皮肤血流量减少,进而出现面色苍白[15]。在本研究,入组患者均皮肤黄染。当VVR发生时,皮肤苍白的表现不明显。患者在DPMAS治疗时,处于平卧位,发生VVR时,与献血诱发相比,乏力症状表现不明显。
不同个体发生VVR的影响因素存在差异[16]。在本研究DPMAS治疗前,VVR组SBP和HR较非VVR组低,考虑患者的低SBP和慢HR可能是诱发VVR发生的重要指标。在DPMAS治疗过程中,血液会经过机器管道离开人体,导致血容量相对不足,可能引起与献血类似的应激反应,引起VVR[7]。在DPMAS治疗时,低BP易发生VVR,可能与DPMAS同时连接胆红素吸附柱和血浆灌流器导致体外循环血量大(约增加500 ml)有关。既往研究显示,女性、年龄轻、BMI、恐惧和初次献血与VVR发生具有相关性[17-20]。
患者在DPMAS治疗过程中发生VVR时,不适症状明显,对初次进行治疗的患者容易引起恐慌。因此,采取必要的预防和治疗措施十分重要。对SBP≤110 mmHg的患者,在实施DPMAS治疗前,予以羟乙基淀粉氯化钠注射液静脉滴注补充血容量,提高SBP,可有效预防VVR的发生。当发生VVR时,治疗措施包括停分浆泵以消除刺激,补液,必要时给予阿托品抑制迷走神经反射。本研究在DPMAS治疗过程中发生VVR时均予以及时处理,无患者死亡。
综上所述,DPMAS治疗相关VVR是一种较为少见的并发症,治疗前SBP和HR是影响患者发生VVR的重要因素。静脉滴注羟乙基淀粉氯化钠注射液是预防VVR发生的主要措施。关于DPMAS治疗相关VVR发生的具体机制仍有待进一步阐明和分析。
