非酒精性脂肪性肝病患者血清胱抑素C、脂蛋白α和nesfatin-1水平变化及其临床意义探讨*
2022-11-21张喜梅
樊 叶,张喜梅,张 岩
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是指除酒精和其他明确的肝损因素所致,肝组织内出现脂质沉积超过肝脏质量5%或以上,显微镜下显示弥漫性肝细胞脂肪变的一种临床病理综合征[1,2]。肝活检属侵入性有创操作,推广应用存在一定的困难,因此寻找一种简单且无创的疾病识别方法并对病情进展实施监控是十分必要的[3]。胱抑素C(cystatin C,CysC)是一种半胱氨酸蛋白酶细胞外抑制剂,与高血压、胰岛素抵抗、肥胖等疾病有关,可反映机体的炎症反应状态[4]。NAFLD患者肝脏合成和代谢功能均出现异常。脂蛋白α(lipoprotein α,Lp-α)在脂蛋白代谢过程中参与脂类运输过程,发挥脂蛋白及其受体的结合引导和酶活性调节等作用[5]。人新饱食分子蛋白1( nesfatin-1) 是新发现的可抑制食欲的生物大分子,在维持能量稳态和正常糖代谢过程中具有重要的生理作用,参与胰岛素抵抗、肥胖、糖尿病等代谢性疾病的发病过程[6]。本研究检测了NAFLD患者血清CysC、Lp-α和nesfatin-1水平变化,分析了运用它们评估疾病严重程度的价值,现报道如下。
1 资料与方法
1.1 一般资料 2019年7月~2021年11月我院诊治的NAFLD患者119例,男性68例,女性51例;年龄为30~64岁,平均年龄为(37.5±9.8)岁。符合《非酒精性脂肪性肝病防治指南》[7]的诊断标准。排除标准:酒精性或病毒性肝炎、药物性肝损伤、自身免疫性肝病;存在全身感染性疾病或恶性肿瘤;存在严重的脏器功能损害;近期有创伤或手术等;近1个月内服用过非甾体类抗炎药或质子泵抑制剂等;孕期或哺乳期妇女。另选择同期经性别和年龄匹配的健康体检者65例作为对照组,其中男性37例,女性28例;年龄为30~65岁,平均年龄为(38.2±8.4)岁。本研究经我院医学伦理委员会审核、通过。
1.2 NAFLD严重程度评估 参照《非酒精性脂肪性肝病诊疗指南》[8]中超声诊断分度标准,将NAFLD分为轻、中、重度。①肝区近场弥漫性增强回声,且较肾和脾强,远场回声则呈现衰减形式;②肝内管道呈现不清晰;③肝脏呈现轻或中度肿大且边缘较为圆钝;④肝内血管走向正常,但血流信号减少;⑤肝右叶包膜、横膈回声均不完整或是不清晰。轻度:具①和②~④中任意一项者;中度:具①和②~④中任意两项;重度:具①和②~④中任意两项再加上第⑤项。
1.3 血清指标检测 采用ELISA法检测血清CysC、Lp-α和nesfatin-1(武汉优尔生生物工程有限公司);使用罗氏Modular全自动生化分析仪检测血生化指标和空腹血糖(Fasting plasma glucose,FPG)水平(宁波美康生物科技公司)。
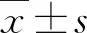
2 结果
2.1 两组血糖和血脂水平比较 NAFLD患者FPG、TG和LDL-C水平显著高于对照组(P<0.05,表1)。
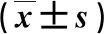
表1 两组血糖和血脂水平比较
2.2 两组血清CysC、Lp-α和nesfatin-1水平比较 NAFLD患者血清CysC水平显著高于对照组,而血清Lp-α和nesfatin-1水平显著低于对照组(P<0.05,表2)。
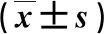
表2 两组血清CysC、Lp-α和nesfatin-1水平比较
2.3 轻、中、重度NAFLD患者血清CysC、Lp-α和nesfatin-1水平比较 重度NAFLD患者血清CysC水平显著高于中度或轻度患者,而血清Lp-α和nesfatin-1水平显著低于中度或轻度患者(P<0.05,表3)。
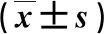
表3 不同脂肪变程度的NAFLD患者血清CysC、Lp-α和nesfatin-1水平比较
2.4 影响NAFLD严重程度的多因素Logistic回归分析 经Logistic回归分析结果显示,血清CysC、FPG、TG和LDL-C高水平或血清Lp-α和nesfatin-1低水平是影响NAFLD严重程度的独立危险因素(P<0.05,表4)。
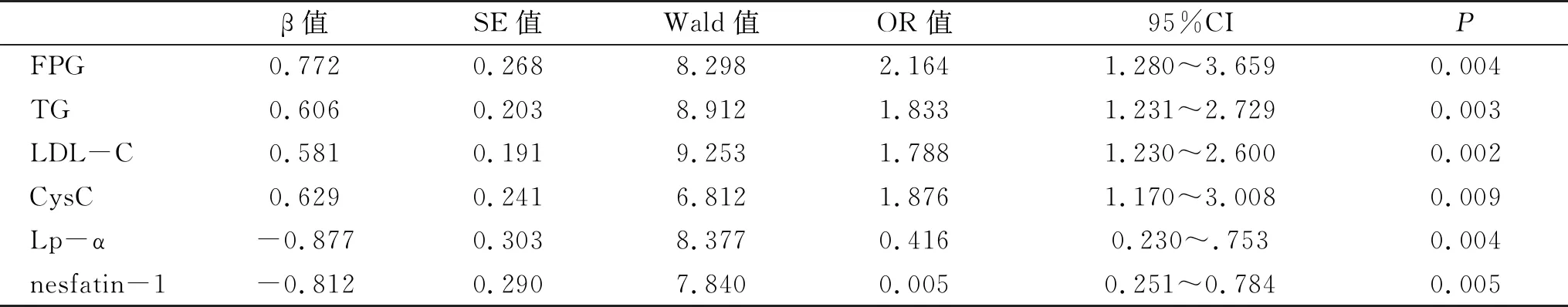
表4 影响NAFLD严重程度的Logistic回归分析
2.5 应用血清CysC、Lp-α和nesfatin-1评估重度NAFLD的效能 联合应用血清CysC、Lp-α和nesfatin-1水平评估重度NAFLD发生的曲线下面积(AUC)显著高于三项指标单独评估(P<0.05),其效能较高(表5、图1)。

表5 应用血清CysC、Lp-α和nesfatin-1评估重度NAFLD的效能
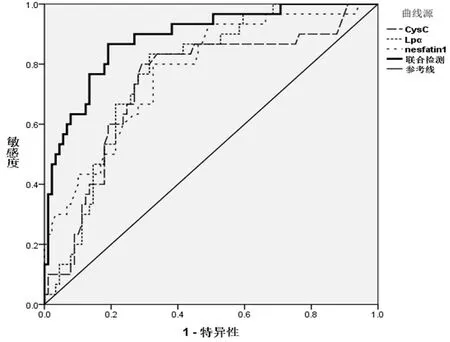
图1 血清CysC、Lp-α和nesfatin-1评估重度NAFLD的效能
3 讨论
NAFLD主要发生机制在于胰岛素抵抗和系统性炎症反应。随着现阶段肥胖和糖尿病等疾病发生率呈现逐年升高的趋势,NAFLD发生率也随之升高[9]。近年来,相关研究数据显示[10],普通成人NAFLD患病率达 20%~33%,在发达国家,NAFLD业已成为肝功能异常和慢性肝病发生的首要原因之一。
CysC经有核细胞恒定速率生成,在正常情况下分泌和排泄速率基本保持恒定,而受年龄、性别、饮食等因素的影响较小,与慢性肝脏炎症性疾病等关系密切,且随着病程进展,血清CysC水平呈现升高趋势。因此,CysC作为一种标志物可在一定程度上用于临床对肝脏功能的监测[11,12]。既往研究[13]比较了脂肪性肝炎、单纯性脂肪肝和健康人群血清CysC水平差异,结果显示,脂肪性肝炎和单纯性脂肪肝患者血清CysC水平显著升高,且随着病情加重,血清CysC水平进一步升高。本研究也显示NAFLD患者血清CysC水平升高。一方面,随着血清Cys C水平变化,影响机体胰岛功能,促进糖尿病发生发展进程;另一方面,Cys C可能通过氧化应激方式直接影响肝脏代谢,多种细胞成分均发生变化,包括DNA、脂质、蛋白质等,这些均与 NAFLD病理学改变相关。按超声诊断分度标准,将NAFLD患者分为轻、中、重度,结果随疾病严重程度增加,血清Cys C水平也随之升高。Cys C可在人体网膜组织、皮下脂肪组织表达,诱发脂肪相关性疾病的发生,进而对肝脏代谢产生影响,参与肝脏病理学改变过程,影响慢性肝病的发展[14]。
Lp-α是一种球形脂蛋白颗粒,中性脂质部分富含胆固醇,具疏水性,外周包绕Apo B100和Apo (a),构成复合物[15]。Lp-α特征性成分apo(a)由肝细胞合成,在内质网和高尔基体中加工成熟后,分泌到细胞外。在血循环中,与LDL颗粒组成完整的Lp-α分子[16]。本研究NAFLD患者血清Lp-α水平显著低于对照组。Lp-α主要合成场所在肝脏,因此肝脏疾病发生时,肝细胞受到损害,Lp-α合成减少,血清Lp-α水平相应降低。相关研究显示[17],中重度慢性肝炎患者血清Lp-α水平显著低于轻度慢性肝炎患者。随着肝损伤程度加重,Lp-α合成受损,血清Lp-α水平持续降低。本研究比较了轻度、中度、重度NAFLD患者血清Lp-α水平差异,结果显示随着NAFLD患者病情加重,血清Lp-α水平也随之降低,与上述研究结果一致,表明Lp-α参与脂质代谢和蛋白质代谢,是NAFLD患者肝功能损伤的敏感指标和早期生物标志物,临床上可通过检测血清Lp-α水平变化评估NAFLD的严重程度。
nesfatin-1于外周脂肪组织、胰腺、心肌、胃、小肠、睾丸等部位广泛分布,在糖脂代谢、能量稳态等能量代谢过程中发挥重要的作用[18]。既往研究[19]通过对糖尿病肥胖患者应用艾塞那肽8周,发现患者血清nesfatin-1水平明显升高。同时,患者肝脏脂肪含量显著下降。本研究NAFLD患者血清nesfatin-1水平显著低于对照组,nesfatin-1水平下降是严重NAFLD发生的独立危险因素。随着疾病进展,血清nesfatin-1水平进一步降低。糖代谢紊乱带来的初次打击和肝细胞脂肪变性后氧化应激带来的二次打击是NAFLD发病的分子机制。NAFLD患者血清nesfatin-1水平下降致使体内能量平衡出现紊乱,进一步促进NAFLD的发生和发展[20]。本研究经ROC曲线分析血清CysC、Lp-α和nesfatin-1三者联合检测评估重度NAFLD方面的价值,结果显示其AUC为0.887,具有较高的评估效能。血清CysC、Lp-α和nesfatin-1水平与NAFLD有密切的关系,或为NAFLD的发病机制和治疗研究提供了一个新的思路和靶点。
综上所述,NAFLD患者血清CysC水平升高,而血清Lp-α和nesfatin-1水平降低。随着疾病严重程度的加重,血清CysC水平呈升高趋势,而Lp-α和nesfatin-1水平下降更明显,检测这些指标的变化可能有助于评估患者病情。
