血清BAFF预测聚乙二醇干扰素-α治疗非活动性HBsAg携带者临床治愈的效能分析*
2022-11-21吴凤萍崔丹丹王怡恺刘晨瑞贾晓黎党双锁
吴凤萍,崔丹丹,王怡恺,李 梅,刘晨瑞,南 希,贾晓黎,党双锁
B淋巴细胞通过产生抗体、诱导免疫调节细胞因子分泌、充当抗原提呈细胞等调节T细胞应答,在体液免疫活动中发挥重要作用[1]。肿瘤坏死因子家族成员B细胞活化因子(B cell activating factor belonging to the tumor necrosis factor family,BAFF)或简称为B细胞活化因子是B淋巴细胞活化所必须的细胞因子,通过与其受体结合,对B淋巴细胞分化、成熟、生存和抗体分泌发挥促进作用[2]。既往研究发现BAFF与慢性病毒性肝炎的发病机制有关[3]。接受基于聚乙二醇干扰素-α(pegylated interferon alpha, Peg-IFN-α)方案治疗的慢性丙型肝炎患者血清BAFF水平升高,并且血清BAFF水平升高与丙型肝炎病毒(hepatitis C virus, HCV)的清除有关[4]。然而,接受Peg-IFN-α治疗的慢性乙型肝炎(chronic hepatitis B, CHB)患者血清BAFF水平的变化及其与治疗应答的关系目前尚不清楚。本研究应用Peg-IFN-α治疗非活动性HBsAg携带者(inactive HBsAg carriers,IHCs),并观察了血清BAFF水平的动态变化,以探讨其对治疗应答的影响,现将研究结果报道如下。
1 资料与方法
1.1 一般资料 2018年1月~2020年8月我院诊治的IHCs 54例,男32例,女22例;年龄为20~55岁,平均年龄为(36.0±8.3)岁。诊断符合《慢性乙型肝炎防治指南》(2015年版)中IHCs的标准[5]。纳入标准:(1)年龄18~65岁;(2)HBsAg阳性超过6个月,血清HBsAg≤1500 IU/mL;(3)血清HBeAg阴性,抗-HBe阳性;(4)血清HBV DNA <20×103IU/ mL;(5)血清ALT和AST正常;(6)既往未接受过抗病毒治疗;(7)Fibroscan行肝脏硬度检测(LSM)<9.0 kPa;(8)上腹部CT或B超检查显示无肝硬化。排除标准:(1)合并严重的心、脑、肺、肾、血液系统等原发性疾病;(2)伴有甲状腺疾病、视网膜病、银屑病、神经性耳聋、精神病或有精神疾病史;(3)失代偿期肝硬化或肿瘤;(4)有酗酒、吸毒史或未能控制的癫痫、糖尿病、高血压和自身免疫性疾病;(5)合并其它嗜肝病毒感染和(或)HIV 感染;(6)妊娠或哺乳期妇女。同时,纳入16例血清HBsAg阴性和HBsAb阳性的健康人群作为对照组,男10例,女6例;年龄为19~51岁,平均年龄为(33.4±9.2)岁。本研究已通过我院医学伦理委员会批准(伦理批号:2018033),所有研究对象入组前均签署了书面知情同意书。
1.2 治疗方法 对入组的IHCs,根据其治疗意愿给予Peg-IFNα-2a(上海罗氏制药有限公司)180μg皮下注射,1次/w或Peg-IFNα-2b(厦门特宝生物工程股份有限公司)180μg皮下注射,1次/w治疗。预期疗程为48 w。所有患者停用Peg-IFN-α后再随访24 w。
1.3 检测与检查 采用PCR法检测血清HBV DNA(罗氏公司);采用化学发光法检测血清HBV 标志物(美国雅培公司);采用ELISA法检测血清BAFF(美国Sigma公司);使用奥林巴斯AU2700 生化仪检测肝功能指标(上海科华生物工程股份有限公司);使用Echosens公司提供的FibroScan 502行LSM检查。
1.4 疗效评估 临床治愈:在72 w时,血清HBsAg< 0.05 IU/ mL,伴或不伴HBsAb ≥10 mIU/ mL,且血清HBV DNA<20 IU/ mL。
2 结果
2.1 基线资料比较 在整个研究过程中,共有2例患者失访,失访时未获得临床治愈。另有2例患者在治疗24周时获得临床治愈,停用Peg-IFN-α并随访至72周。采用意向性治疗分析,在72周时共有24例(44.4%)患者获得了临床治愈,30例患者未获得临床治愈;治愈与未治愈(包括失访)组基线资料比较,除基线HBsAg(p=0.028)和HBVDNA(p=0.035)外,余特征均无显著性差异(P均>0.05,表1)。

表1 两组基线资料比较
2.2 两组血清BAFF水平动态变化比较 在治疗12 w和24 w时,治愈组血清BAFF水平分别为(805.8±197.6)pg/mL和(895.3±227.4)pg/mL,显著高于未治愈组[(675.3±190.8)pg/mL和(724.4±218.0)pg/mL,P均< 0.05,图1],提示在治疗过程中,血清BAFF水平呈逐渐升高的患者可能获得治疗应答。

图1 两组血清BAFF水平(pg/mL)变化的比较
2.3 影响Peg-IFN-α治疗IHCs患者临床治愈的因素分析 以性别、年龄、基线HBsAg定量、HBV DNA定量、ALT水平、BAFF水平、12周时BAFF水平和24周时BAFF水平为自变量,以临床治愈为因变量(临床治愈=1,未治愈=0),进行Logistic回归分析。用性别和年龄作为调整因素,多因素分析结果显示基线HBsAg定量、基线HBV DNA <20 IU/mL、治疗12周时BAFF水平和24周时BAFF水平为影响临床治愈的独立因素(表2)。
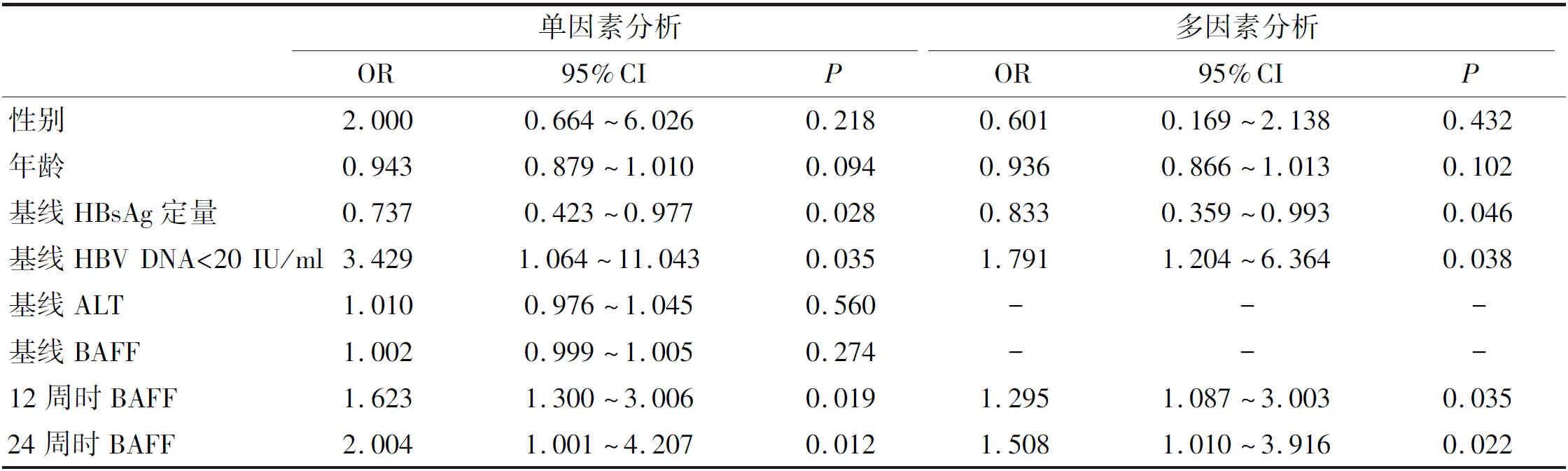
表2 单因素和多因素Logistic回归分析影响临床治愈的因素
2.4 血清BAFF预测临床治愈的效能分析 经ROC分析,Peg-IFN-α治疗12 w时和24 w时血清BAFF水平预测临床治愈的效能见表3。

表3 血清BAFF水平预测临床治愈的ROC分析
3 讨论
IHCs表现为血清HBsAg阳性,HBeAg阴性,抗-HBe阳性,HBV DNA<2.0×103IU/mL,ALT和AST持续正常[6]。一般认为,IHCs处于免疫控制期,疾病进展相对缓慢,预后良好,因而目前的慢性乙型肝炎防治指南暂不推荐对这类患者进行抗病毒治疗[7]。然而,长期的随访研究结果显示大约10%~20%IHCs可能会经历HBV的重新激活,约4%~20%IHCs可能会逆转为HBeAg阳性CHB,约20%~40%IHCs会逆转为HBeAg阴性CHB。当合并其他系统疾病需要使用化疗药物、糖皮质激素等免疫抑制剂治疗时,将会大大增加HBV再激活的风险,病情严重者甚至诱发致命性的肝衰竭[8-10]。在对1932例IHCs进行了长达13年的随访观察发现,IHCs肝病相关死亡风险是HBsAg阴性人群的2.1倍,肝细胞癌(hepatocellular carcinoma,HCC)发生风险是HBsAg阴性人群的4.6倍[11]。HBsAg清除意味着慢性HBV感染的临床治愈,实现HBsAg清除会显著改善慢性HBV感染患者的临床结局,大大降低肝硬化和HCC的发生风险[12, 13]。因此,对IHCs进行积极的治疗以追求临床治愈具有极大的临床意义。
本研究给予54例IHC患者Peg-IFN-α治疗后,获得了高达44.4%的临床治愈率,该研究结果与有关报道[14]结果相一致,表明应用Peg-IFN-α治疗IHCs可实现较高的临床治愈率。Peg-IFN-α具有抗病毒和免疫调节的双重作用,它不仅可以诱导α-干扰素刺激基因的表达而发挥抗病毒作用,还可以活化T淋巴细胞、巨噬细胞、自然杀伤细胞等免疫细胞而增强机体的免疫功能,从而促进HBV的清除[15]。此外,Peg-IFN-α还可以通过诱导脱氨酶载脂蛋白B mRNA编辑酶催化多肽3A的表达而降解HBV的复制模板共价闭合环状DNA,从而彻底清除感染肝细胞内的HBV[16]。
既往研究表明在慢性HCV感染的患者中,血清BAFF水平升高[17]。最近的一项研究表明,与健康对照者相比,CHB患者血清BAFF水平升高,并且血清BAFF水平与慢性肝病的不良临床结局,如肝硬化和HCC的发生相关[18]。本研究发现,与健康对照人群相比,IHCs血清BAFF水平显著升高,该研究结果与既往的研究结果相一致,表明血清BAFF水平可能与慢性病毒性肝炎的发病机制相关[19]。
本研究治愈组与未治愈组患者基线血清BAFF水平无显著性差异,表明基线BAFF水平与Peg-IFN-α治疗应答无关。该结论与有关报道[19]的结论相反,后者发现基线低水平的BAFF可以预测HBeAg阳性CHB患者对Peg-IFN-α治疗的良好应答。这两项研究的研究对象和对Peg-IFN-α应答的定义标准不同可能是导致两个研究结论存在差异的主要原因。本研究还观察到IHCs接受Peg-IFN-α治疗后,血清BAFF水平较治疗前升高,表明Peg-IFN-α治疗可以诱导BAFF的产生。在接受Peg-IFN-α治疗的慢性丙型肝炎患者也有类似的报道[20]。本研究经多因素Logistic回归分析发现在Peg-IFN-α治疗12 w和24 w时血清BAFF水平是预测IHCs临床治愈的指标,表明在Peg-IFN-α治疗过程中,早期监测血清BAFF水平可以指导治疗的进行。进一步经ROC分析发现在Peg-IFN-α治疗12 w时血清BAFF >704.27 pg/mL,或在治疗24 w时血清BAFF>741.94 pg/mL可以较好地预测IHCs的临床治愈。
综上所述,本研究发现应用Peg-IFN-α治疗IHCs可以实现较高的抗病毒应答率。应用Peg-IFN-α治疗可以促使IHCs血清BAFF水平升高,而监测这种升高趋势可以指导治疗的进行。
