肝硬化并发急性肾损伤诊治进展
2022-11-21李佳峥南月敏
韩 芳,李佳峥,南月敏
急性肾损伤(acute kidney injury,AKI)是失代偿期肝硬化腹水患者常见且严重的并发症之一,其发病率达27%~53%[1]。一旦发生AKI,28 d病死率达29%~44%[2,3]。我国学者[4]对1071例肝硬化患者进行回顾性分析发现,AKI发生率为11.1%,Child A级、B级和C级肝硬化人群AKI发生率依次为3.8%、10.9%和27.7%。AKI患者2个月病死率达37.0%。1期、2期和3期AKI患者2个月病死率分别为20.3%、36.0%和73.3%。随着疾病的进展及腹水、感染、出血等并发症的发生,肝硬化患者AKI发生风险呈递增趋势,严重影响患者的生存状况。
1 肝硬化并发AKI的病因及临床分型
有研究报道[5],在126例失代偿期肝硬化患者中,60例发生AKI,累计发生AKI 98例次,其中79例次有明确的诱因。在各种诱因中,28.6%为大量放腹水(> 3 L),其次为自发性细菌腹膜炎(14.3%)或其他部位细菌感染(23.5%)。ICU住院的肝病患者并发AKI的危险因素为:年龄>60岁、糖尿病、高SOFA评分、高APACHE-II评分、有创机械通气(IMV)。中国台湾的一项研究显示,高胆红素血症与增强CT检查后发生AKI有关。所以,对于高胆红素血症患者,行增强CT或者相关的碘剂应用时,需要警惕AKI的发生。诺氟沙星400 mg/d预防治疗可降低肝肾综合征(hepatorenal syndrome,HRS)发生率,延长生存期。
根据病因的不同,可将AKI主要分为肾前性、肾性和肾后性,其中,肾前性AKI较常见,可达58.0%,肾性AKI占比为41.7%,而肾后性AKI占比为0.3%(表1)。
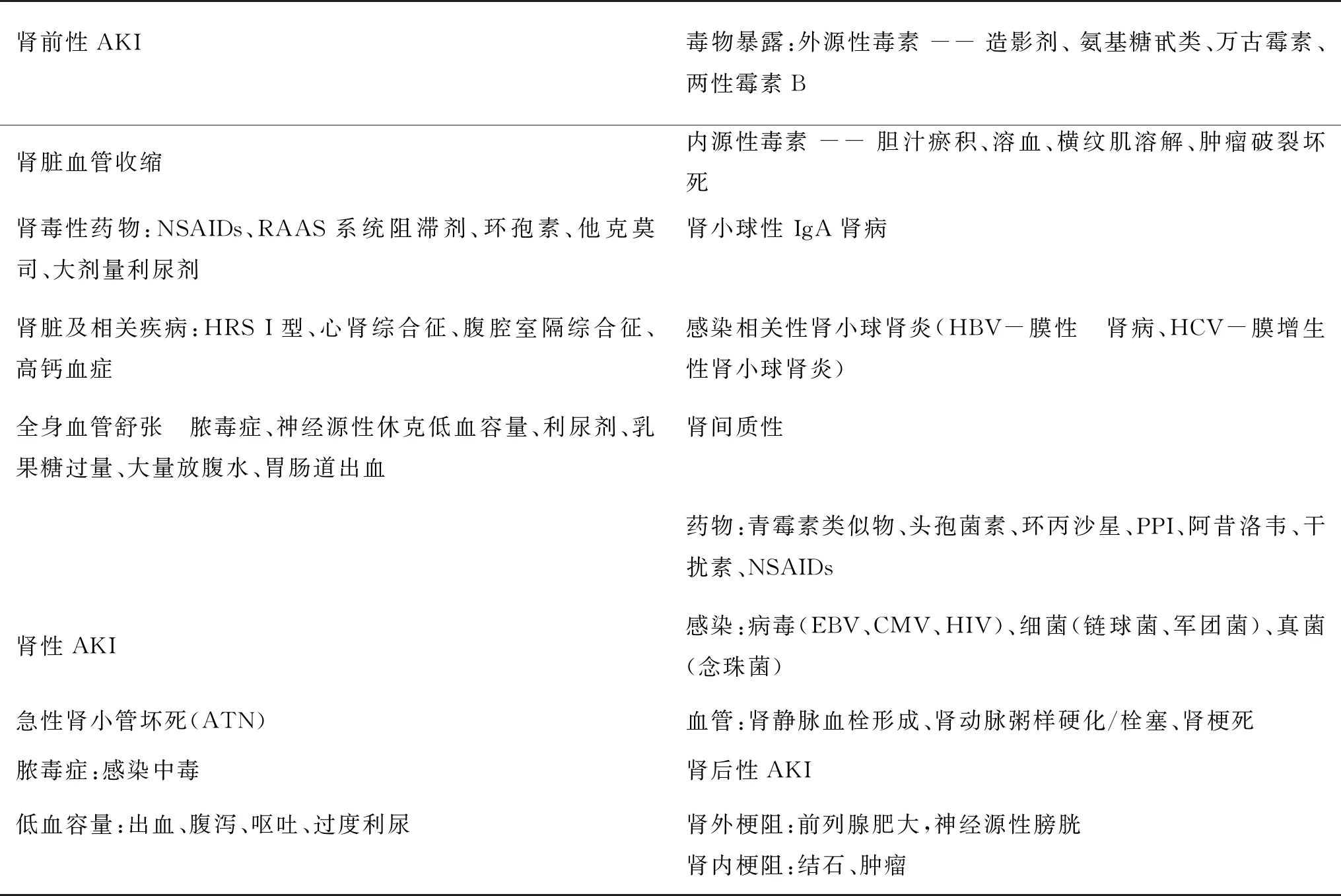
表1 肝硬化并发AKI的病因及临床分型
2 肝硬化并发AKI的病理生理学发生机制
由于肝硬化患者门静脉高压和高动力循环的存在,内脏动脉扩张加重,有效循环血容量减少,反射性激活肾素-血管紧张素-醛固酮系统,心输出量不足。同时,由于肝脏炎症、肠道菌群移位和并发感染,导致大量炎症因子释放和内毒素血症,引起肾脏微循环功能障碍,诱发肾功能损伤[6](图1)。
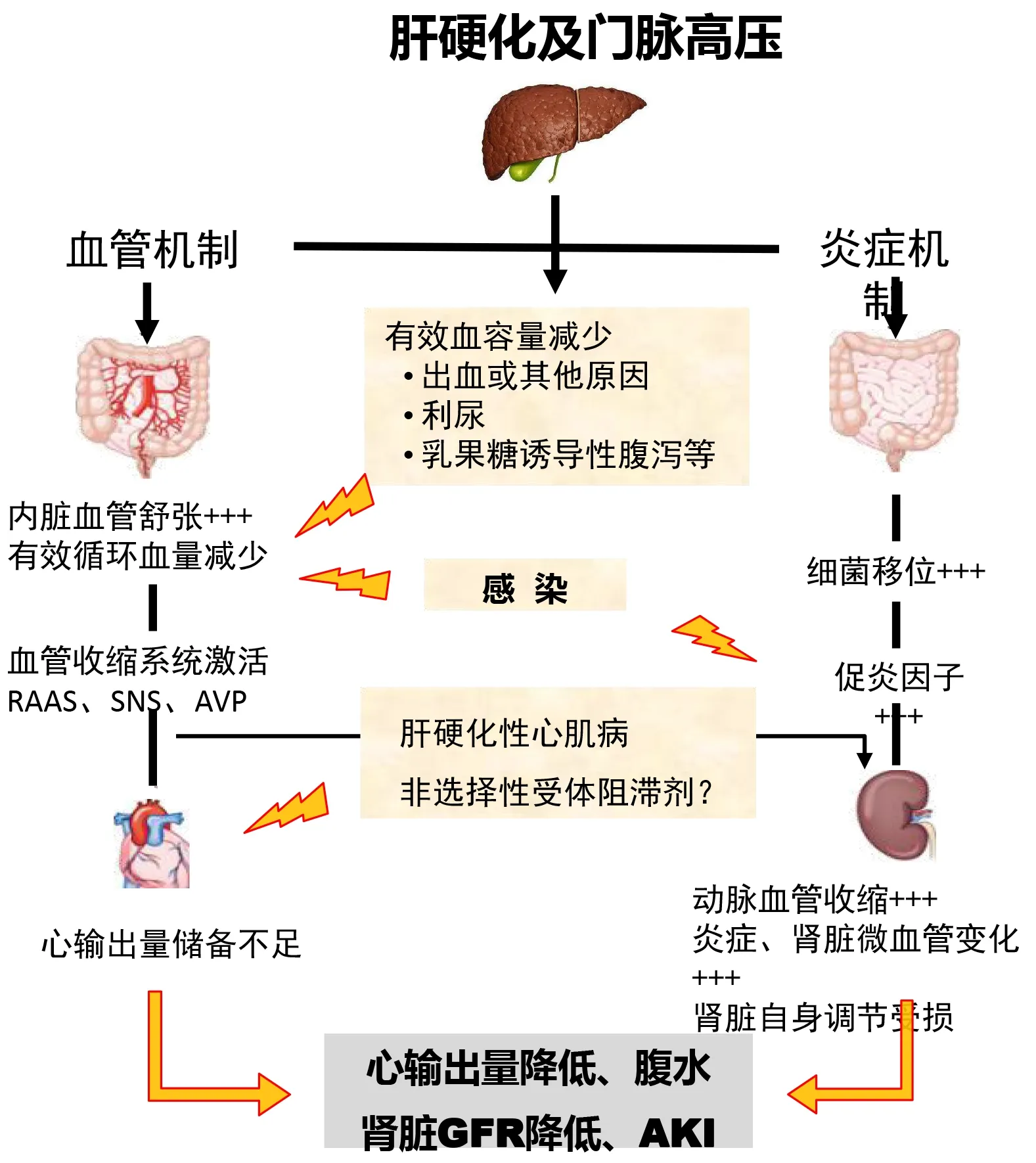
图1 肝硬化并发AKI的病理生理发生机制
3 肝硬化并发AKI的诊断
肝硬化患者48 h内血清肌酐(serum creatinine, sCr)升高≥ 0.3 mg/dL (26.5 μmol/L)或7 d内sCr升高≥基线值50%,和/或尿量≤ 0.5 mL/kg/h持续≥ 6 h,即可诊断AKI。
国际上,有多个学术组织对AKI提出了诊断建议和临床分期标准。2002年国际急性透析质量指导组(acute dialysis quality initiative,ADQI)提出急性肾衰竭的RIFLE标准,2004年ADQI联合相关协会提出AKI的概念,2005年急性肾脏损伤网络(acute kidney injury network,AKIN)专家组提出以血肌酐和尿量进行AKI分期;2021年改善全球肾脏病预后组织(kidney disease: improving global outcome, KIDGO)以血肌酐和尿量及估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)作为AKI的分期标准。2015年以来,国际腹水俱乐部(international club of ascites,ICA)提出以血清肌酐水平分期[7],至今被欧洲、美国和中国指南采用。
肝肾综合征被分为两型,1型为急进型(HRS-AKI),2型为缓进型、非AKI(HRS -NAKI)。HRS-AKI诊断要点如下[7]:①肝硬化伴腹水;②符合AKI确诊标准: 48 h内sCr上升≥ 0.3 mg/dL (26.5 μmol/L)或7 d内sCr升高≥基线值50%;③连续停用利尿剂并输注白蛋白(1 g.kg-1)扩容后,48 h内无应答;④无休克;⑤近期未使用过肾毒性药物,如非甾体类抗炎药、氨基糖苷类、碘化造影剂等;⑥无肾实质病变的表现,无蛋白尿(< 500 mg/d)及微量血尿(< 50个红细胞/高倍视野),肾脏超声检查正常(表2)。

表2 KDIGO和ICA 的AKI分期诊断标准
4 肝硬化并发AKI的治疗
早期识别和早期干预,预防AKI进展是挽救肝硬化并发AKI进展的重要策略,包括纠正AKI的可逆性因素,如低血容量、感染、心功能不全、肾毒性药物和尿路梗阻等。2021年《AASLD腹水和肝肾综合征诊断、评估和管理指南》[8]建议:一旦诊断为AKI,应立即查找诱因并予以治疗。相关危险因素包括体液流失、细菌感染、血流动力学不稳定和潜在的肾毒性药物,如非甾体抗炎药;低血容量引起的急性肾损伤,应采取液体替代治疗,纠正导致血容量不足的原因并停用利尿剂。
针对HRS-AKI的药物治疗方案为及早应用血管收缩剂,首选特利加压素。对于不可及或不能耐受者,可考虑应用去甲肾上腺素,并联合应用白蛋白。特利加压素的用法:1~2 mg微量泵泵入或缓慢静脉输注,每4~6 h,最大用量为12 mg.d-1。特利加压素/去甲肾上腺素治疗应答的定义为,治疗14 d内血清肌酐水平降至< 1.5 mg/dL,或恢复至较基线水平升高< 0.3 mg/dL。如予以最大可耐受剂量的血管收缩剂治疗> 4 d,血清肌酐水平无明显改善或仍然升高,需停止治疗。应用血管收缩剂联合白蛋白期间应密切监测药物不良反应,包括缺血相关并发症和肺水肿等。若血管收缩剂不可用,可口服米多君(5~15 mg,q8h)、静脉泵入奥曲肽(100~200 μg,q8h或50 μg.h-1静脉泵入),但有效性较差[8]。HRS-AKI患者在治疗中止后可能病情复发,可再次启动相同方案治疗。一项纳入12个随机对照研究,包括700例AKI/HRS患者的Meta分析显示[9],通过对特利加压素联合白蛋白(特利加压素起始剂量为1 mg,之后为1~2 mg/4~6 h,最大剂量为12 mg.d-1,白蛋白 20~40 g.d-1)与白蛋白联合安慰剂对比发现,特利加压素联合白蛋白能更好地逆转HRS、减少CRRT的使用。研究显示[10],给予特利加压素联合白蛋白持续微量泵静脉给药与间断静脉输注的疗效无显著性差异,但前者不良反应明显减少。
4.1 药物治疗疗效评估 逆转AKI患者1期以上为治疗有效;AKI进展1期以上或需要CRRT为疾病进展;AKI未恢复属于无应答;AKI分期下降,sCr降低至≥基线值0.3 mg/dL(26.5μmol/L)为部分应答;sCr降低至基线值<0.3 mg/dL(26.5 μmol/L)为完全应答[5,9]。
关于应用TIPS治疗HRS-AKI仍有争议。 一项纳入128例经TIPS治疗的HRS患者,结果显示,I型HRS短期(30 d)和1 a生存率分别为72%和47%,肾功能改善率为93%,TIPS可有效降低sCr;对于Ⅱ型HRS患者,短期和1 a生存率为86%和64%,肾功能改善率为83%,TIPS可有效逆转II型HRS、改善生存率,血清肌酐、血尿素氮、血清钠、钠排泄和尿量均有明显改善,未观察到与死亡相关的并发症。鉴于以往发表的相关研究不属于大型对照研究,2021年美国肝病学会指南[6]不建议行TIPS治疗,HRS-AKI患者究竟能否从TIPS中获益,仍有待经验积累和临床探索。
4.2 肝硬化并发AKI合并SBP的治疗 EASL发布的肝硬化腹水、SBP和HRS指南[12]强调联合、尽早治疗,立即寻找病原体,同时开始经验性抗生素治疗,首选三代头孢菌素,如头孢噻肟 2 g,q12h,连续5 d;白蛋白1.5 g.kg-1×2 d,第3天为1 g.kg-1;也可以应用特利加压素和去甲肾上腺素。
针对经上述治疗无应答者,应考虑肾小管损伤(acute tubular necrosis,ATN)或其他因素,各种病因引起的肾组织缺血/中毒性损害致使肾小管上皮细胞损伤/坏死,患者可表现为GFR急剧降低、进行性氮质血症、水电解质和酸碱平衡失调、肺水肿、高钾血症,其中,肺水肿和高钾血症为死亡的主要原因。治疗措施:①积极纠正水电解质和酸碱平衡紊乱(补充碳酸氢钠,纠正酸中毒);②去除病因和诱发因素;③及时合理行CRRT治疗;⑤避免使用肾毒性药物,积极控制感染。
CRRT可用于肾功能恶化、电解质紊乱、对血管收缩剂反应较差、容量高负荷的肝移植候选者。非肝移植患者行CRRT治疗,需做出明确治疗终点。即使肝硬化并发AKI患者获得治疗应答,鉴于短期内病死率较高,应行紧急肝移植评估。对于内科治疗无应答的AKI患者,肝移植时间应< 5周;等待时间> 6周者,可考虑肝肾联合移植[6,8]。
综上所述,AKI是肝硬化常见的严重并发症,扩容和停用利尿剂可逆转低血容量性肾前性AKI。对于HRS-AKI患者,需要及早应用特利加压素联合白蛋白治疗。TIPS的疗效有待研究。对内科综合治疗效果差者,可行CRRT治疗,必要时行肝移植/肝肾联合移植。
