肝硬化并发急性肾损伤临床管理现状与挑战
2022-11-21蒋莹莹丁惠国
蒋莹莹,丁惠国
肾损伤是肝硬化常见的并发症或合并症之一,与患者的预后密切相关。传统上,将血清肌酐(serum creatinine,sCr)≥1.5 mg/dl定义为肾功能障碍,作为1型和2型肝肾综合征诊断的重要依据,其局限性在于肝硬化患者早期肾功能损伤易被漏诊,且器质性肾损伤或慢性肾病患者不能正确地归类。近年来,根据肾功能受损时间长短,将其分为急性肾损伤(acute kidney injury, AKI)、亚急性(即急性肾脏病,acute kidney diseases,AKD)和慢性肾脏病(chronic kidney disease,CKD)[1],包括了功能性和器质性肾损伤。按照肝硬化并发肾损伤的新概念,肝肾综合征(hepatorenal syndrome,HRS)的病理生理特征不仅包括内脏血管扩张,肾血流量减少所致的功能性肾功能障碍,还包括了全身炎症反应等所致的器质性肾损伤。基于这些理论,认为HRS纯粹是一种“功能性”肾功能衰竭的观点是不可靠的,这一概念对于指导肝硬化并发肾损伤的治疗和预后评估具有重要的临床意义。
1 AKI
广义的AKI指严重肝病患者入院48 h内因各种原因导致的急性功能性和急性器质性肾损伤。2015年国际腹水俱乐部(ICA)制定了肝硬化并发AKI诊断、分期和治疗效果的评判标准(表1)[2],其与KDIGO标准基本一致[3]。新版标准将肝硬化并发AKI定义为48 h内血清sCr增加≥0.3 mg/dl(26.5μmol/L),或7 d内血清sCr水平升高超过基线值的50%。sCr基线定义为近3月内任何一次sCr检测值,以便于肝硬化并发AKI早期诊断与管理。AKI新定义也适合急性肝衰竭或慢加急性肝衰竭患者。
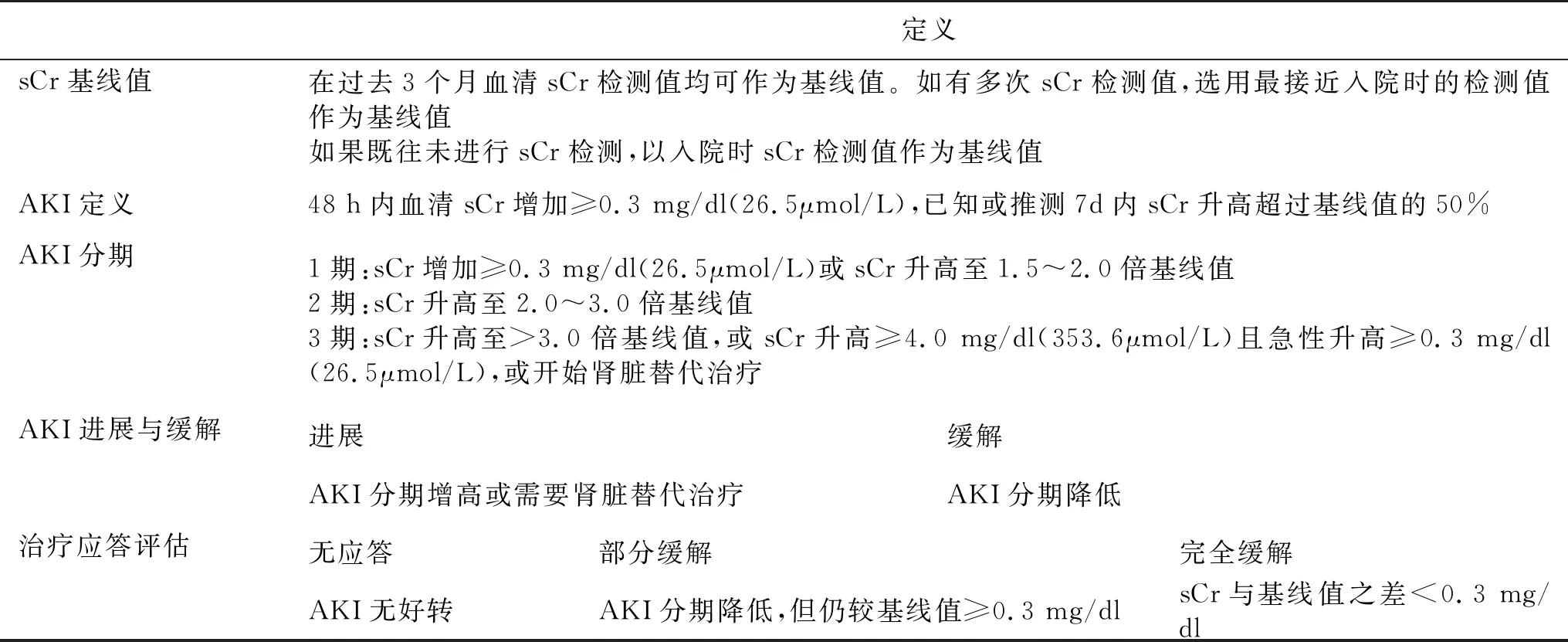
表1 2015年国际腹水俱乐部对肝硬化并发AKI患者诊断与管理标准[2]
在肝硬化患者,AKI发病率约为12%~50%[1, 4-7]。有肝硬化相关并发症,如感染、腹水、肝性脑病等的患者AKI发生率更高,严重影响肝硬化患者的预后。AKI可以使肝硬化患者短期(30 d)病死率增加近10倍[8],3 m病死率高达28%~47%[9-12]。AKI也与肝移植后的高短期病死率和不良预后显著相关[13]。
肝硬化并发AKI的初始治疗重点在于早期识别并去除诱因,防止血流动力学进一步恶化。对于容量不足的患者,应减量或停止利尿剂治疗,酌情使用白蛋白扩容;如并发上消化道出血,应积极按照上消化道出血常规进行处理;如确诊或强烈怀疑感染,应尽快明确感染部位,基于病原学及其耐药情况,早期经验性使用抗生素治疗[14];如怀疑药物性肾损伤,应仔细寻找潜在的肾损害药物,如非甾体类抗炎药以及可能引起或加重低血压的药物,如血管扩张剂或非选择性β受体阻滞剂,并及时停用[15]。对于AKI患者,经治疗获得完全缓解后,应密切进行随访,以便早期发现AKI复发并及时评估是否进展为CKD[7]。
2 AKD与CKD
KDIGO指南针对AKD与CKD的定义是基于肾小球滤过率(GFR)。在GFR<60 ml/min/1.72m2持续异常90 d内,又不符合AKI的标准被定义为AKD;持续>90 d功能性或器质性肾功能异常(GFR<60 ml/min/1.72m2)被定义为CKD。
AKD大多数是AKI持续发展的结果,可能是AKI和CKD之间的过渡阶段。研究显示,约1/3 AKI患者可进展为AKD,而在AKD患者中新发CKD的发生率高达64%[16]。在AKI患者中,CKD、肥胖、腹水、AKI高分期、社区获得性AKI和低血清白蛋白患者,AKD发生率更高[16]。早期识别AKD发生的高危因素并提前干预窗口,以减少AKD患者进展为CKD的发生,改善患者预后。
3 HRS
HRS是以肝硬化门脉高压血流动力学紊乱和内脏血管扩张为病理生理特征的功能性肾损伤,但可以发生在CKD和AKD基础上,或肝功能衰竭患者[17]。
传统观点的HRS被分为1型HRS和2型HRS,其局限性在于肝硬化患者早期肾功能损伤被漏诊,且器质性肾损伤或CKD患者不能正确地归类。2019年ICA更改了HRS的分类,将1型HRS更名为HRS-AKI,而将2型HRS更名为肝肾综合征-非急性肾损伤(hepatorenal syndrome-nonacute kidney disease,HRS-NAKI),其诊断标准见表2。新的诊断标准将HRS诊断范围进一步扩大,包括急性肝衰竭和慢加急性肝衰竭患者。

表2 HRS分型的新定义[17]
根据新版诊断标准,HRS的确诊和开始药物治疗不再需要具体的sCr值。与传统的1型HRS、2型HRS概念和诊断标准相比较,新版HRS分型不仅有助于诊断叠加在HRS-CKD或HRS-AKD上的HRS-AKI,而且有助于理解在肾脏结构损伤患者中也可以发生HRS-AKI,即叠加在CKD存在基础上的HRS-AKI。
临床上一旦诊断HRS,应立即开始使用血管收缩剂(血管加压素及其类似物、α-肾上腺素能受体激动剂、生长抑素类似物等)联合人血白蛋白治疗。特利加压素是治疗HRS研究最深入的血管收缩剂。研究结果显示,特利加压素能改善40%~50%HRS患者的肾功能,但是2型HRS(现称HRS-NAKI)复发率却显著高于1型HRS(现称HRS-AKI)[18, 19]。根据对肝硬化肾脏病理损伤的新认识,我们考虑HRS-NAKI复发率高于HRS-AKI可能的原因是HRS-NAKI可能存在器质性肾损伤,但需要进一步研究证实。
另外一个需要注意的问题是,在使用血管收缩剂联合人血白蛋白治疗HRS时,白蛋白的用法用量值得深思。目前,关于血管收缩剂联合人血白蛋白扩容时,国内指南推荐白蛋白常用剂量为20~40 g.d-1。在一项关于“白蛋白治疗对失代偿期肝硬化患者全身和门脉血流动力学及全身炎症的影响”的研究结果显示,长期(12 w)大剂量白蛋白(1.5 g.kg-1每周一次)能显著改善失代偿期肝硬化循环稳定性和左心室功能,降低血浆细胞因子水平,而对门静脉压无明显影响[20]。迄今为止,大剂量白蛋白治疗HRS患者的疗效和安全性尚未得到评估。
TIPS可以改善严重/难治性腹水患者的肾功能和生存率,对HRS-NAKI患者有较好疗效。但是,对于MELD评分较高(>15分)的患者,可能无法从TIPS治疗中获益,应谨慎选择[21],尽快完善肝移植评估。肾替代治疗并不能改善HRS患者的预后[22],仅用于HRS并发严重高钾血症、代谢性酸中毒、容量超负荷时需要肾脏替代治疗时的抢救治疗[23]。
4 肝硬化并发AKI临床面临的挑战
4.1 HRS-AKI与急性肾小管坏死(acute tubular necrosis,ATN)鉴别 大多数肾前性AKI可以通过扩张血浆容量而得到纠正,而肾后性AKI少见。目前,临床上真正的挑战是区分HRS-AKI与ATN-AKI。早期区分HRS-AKI与ATN-AKI,对于及时调整治疗方案、改善患者预后至关重要。经典的尿液生物标志物,如尿钠浓度或钠排泄分数,容易受应用利尿剂的影响,因此在肝硬化患者鉴别AKI与ATN的作用有限。新的生物标志物,如中性粒细胞明胶酶相关脂质沉积蛋白(neutrophil gelatinase-associated lipocalin, NGAL)、N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D-glucosaminidase, NAG)、IL-18、肾损伤分子1(kidney injury molecule 1, KIM-1)等,已被证明有可能能区分肝硬化患者ATN与AKI[24-27]。研究显示,NGAL对ATN-AKI与非ATN-AKI的鉴别诊断具有最高的准确性(AUC=0.87)。NGAL不仅是AKI进展的独立预测因素,也是28 d病死率的独立预测因子[9]。尽管这些新型标志物在鉴别AKI类型中展示出广阔的应用前景,但是仍需要多中心、大样本的临床研究加以验证。
4.2 AKI与CKD的“相爱相杀” 在普通人群中,既往无肾脏疾病的AKI患者有发展为CKD的风险。相反,CKD患者也存在发生AKI的致病因素,如感染、休克等。不管是AKI或是CKD或两者重叠都会显著增加死亡风险[28]。研究显示,肝硬化本身不仅是AKI的危险因素,也是CKD的易感因素[29],特别是乙型肝炎肝硬化和非酒精性脂肪性肝炎(NASH)相关肝硬化患者有较高的CKD发生率,约为3%~4%[30-32]。在肝硬化人群中,严重的AKI和/或反复发作的AKI患者发生CKD的风险更高[33]。尽管肝硬化人群中AKI与CKD之间序贯或重叠的临床特征及其精准预测研究有限,但已有研究显示肝硬化并发AKI患者中约25%~33%可以发展为CKD,而高达75%CKD患者有进一步发生AKI的风险[29, 34]。
5 小结
肾损伤是肝硬化、急性肝衰竭、慢加急性肝衰竭患者最主要的死亡原因。肝硬化肾损伤的新分类、新概念和新诊断标准对于指导临床早期识别肝硬化肾损伤高风险人群、早期诊断、药物治疗和预后判断具有重要的临床意义。但是,这些新理念及其大多数来自欧美以酒精性肝硬化为主的国家或地区。在我国临床实践中,肝硬化肾损伤新分类及新诊断标准仍需要进一步验证。
