北京鸭、连城白鸭及其杂交F5资源群体骨骼肌发育差异的研究
2022-11-21李东锋葛建雅王浩彬何宗亮金通于敏莉
李东锋,葛建雅,王浩彬,何宗亮,金通,于敏莉*
(1.南京农业大学动物科技学院,江苏 南京 210095;2. 南京市畜牧家禽科学研究所,江苏 南京 210036; 3.南京农业大学淮安研究院,江苏 淮安 223005)
我国是水禽生产和消费大国,鸭肉产量占世界70%。鸭肉中脂肪酸熔点低,不饱和脂肪酸多,含有丰富的B族维生素和烟酸,因其口感好、肉质鲜美,倍受青睐。我国养鸭的历史悠久,发展速度快,拥有优良的地方品种资源[1]。家禽的产肉性能是衡量其经济价值的重要指标,当代家禽养殖业在追求缩短饲养周期的同时,也为改善肉品质做着不懈努力[2]。
北京鸭是我国优良的本地品种,经系统选育形成专门育肥的肉用型鸭种,其生产性能如生长速度、饲料转化率和瘦肉率等指标均已达到世界先进水平。但是其为大体型肉鸭品种,存在脂肪沉积速度快、皮脂率高、胸及腿肌率低等不足;且其品质较差,仅适用于制作烤鸭或分割鸭,不能满足人们对肉鸭品质的不断需求。连城白鸭是我国稀有的地方水禽种质资源之一,以“白羽、乌喙和青脚”的性状而著称[1]。因该鸭体型小、生长速度慢,利用其为肉鸭生产成本高,不利于大规模推广。因此,通过杂交选育小体型优质肉鸭新品种(系)在我国肉鸭市场具有十分广阔的前景。为了满足市场需求,充分挖掘连城白鸭的品种资源优势和全面改良连城白鸭的生长速度和饲料转化率,以优质地方鸭种连城白鸭(母本)和快大型肉鸭北京鸭(父本)为育种素材应用杂交、多代横交技术和群体继代选育方法,经过5个世代的选育,F5资源群体的表观性状稳定,生长速度提高,肉质性状良好。
肌纤维特性是影响肉品质的重要因素,肌纤维直径与肌肉嫩度负相关,肌纤维密度与肌肉嫩度正相关[3]。在实际育种过程中,育种者大多致力于提高营养水平和肌肉产量来提高生产效率[4]。胚胎期是决定家禽生长发育的重要时期,遗传物质和营养环境共同决定子代生长发育的表型[5-6]。禽类的肌纤维类型和数量在胚胎期就已确定,出壳后肌肉的增加主要依赖于肌纤维的肥大和增长[7-8]。研究发现,动物骨骼肌组织的发育受众多信号通路和转录因子的共同调控,且在品种间表现出明显的差异[7]。目前,鸭骨骼肌发育在品种间差异及形成机制的研究较少,有待于进一步探究。
已有研究表明DNA 甲基化可参与调控肌肉组织的发育过程[9],进一步探究骨骼肌发育与DNA甲基化的关系,有利于了解骨骼肌发生过程中关键基因的修饰作用。基因组DNA甲基化对成肌细胞的程序建立有重要的作用,肌源干细胞中的低甲基化区域与增强子型染色质相邻,表明DNA甲基化参与了细胞特异性增强子的调控[9]。目前已明确了生肌决定因子(Myf5)超增强子的低甲基化和上游刺激因子1(Usf1)与Myf5超增强子结合均发生在肌源性干细胞的DNA去甲基化过程中[10]。以往研究表明,DNA甲基化对骨骼肌的发育有重要的调控作用,而DNA甲基化的差异是否影响不同品种鸭骨骼肌的发育和肌纤维特性的形成,仍未可知。
胚胎期骨骼肌发育对成体的产肉性能和肉品质有巨大的潜在影响[11]。研究发现,骨骼肌的发育受众多信号通路和转录因子的共同调控,且在品种间表现出明显的差异。目前,有关鸭骨骼肌发育在品种间的差异及其形成机制的研究较少且结论尚不明确。本研究以北京鸭、连城白鸭和杂交F5资源群体胸肌和腿肌为研究对象,从肌纤维特性、成肌发育相关基因的表达模式以及基因组甲基化水平变化情况,探讨不同品种鸭骨骼肌发育的差异,从而为优质肉鸭的生产实践提供理论依据。
1 材料与方法
1.1 试验动物及样品采集
本试验所用鸭胚和成年鸭均来自南京市畜牧家禽科学研究所的种鸭群。在相同的日粮水平和饲养条件下,分别收集大小均匀的北京鸭、连城白鸭和杂交F5资源群体的种蛋各200枚进行统一孵化。入孵后24 h设为1胚龄(embryonic day,E1),分别于14、21、28胚龄(E14、E21、E28)和7周龄(7W)进行采样。每个时期采集30个雄性个体的胸肌、腿肌,将鸭胚取出后称重,剥下两侧的胸肌和腿肌称重,再将一侧肌肉组织立即放入4%多聚甲醛溶液中固定后用于制作石蜡切片,另一侧肌肉置于液氮中速冻,用于提取DNA和RNA及后续指标的检测。
1.2 胸肌率和腿肌率的计算
根据肌肉组织和胚重计算胚胎期胸肌率和腿肌率。胚胎期,胸肌率=胸肌重/胚重×100%;腿肌率=腿肌重/胚重×100%;7W,鸭全净膛率、胸肌重、胸肌率、腿肌重、腿肌率的测定方法参照《家禽生产性能名词术语和度量统计方法:NY/T 823—2004》进行。胸肌率=胸肌重/全净膛重×100%;腿肌率=腿肌重/全净膛重×100%。
1.3 肌纤维组织学测定
将收集的骨骼肌样品制作石蜡切片并进行HE染色。每张切片随机选取3个视野较好的区域进行图像采集,对北京鸭、连城白鸭和F5资源群体胚胎期骨骼肌组织进行细胞核密度指标的统计,对E28、7W北京鸭和F5资源群体的骨骼肌组织进行肌纤维密度(MFN)、肌纤维直径(MFD)和肌纤维横截面积(CSA)等指标的统计。用Image-Pro Plus 6.0软件分析肌纤维密度、肌纤维直径和横切面积。
1.4 实时荧光定量PCR(qPCR)
采用Trizol试剂提取总RNA,用15 g·L-1琼脂糖凝胶电泳和紫外分光光度计分别检测RNA样品质量和浓度。取2 μg总RNA,反转录(RT)为cDNA。qPCR扩增采用SYBR GreenⅠ法。反应体系:2×SYBR Green Realtime PCR Master Mix 10 μL,上、下游引物各0.4 μL(10 μmol·L-1),cDNA模板 2 μL,50×Rox Reference Dye 0.4 μL,加ddH2O 6.8 μL。反应条件:95 ℃ 2 min;95 ℃ 20 s,60 ℃ 20 s,72 ℃ 60 s,共35个循环;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s。每次反应均设空白样品为阴性对照,设置3个重复。引物序列见表1。

表1 引物信息Table 1 Primer information
1.5 DNA的dot blot检测
酚/氯仿法提取肌肉组织基因组DNA,将DNA浓度调至300 ng·μL-1。在尼龙膜上标记并按浓度梯度点样,室温干燥后,在紫外交联仪上交联10 min,紫外光参数设置为1 200 J·cm-2。将尼龙膜放入含5% BSA的TBST溶液中室温封闭1 h,置于一抗[5-羟甲基胞嘧啶(5hmC)抗体,1∶1 000]稀释液中,4 ℃孵育过夜。加入含5% BSA的TBST稀释的二抗(1∶5 000)稀释液中室温孵育2 h,将尼龙膜与ECL显色液充分接触 1 min 后,暗室显影并拍照检测。
1.6 数据处理及统计分析

2 结果与分析
2.1 北京鸭、连城白鸭和F5资源群体骨骼肌质量分析
胚胎期,不同品种鸭胸肌、腿肌组织的质量差异如图1所示。在鸭胚胎发育过程中,北京鸭(P)胸、腿肌肉组织质量都显著高于连城白鸭(L)和F5资源群体(H)的肌肉重(P<0.05)(图1)。E21后,F5资源群体的胸肌重均显著高于连城白鸭(P<0.05),而两者间的腿肌重则无显著差异(P>0.05)。北京鸭和连城白鸭的胸肌率随着胚龄的增加而降低,表明胸肌在胚胎后期发育相对缓慢;而F5资源群体在E21胸肌率上升随后下降。在E21,F5资源群体胸肌率和腿肌率均显著高于连城白鸭(P<0.05)。

图1 14、21、28胚龄(E14、E21、E28)和7周龄(7W)北京鸭(P)、连城白鸭(L) 和F5资源群体(H)的胸肌重、腿肌重Fig.1 The weight of pectoral muscle and leg muscle of Peking ducks(P),Liancheng white ducks(L) and hybrid F5 populations(H)at 14,21,28 embryo old(E14,E21,E28)and 7 weeks old在各时间点不同品种间不同小写字母表示差异显著(P<0.05)。下同。The different small letters indicate significant difference in different varieties at each time point(P<0.05). The same below.
在达到上市日龄(7W)时,北京鸭和F5资源群体的胸肌重、腿肌重、胸肌率和腿肌率差异显著(图1)。而在7周龄时,连城白鸭体重较轻,远未达到上市标准,本试验未做相关指标检测。北京鸭的胸肌重和腿肌重均显著高于F5资源群体;北京鸭胸肌比腿肌重,而F5资源群体腿肌比胸肌重(P<0.05)。北京鸭的胸肌率显著高于F5资源群体的胸肌率,而腿肌率显著低于F5资源群体(P<0.05)。
2.2 北京鸭、连城白鸭和F5资源群体的肌纤维特性比较
北京鸭、连城白鸭和F5资源群体胸肌、腿肌组织在胚胎期的肌纤维形态变化见图2。胸肌、腿肌的细胞核密度变化趋势一致,肌细胞核密度随着胚龄的增加而逐渐降低;在E14时,北京鸭胸肌细胞核密度显著高于连城鸭和F5资源群体;腿肌的细胞核密度在E14时未表现出品种间的差异。在E28时,北京鸭胸肌和腿肌细胞核密度均显著高于连城白鸭和F5资源群体(P<0.05)。

图2 北京鸭(P)、连城白鸭(L)和F5资源群体(H)胚胎期鸭骨骼肌肌纤维 切片图(A、B)(HE染色)及肌纤维细胞核密度分析(C、D)Fig.2 Analysis of muscle fiber(A,B)(HE staining)and nuclear density analysis(C,D)of duck skeletal muscle in embryonic stages of Peking ducks(P),Liancheng white ducks(L)and hybrid F5 populations(H)
7周龄时,北京鸭和F5资源群体的胸肌和腿肌肌纤维特性比较如图3所示。单位面积内胸肌肌纤维数量比腿肌肌纤维数量多,且单个胸肌肌纤维横截面积(CSA)比腿肌肌纤维的小;单位面积内北京鸭胸肌、腿肌肌纤维数量比F5资源群体的少,而北京鸭胸肌、腿肌肌纤维CSA比F5资源群体的大。比较E28和7W北京鸭和F5资源群体的胸肌和腿肌肌纤维CSA、肌纤维密度(MFN)和肌纤维直径(MFD)的差异,结果显示MFN随着MFD的增加而降低,呈负相关;CSA随MFD的增加而变大,呈正相关。腿肌组织的CSA和MFD均大于胸肌组织,腿肌MFN则显著小于胸肌MFN(P<0.05)。北京鸭胸肌组织的MFD和CSA高于F5资源群体,但仅在7W表现出品种间的显著差异(P<0.05);7W时北京鸭胸肌MFN显著低于F5资源群体(P<0.05)。北京鸭腿肌MFD和CSA在E28和7W均显著高于F5资源群体(P<0.05);F5资源群体MFN显著高于北京鸭(P<0.05)。
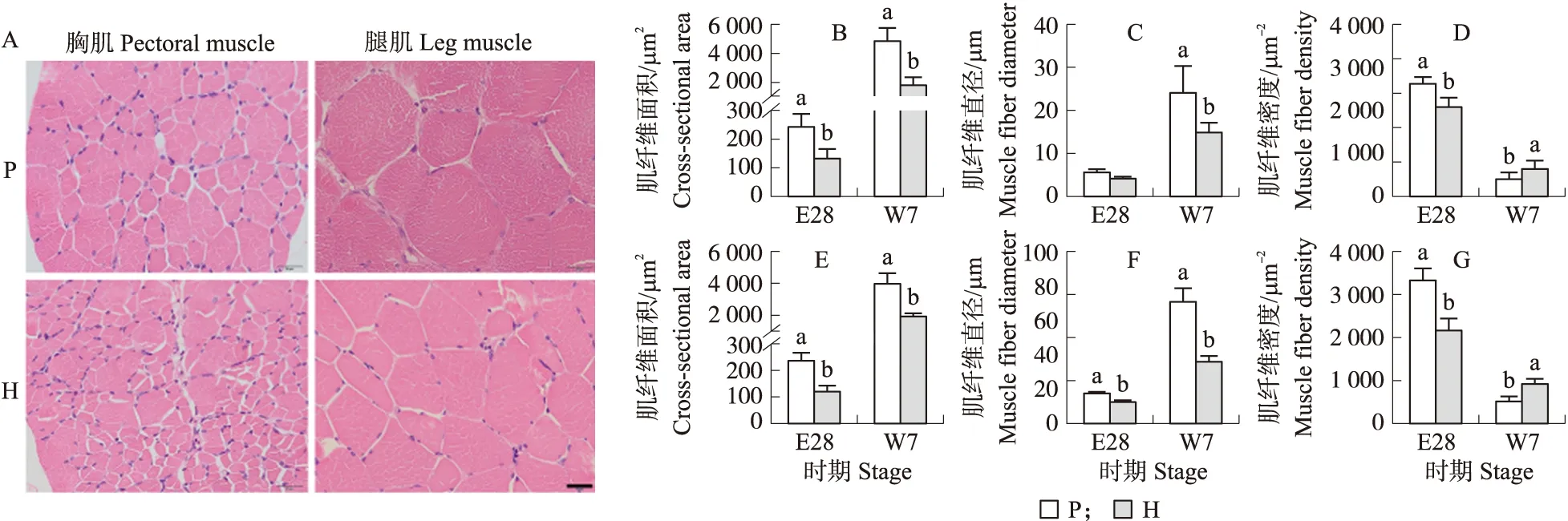
图3 7周龄北京鸭和F5资源群体的胸肌和腿肌组织切片及肌纤维特性分析Fig.3 Cross sections of pectoral muscle and leg muscle of 7W Peking ducks and hybrid F5 populationsA. 切片HE染色图Pictures of HE staining;B-D. 胸肌肌纤维面积、直径和密度分析Analysis of cross-sectional area,diameter and density of pectoral muscle fiber. E-G. 腿肌肌纤维面积、直径和密度分析Analysis of cross-sectional area,diameter and density of leg muscle fiber.
2.3 北京鸭、连城白鸭和F5资源群体肌肉发育相关基因mRNA的表达
采用RT-qPCR检测胚胎期北京鸭、连城白鸭和F5资源群体的胸肌和腿肌中Pax7、MRF和MyHCmRNA表达水平。结果(图4)显示:在3组鸭胸肌组织中,Pax7 mRNA表达水平在E14时差异不显著(P>0.05);E28连城白鸭的胸肌Pax7表达水平显著低于北京鸭和F5资源群体(P<0.05)。F5资源群体胸肌中Pax7表达水平随胚龄的增加而显著增加,在E28其表达水平接近北京鸭的表达水平。Myf5和MyoD的表达水平在3组鸭的胸肌组织中均在E21时达到高峰,且F5资源群体胸肌中Myf5和MyoD的表达水平显著高于北京鸭和连城白鸭(P<0.05)。在E28,Mrf4连城白鸭胸肌中表达水平较高(P<0.05)。在E14,北京鸭胸肌中MyoG表达水平最高,随后在胚胎发育过程中持续下降。MyHCmRNA表达水平在3个品种鸭的胸肌组织中先升高再降低,在E21时表达量最高,且F5资源群体胸肌MyHC表达水平显著高于北京鸭和连城白鸭(P<0.05)。

图4 胚胎期北京鸭(P)、连城白鸭(L)和F5资源群体(H)胸肌(PM)和腿肌(LM)组织中 成肌发育相关基因mRNA的表达Fig.4 mRNA expression of myogenetic genes in pectoral muscle(PM)and leg muscle(LM)of Peking ducks(P), Liancheng white ducks(L)and hybrid F5 populations(H)at embryonic stages
在胚胎期腿肌中,北京鸭腿肌中Pax7表达水平在E14和E21显著高于F5资源群体(P<0.05)。Myf5在E21和E28北京鸭腿肌中的表达水平显著高于连城白鸭和F5资源群体(P<0.05)。在E28,MyoD在连城白鸭中有较高的表达水平,显著高于北京鸭和F5资源群体(P<0.05)。Mrf4的表达水平在E28表现出最大值,且连城白鸭腿肌Mrf4的表达水平显著高于F5资源群体和北京鸭(P<0.05)。在E21,北京鸭腿肌MyoG达最高的表达水平,显著高于其他2组(P<0.05)。北京鸭和连城白鸭腿肌中MyHC在E28时无显著差异,但显著高于F5资源群体(P<0.05)。

图5 7周龄北京鸭(P)和F5资源群体(H)的胸肌(PM)和腿肌(LM)组织中成肌发育相关基因mRNA的表达Fig.5 mRNA expression of myogenesis genes in pectoral muscle(PM)and leg muscle(LM) of Peking ducks(P)and hybrid F5 populations(H)at 7 weeks old
如图5所示:7周龄时,北京鸭胸肌和腿肌组织中Pax7和MyoD的表达水平都显著高于F5资源群体;北京鸭腿肌中Pax7表达水平比胸肌高,而F5资源群体胸肌中Pax7表达水平比腿肌高;MyoD在腿肌中的表达水平均高于胸肌(P<0.05)。北京鸭胸肌和腿肌中Myf5、Mrf4、MyoG和MyHC的表达水平均显著低于F5资源群体;且2个品种胸肌中Myf5、MyoG和MyHCmRNA的表达水平都比腿肌高(P<0.05)。
2.4 北京鸭、连城白鸭和F5资源群体肌肉组织中5hmC水平检测
从图6可知:在E14时,北京鸭、连城白鸭和F5资源群体胸肌中5hmC水平在品种间差异显著,F5资源群体5hmC水平最低(P<0.05);在E21时,胸肌中5hmC水平均达到高峰,且北京鸭和连城白鸭中5hmC水平显著高于F5资源群体(P<0.05);在E28时,连城白鸭胸肌中5hmC水平仍维持在较高水平,显著高于北京鸭和F5资源群体(P<0.05)。在腿肌中,F5资源群体5hmC水平在E14和E28时显著高于北京鸭和连城白鸭(P<0.05);在E21,连城白鸭腿肌中5hmC的水平最高,显著高于北京鸭(P<0.05)。在E21,北京鸭、连城白鸭和F5资源群体的骨骼肌组织中全基因组5hmC均有较高水平,表明E21是鸭骨骼肌组织进行全基因组去甲基化的重要时期。7周龄时,北京鸭和F5资源群体胸肌中全基因组5hmC水平未表现出品种间的差异(P>0.05);北京鸭腿肌中5hmC水平显著低于F5资源群体(P<0.05),这一差异与胚胎期E28时5hmC的水平相一致。

图6 北京鸭(P)、连城白鸭(L)和F5资源群体(H)的胸肌(PM)和腿肌(LM)中5hmC水平分析Fig.6 Analysis of 5hmC level in pectoral muscle(PM)and leg muscle(LM)of Peking ducks(P), Liancheng white ducks(L)and hybrid F5 populations(H)DNA dot blot分析胚胎期(A、C)和7周龄(E)北京鸭、连城白鸭和F5资源群体的胸肌和腿肌组织基因组5hmC水平变化DNA dot blot analysis of 5hmC level in pectoral and leg muscle of Peking ducks,Liancheng white ducks and hybrid F5 populations. B、D、F表示胸肌、腿肌组织中5hmC相对光密度值的定量统计B,C,D mean quantitative statistics of 5hmC relative value of the optical density in pectoral and leg muscle.
2.5 北京鸭、连城白鸭和F5资源群体骨骼肌中DNA甲基化相关基因mRNA表达式
采用RT-qPCR检测了DNA甲基化相关基因mRNA在骨骼肌中表达水平变化。结果如图7所示:在E14,北京鸭胸肌中Dnmt1、Dnmt3b、Tet(1~3)mRNA表达水平显著高于连城白鸭和F5资源群体(P<0.05);在E28时,连城鸭胸肌组织中Dnmt1、Tet(1~3)基因的表达水平最高(P<0.05),说明发生基因组去甲基化过程(P<0.05)。在胚胎期腿肌中,E14北京鸭腿肌中Dnmt1、Dnmt3b、Tet1和Tet3 mRNA表达水平显著高于连城白鸭和F5资源群体;在E28,Dnmt1、Dnmt3a和Tet1 mRNA在连城鸭腿肌组织中的表达水平最高;Tet2 mRNA在胚胎期F5资源群体腿肌组织中的表达水平最高(P<0.05)。在E21时,Dnmt3bmRNA在连城白鸭胸肌、腿肌中的表达水平最高(P<0.05)。7周龄时,Tet2 mRNA在北京鸭和F5资源群体的骨骼肌组织中的表达水平最高,胸肌中的表达水平高于腿肌(P<0.05)。Dnmt1、Dnmt3a、Tet1、Tet3在北京鸭肌肉组织中的表达水平比F5资源群体高,且在胸肌中的表达水平显著高于腿肌(P<0.05)。Dnmt3b和Tet2 mRNA在F5资源群体胸肌中的表达水平显著高于北京鸭(P<0.05)。

图7 北京鸭、连城白鸭和F5资源群体胸肌(PM)和腿肌(LM)中甲基化调控相关基因的mRNA表达Fig.7 mRNA expression of methylation related genes in pectoral muscle(PM)and leg muscle(LM) of Peking ducks,Liancheng white ducks and hybrid F5 populations
3 讨论
不同品种鸭骨骼肌组织的发育有着独特的规律,胚胎期肌肉组织的生长发育情况与成年鸭的产肉能力和肉品质密切相关。朱文齐等[8]在不同品种鸭胚胎期骨骼肌发育的研究中发现,体型相差较大的鸭在胚胎期的胚重、胸肌重和腿肌重已有明显差异。本研究中,在胚胎期和上市日龄,北京鸭各肌肉组织均重于连城白鸭和F5资源群体,且F5资源群体的胸肌重和腿肌重均比连城白鸭重,这表明北京鸭改良了连城白鸭的低产肉能力。
已有研究表明,在不同品种家禽骨骼肌的肌纤维特性存在很大差异[12]。在相同管理条件下,地方品种鸡的肌纤维直径较小,快大型鸡肌纤维直径较粗,并且遗传背景的差异还能影响肌纤维的数量[13]。鸭胚胎胸肌率和腿肌率在不同时期和品种间的差异较大。通过对鸭胚胎期胸肌组织的形态学观察,本研究表明E21是肌纤维增殖到融合转变的关键时期,这与顾丽红[14]对北京鸭胚胎期胸肌发育的研究结论一致。张荣萍等[11]在鸭胚胎发育后期腿肌肌纤维特性的研究中,发现E21也是腿肌组织发育的高峰期。
有许多研究已表明肌纤维特性对肉嫩度有直接影响[14-15]。北京鸭在E11—E26时期胸肌肌纤维直径先快速增加再放缓,肌纤维密度变化则相反[16]。本研究结果显示,在E28时,北京鸭肌肉的肌纤维密度高于F5资源群体。MFN在胚胎期早已决定成体动物的产肉性能[17],张荣萍[18]的研究表明北京鸭的骨骼肌重和肌纤维密度均高于黑鹜鸭。徐苏微等[12]研究表明家禽肌纤维横截面积与年龄成正比,肉用型品种肌纤维面积比蛋用型大,快大型品种肌纤维直径大于慢速型。在本试验中,北京鸭肌肉组织的肌纤维横截面积(CSA)和肌纤维直径(MFD)均大于F5资源群体,MFN小于F5资源群体,其中在腿肌组织中的差异更明显,这表明肌纤维表型性状在品种间有差异。
研究发现Pax3/Pax7 基因共同调控家禽胚胎期骨骼肌发育和再生[19]。本研究表明,Pax7在E21北京鸭、连城白鸭和F5资源群体骨骼肌中表达水平较高。7周龄北京鸭Pax7表达水平显著高于F5资源群体,揭示Pax7表达水平在鸭肌肉发育过程中存在品种差异。生肌调节因子(MRF)在胚胎肌肉的形成和成体肌肉的生长有着重要的调控作用。F5资源群体胸肌中MyoD表达水平显著高于连城白鸭;MyoD表达水平在连城白鸭腿肌中除E21之外的时间点均显著高于F5资源群体。这与朱文奇等[8]检测高邮鸭和金定鸭胚腿肌中MyoD表达水平在品种间差异较小的结论不同,可能是由于品种和检测时间点不同造成的。Liu等[20]在火鸡骨骼肌研究中发现,不同品种、性别和发育阶段胸肌组织中MyoG的表达量存在差异。本研究中,胸肌中MyoGmRNA在胚胎发育前期表达水平较高,后期表达水平较低,表明E21是胸肌发育的转折点[21-22]。通过对鸭胚胸肌的形态学分析,初步表明E21是胸肌组织发育从增殖转化为融合的关键时期,此时鸭胚胸肌发育最快[22]。Fujisawa-Sehara等[23]发现Mrf4在出生后和成体哺乳动物的红、白肌中维持较高的表达水平。在本试验中,7周龄北京鸭和F5资源群体胸肌和腿肌组织中Mrf4 mRNA均有较高的表达水平。
TET酶和5hmC修饰已成为基因表达的关键激活因素,导致DNA去甲基化和基因活化[24]。Koh等[25]的研究表明,TET通过调控谱系特异性基因在维持细胞多能性中起重要作用,而TET及其5hmC产物在成体干细胞和体细胞组织中具有相反作用[26]。Liu等[27]研究发现Tet2的表达是平滑肌细胞分化所必需的,同时Tet2激活的基因启动子区域富含5hmC标记,导致强烈的基因激活。Tet2参与5hmC的产生和DNA去甲基化,在成肌细胞和肌管中显著上调[28]。本试验结果表明,在鸭胚和成年鸭的肌肉组织中,Tet2基因mRNA表达水平最高,且Tet2在F5资源群体的肌肉组织中表达水平显著高于北京鸭。Dnmts家族对甲基标记的起始和维持起着严格的调控作用[29],肌肉组织中Dnmt1的缺失降低了肌细胞的分化能力[30-31]。DNA甲基化通过对肌生成转录因子MyoD的调控来调节肌肉的发育[32]。本试验中,Dnmt1基因在肌肉组织中表达水平较低;在E21时,Dnmt3a基因在骨骼肌组织中的表达水平相对较高,7周龄北京鸭腿肌中Dnmt3a表达水平相对较高。北京鸭、连城白鸭和F5资源群体的胸肌、腿肌中全基因组5hmC在E21均有较高表达水平,这表明E21是鸭骨骼肌组织进行全基因组去甲基化的重要时期。这些结果表明,Tet2在骨骼肌发育中发挥重要作用,推测DNA去甲基化在品种间的水平存在差异,这可能导致不同品种鸭的骨骼肌发育存在差异。
禽类肌纤维的数量早在出壳前就已决定,在成肌发生过程中,DNA甲基化修饰对肌细胞的成活起决定作用。本研究发现胚胎期北京鸭骨骼肌组织发育显著快于连城白鸭和F5资源群体,表明骨骼肌的差异在胚胎期就有体现;北京鸭、连城白鸭和F5资源群体中调控肌肉发育的相关基因在品种间表达水平不同;DNA甲基化水平在不同品种间存在显著差异,这种差异可能是导致不同品种鸭肌肉发育存在差异的原因,具体的调控机制仍需进一步探索。
