磁性荷叶吸附剂的制备及其对亚甲基蓝的吸附
2022-11-21任希华贾悦陈华艳陈向上
任希华,贾悦,陈华艳,陈向上
(1.省部共建分离膜与膜过程国家重点实验室,天津 300387;2.天津工业大学 环境科学与工程学院,天津 300387;3.天津工业大学 材料科学与工程学院,天津 300387)
染料水溶性好,分子结构稳定难以降解,给废水处理造成严重困难[1-4]。吸附法处理染料废水其操作方便、能耗较低、处理能力强,被认为是一种理想的废水处理方法[5-6]。与传统吸附剂相比,生物基吸附剂成本低,具有物理吸附和化学吸附的特性[7-10]。荷叶本身具有很强的吸附能力,因“莲花效应”限制其作为吸附剂在水溶液中的应用。Yang等通过荷叶球磨处理[11],获得粒径小且疏水性低的荷叶粉末吸附剂;但其在水溶液中难以快速分散和回收,限制荷叶的进一步应用[12-13]。本研究通过离子共沉淀法,使磁性Fe3O4沉积在荷叶表面,实现负载吸附剂的快速分散和分离回收。
1 实验部分
1.1 试剂与仪器
荷叶,来自于池塘废弃荷叶(LL);氯化亚铁、氯化铁、氨水、氢氧化钠、乙醇、盐酸、亚甲基蓝(MB)均为分析纯。
Nicolet iS50型红外光谱仪;K-alpha型X射线电子能谱仪;Hitachi S4800型冷场发射扫描电镜;FA2004N型电子天平;BLY-50TH型恒温摇床;78HW-1型磁力搅拌器等。
1.2 磁性生物质吸附剂的制备
用去离子水洗涤荷叶多次,去除表面灰尘和污垢。然后在无水乙醇和去离子水中80 ℃水浴加热30 min,去除色素等活性物质。于80 ℃烘箱中烘干至恒重,用粉碎机粉碎3 min,再用高速球磨机分别研磨90,180 min,获得LLP-1和LLP-2两种不同粒径的荷叶粉末,装入密封袋备用。
碱性条件下,采用化学共沉淀技术制备均相Fe3O4纳米颗粒。准确称取所需质量的FeCl2·4H2O及FeCl3·6H2O(Fe2+/Fe3+摩尔比为1∶2)置于80.00 mL去离子水中搅拌至溶解。然后水浴加热至80 ℃并缓慢加入10.00 mL质量分数为25%的氨水,再加入10.0 g荷叶粉末,恒温快速搅拌条件下反应40 min。冷却至室温后过滤,滤出物先后用无水乙醇和去离子水冲洗,置于70 ℃下鼓风、真空干燥各12 h。MLLP的制备原理如式(1)和(2)。

(1)

(2)
1.3 吸附性能测试
称取1 g/L的MLLP置于离心管中,取30 mL一定浓度的MB溶液,并用0.1 mol/L HCl和0.1 mol/L NaOH调节溶液的pH,放入恒温摇床上在200 r/min条件下吸附160 min。磁性分离,取上层清液,用孔径为0.45 μm的滤膜进行过滤,紫外分光光度计测试其吸光度(波长664 nm)。重复测试3次,取平均值。计算复合吸附剂MLLP对MB的吸附量和去除率。
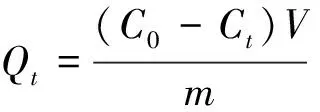
(3)
(4)
式中Qt——t时刻吸附剂的吸附量,mg/g;C0——溶液的初始浓度,mg/L;Ct——t时刻溶液的浓度,mg/L;Ce——吸附过程达到平衡时溶液的浓度,mg/L;V——溶液的体积,L;m——吸附剂的质量,g;R——去除率,%。
2 结果与讨论
2.1 复合吸附材料表征
2.1.1 粒径 研磨不同时间后的荷叶粉末粒径分布曲线见图1。

图1 LLP及MLLP的粒径分布Fig.1 Particle size distribution of LLP and MLLP
由图1可知,球磨90,180 min后,LLPs的平均粒径分别减小至80.61,58.48 μm,Fe3O4负载后MLLP-1、MLLP-2的粒径有所增大,分别为90.12,79.67 μm。这可能是纳米Fe3O4通过表面之间存在的范德华力、静电和疏水相互作用以及铁磁体之间的结合力覆盖在LLP表面所引起的[14-15]。
2.1.2 XPS 采用XPS对LLP及MLLP表面进行元素成分分析,结果见表1。
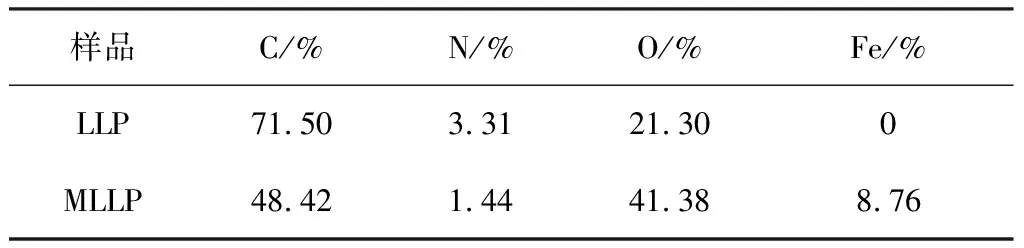
表1 LLP及MLLP的表面元素原子分数分析Table 1 Atomic fraction analysis of surface elements of LLP and MLLP
由表1可知,在纳米Fe3O4被合成负载于LLP后,C元素由71.50%降低到48.42%;N元素含量由3.31%降低到1.44%;而Fe、O元素含量分别增加了8.76%和20.08%。C、N元素含量百分比降低是由于Fe3O4的负载增加了Fe和O元素含量,同时LLP部分表面被Fe3O4纳米粒子覆盖,证明Fe3O4成功的沉积在LLP表面,制得MLLP[16]。
2.1.3 SEM 由图2可知,铁前体(FeCl2·4H2O 和 FeCl3·6H2O)经过在碱性条件下离子共沉淀技术生成铁氧化物沉积在LLP表面和孔隙结构内。LLP表面光滑,存在少量的沟壑;而MLLP材料表面粗糙,有颗粒状物质堆积,比表面积有所增大,利于对染料的吸附。制备过程中荷叶原有的纤维结构未被破坏[17]。


图2 LLP及MLLP的表面形貌图(SEM)Fig.2 SEM of LLP and MLLP a.LLP;b.MLLP
2.1.4 FTIR LLP与MLLP的红外光谱见图3。
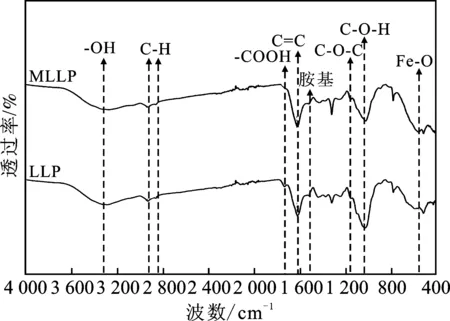
图3 LLP及MLLP的红外光谱图Fig.3 FTIR of LLP and MLLP
由图3可知,在3 328 cm-1处为—OH官能团吸收峰,2 924,2 855 cm-1处为C—H官能团吸收峰,1 741 cm-1处为—COOH不对称伸缩振动峰,1 615 cm-1附近为荷叶中木质素、纤维素等有机物中芳香族环振动吸收峰[18],1 516 cm-1处为仲胺官能团,1 151 cm-1处为多糖C—O—C,1 028 cm-1处为C—O—H 伸缩振动[19]。MLLP在554 cm-1出现新的吸收峰,再一次说明铁氧化物成功的负载在LLP表面。根据颗粒表面丰富的官能团,推测MLLP的吸附同时存在物理吸附和化学吸附两种吸附机制。
2.2 MLLP对亚甲基蓝的吸附
2.2.1 pH对MLLP吸附亚甲基蓝的影响 分别测试了pH=3~10范围内MLLP对染料MB的吸附性能,结果见图4。
由图4可知,当pH=10时,达到吸附量最大值,为97.10 mg/g;在pH值3~6条件下,溶液中存在大量氢离子包围在吸附剂表面,H+会与MB竞争吸附位点,对MB阳离子产生静电排斥,从而导致吸附能力较低。当pH值从7~10 逐渐增加时,H+浓度降低,MLLP吸附剂表面去质子化,提高MB与MLLP表面空隙间的吸附作用。另外,碱性条件下,复合材料MLLP中的荷叶颗粒内部结构易溶胀疏松,孔隙率相对增加,提高了MLLP的传质能力,且荷叶颗粒中的纤维素和半纤维素在碱性条件下氢键易断裂,促使游离羧基的形成,进而吸附MB的能力有所提升[20]。因此,MLLP在碱性条件下的吸附性能更强。基于实验的便捷性,后续实验以MB溶液自然pH值(7.09)进行吸附。
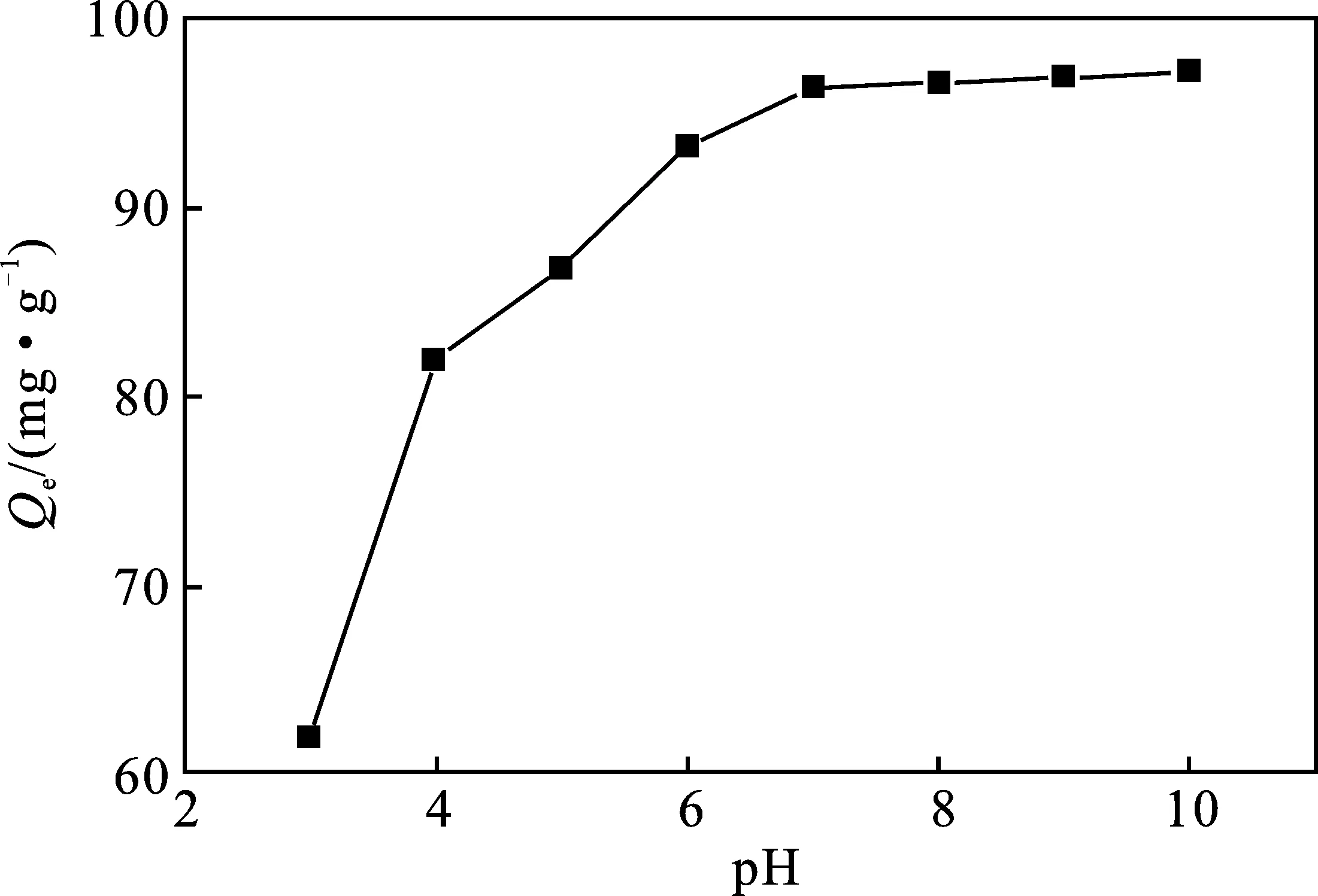
图4 初始溶液pH对MLLP吸附MB性能的影响Fig.4 Influence of initial solution pH on MLLP adsorption capacity of MB
2.2.2 温度对MLLP吸附亚甲基蓝的影响 图5为液相温度对MLLP吸附MB性能的影响。

图5 温度对MLLP吸附MB性能的影响Fig.5 Influence of temperature on MLLP adsorption performance of MB
由图5可知,温度从15 ℃上升到55 ℃时,复合材料MLLP对MB最大吸附量略有下降,从97.60 mg/g 降低到89.46 mg/g,复合材料MLLP对水中MB的吸附在本质上是放热反应,适宜在室温下进行。
2.3 MLLP吸附MB的动力学
图6为MLLP对MB的吸附量随时间变化规律。
由图6可知,前5 min时,MLLP-2吸附速率和吸附能力高于MLLP-1,且均优于LLP,这可能是因为Fe3O4纳米粒子在LLP表面沉积,降低荷叶粉末表面疏水性,且微孔结构和活性水羟基增加[21]。
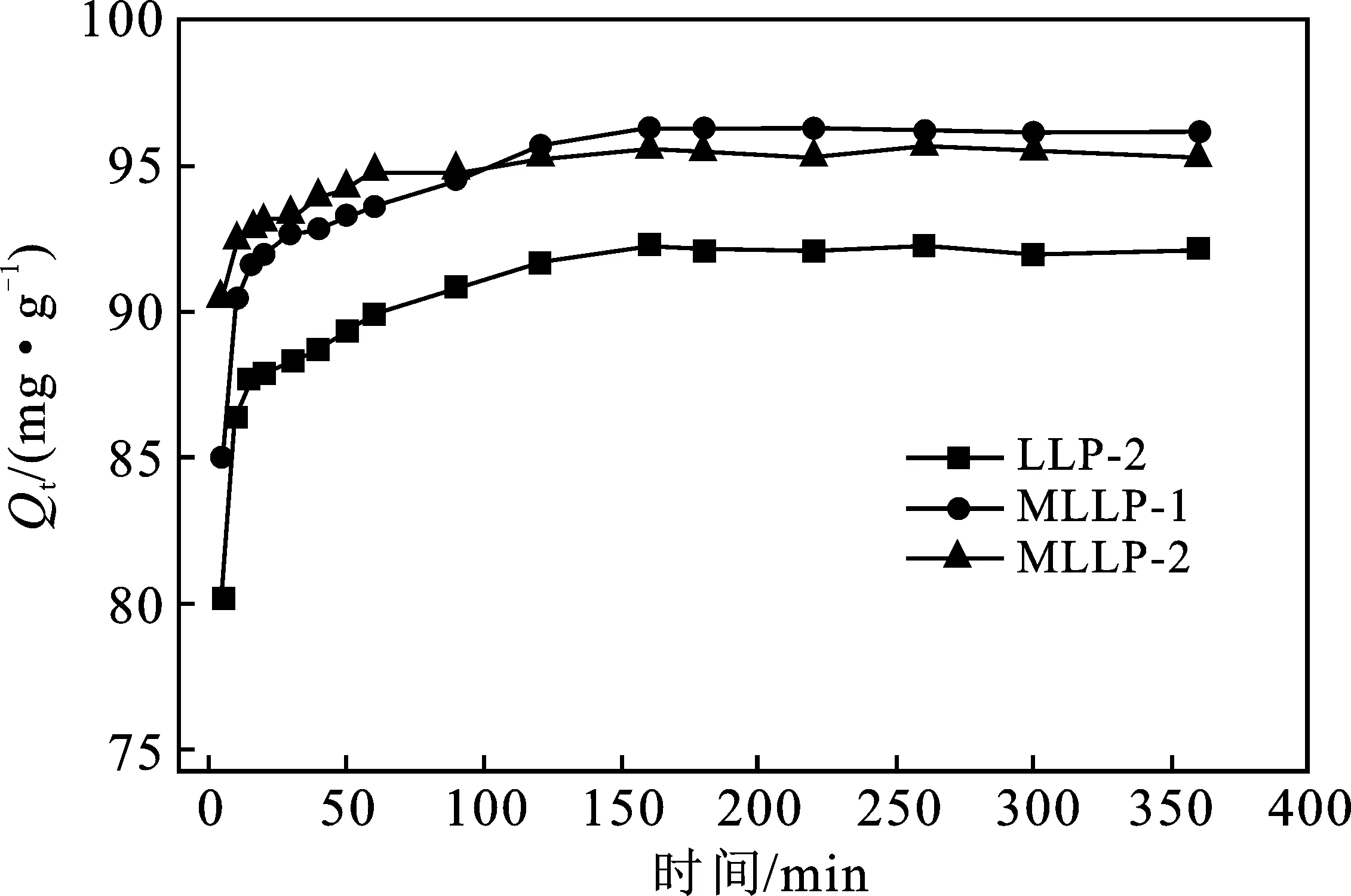
图6 MLLP对MB吸附量随时间变化规律Fig.6 Influence of contact time on MLLP adsorption performance of MB
此外,吸附15 min时,LLP-2、MLLP-1和MLLP-2对MB的吸附量分别达到87.63,91.65,92.80 mg/g。此段为快速吸附阶段,MLLP-2的吸附量和吸附速率均高于MLLP-1,可能是Fe3O4的负载使吸附剂更易于分散在MB溶液中。在20~160 min,吸附量增加变缓慢,且在90 min后,MLLP-1的吸附量逐渐大于MLLP-2。这可能是由于LLP-2粒径较小,容易被Fe3O4纳米粒子包覆,相应的也包埋了部分LLP表面,导致MLLP-2对MB的吸附能力略有下降。
采用伪二级动力学模型和粒子内扩散模型进行MLLP对染料MB的吸附动力行为数据拟合[22],结果见图7和表2。
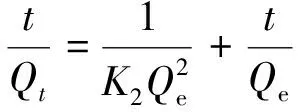
(5)
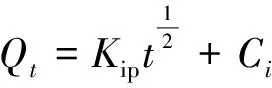
(6)
式中k——二阶方程速率常数,g/(mg·min);Ci——与边界厚度有关的常数,mg/g;kip——颗粒内扩散速率常数,mg/(g·min1/2)。
kip值越大,表明吸附质易在吸附剂内部扩散。Qt与t1/2的线性关系,可能存在多种情况,直线通过原点表明吸附过程受颗粒内扩散和膜扩散的联合控制,否则,吸附过程伴随着内扩散[15]。
由图 7可知,吸附过程符合准二级动力学模型(R2=0.999 9),基于表2数据计算得到的平衡吸附量(96.53 mg/g)与实际吸附量(91.65 mg/g)相近,说明MLLP对MB的吸附主要以化学吸附为主,其中存在共价键和离子交换。

(a)MLLP吸附MB的准二级动力学模型拟合
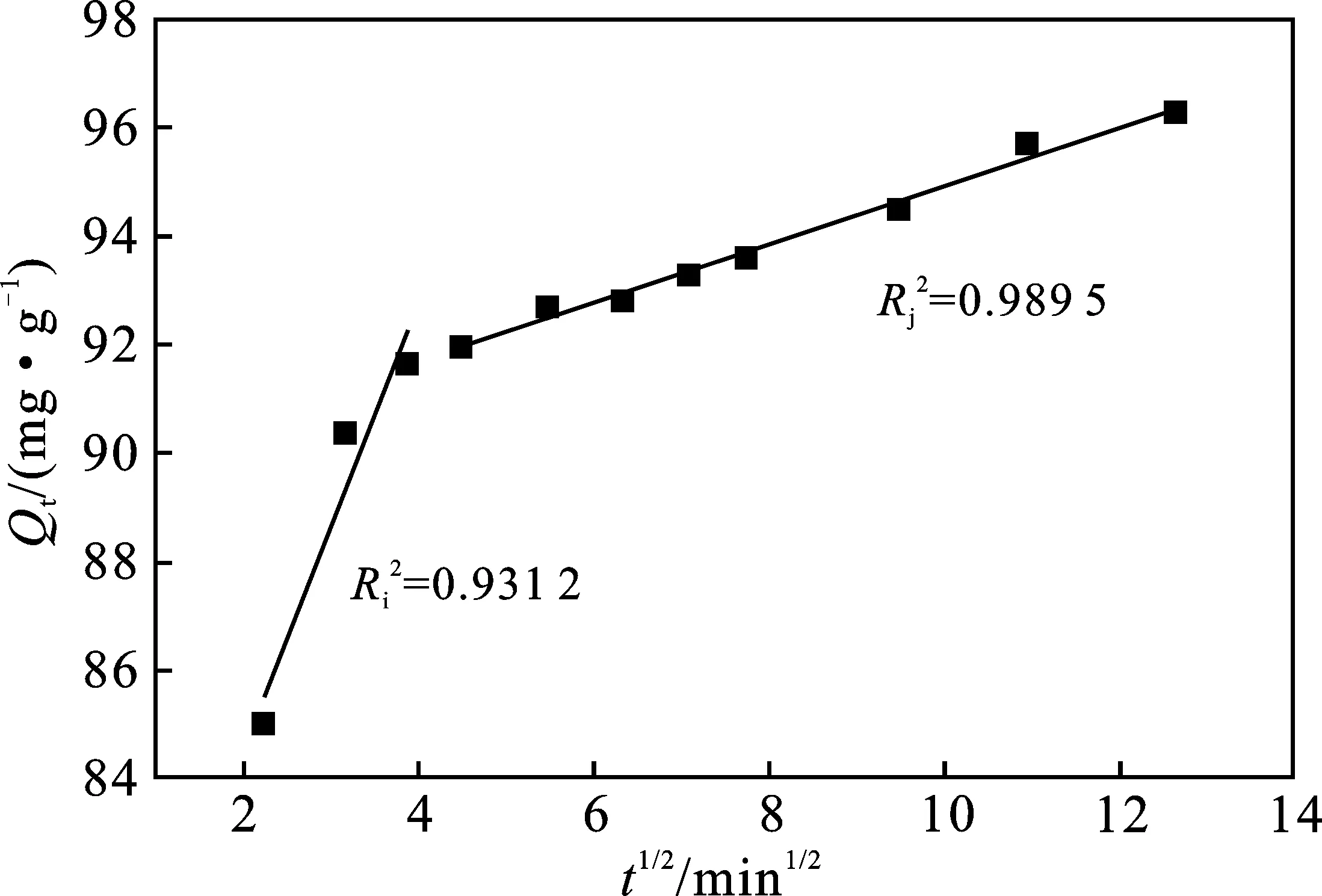
(b)MLLP吸附MB的颗粒内扩散模型拟合
由图7(b)(颗粒内扩散模型结果)可知,MLLP吸附MB的过程主要有两阶段:第一阶段是表面扩散,此阶段由于MB分子在MLLP内外表面浓度差较大和MLLP表面大量吸附位点的空缺共同作用,使MB分子快速吸附,颗粒内扩散速率常数(Ki)最高,有利于染料的快速去除。第二阶段是颗粒内扩散,浓度差降低,吸附位点减少,导致MB吸附速度减慢。在此之后达到吸附平衡,MLLP表面活性位点趋于饱和。综上所述,影响MLLP吸附MB分子的速率主要是表面扩散和颗粒内扩散,且吸附过程同时存在物理吸附和化学吸附。

表2 MLLP吸附MB的动力学参数Table 2 Kinetic parameters of MLLP adsorption of MB
2.4 MLLP吸附亚甲基蓝的吸附等温线
图8为MB初始浓度下,MLLP对MB的吸附量和去除率的影响。
由图8可知,随MB初始浓度的升高,MLLP的吸附量的增长速度逐渐降低。这主要是因为对于一定的吸附剂而言,初始浓度的增大,相应的吸附负荷增大,阻碍MB在MLLP表面和内部的传质。
分别采用Langmuir、Freundlich等温线模型对MLLP吸附MB过程进行拟合[22],结果见图9和表3。

(a)Langmuir模型
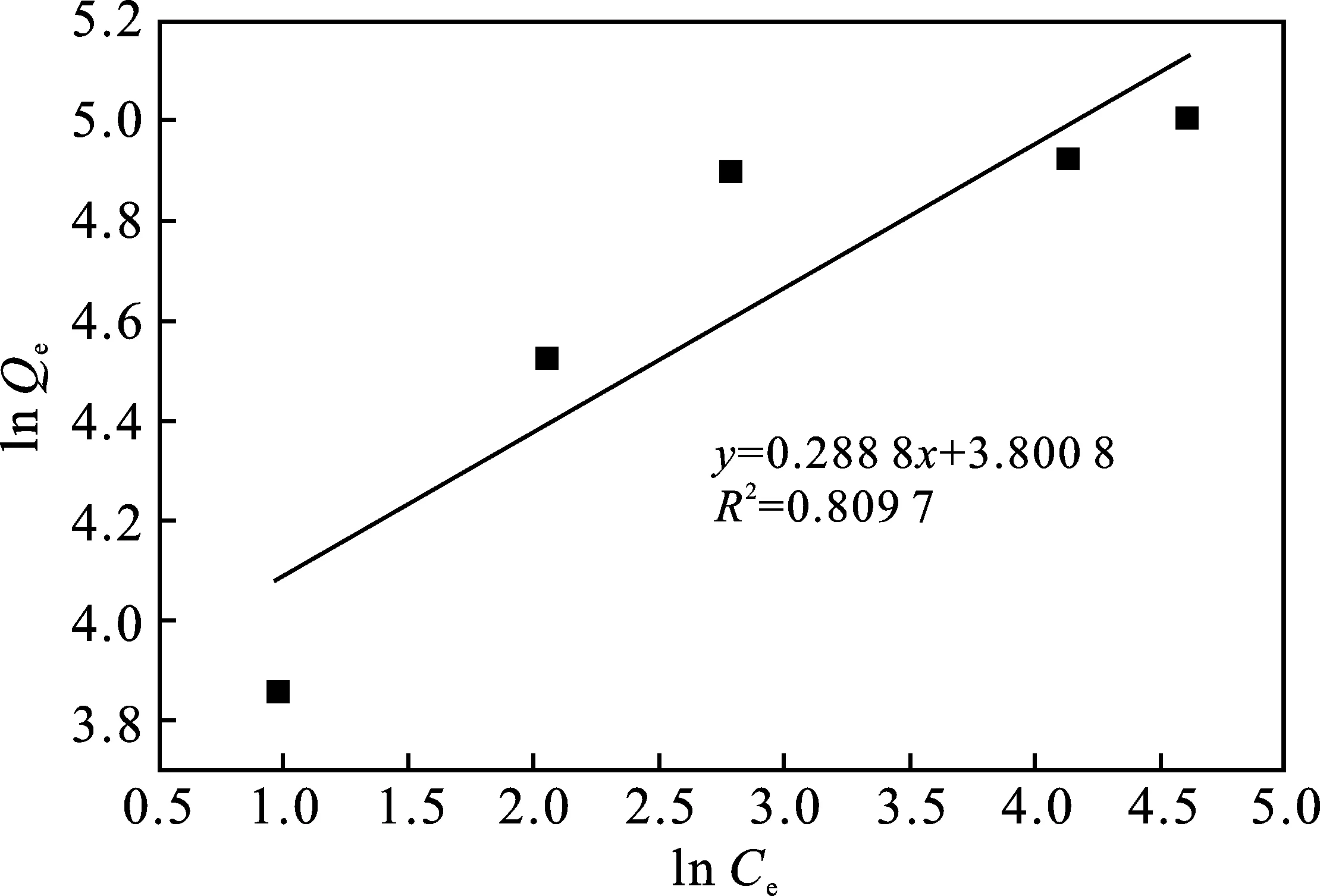
(b)Freundlich模型
(7)
(8)
式中Ce——吸附平衡后浓度,mg/L;
Qe——MLLP对MB的平衡吸附量,mg/g;KL——Langmuir吸附常数,L/mg;Qm——最大吸附容量,mg/g。
Kf——吸附平衡常数,mg/g;n——不均匀系数,表明材料的不均匀性和吸附推动力强度。
n值在2~10之间时,容易吸附;当n<0.5时,难于吸附。

表3 MLLP吸附MB的吸附等温线参数Table 3 Adsorption isotherm parameters of MLLP adsorption MB
由表3可知,对MLLP吸附 MB的吸附数据拟合更符合Langmuir模型(R2=0.997 6),MB 染料的吸附过程主要是以单分子的均匀吸附为主,拟合最大吸附量为156.25 mg/g。参数中的KL值越大,表示吸附剂和染料结合的稳定性越大。
2.5 磁性负载吸附剂回收效率
对LLP-1、LLP-2、MLLP-1和MLLP-2分别进行回收测试,将吸附剂均匀分散于溶液中,后静止或利用磁性分离3 min,回收结果见表4。
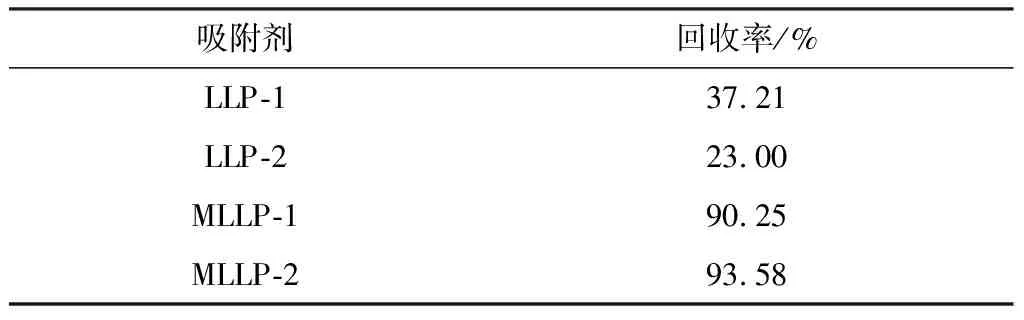
表4 吸附剂回收率参数Table 4 Recovery parameters of adsorbent
由表4可知,小粒径不利于沉降,LLP粒径减小回收率降低,LLP-2 回收率仅为23.00%。而负载纳米Fe3O4后,MLLP的回收率均大于90%,MLLP-2的回收率高于MLLP -1,说明磁性包裹可有效促进吸附剂从水中的分离回收,且小粒径MLLP的吸附速率和回收率均优于大粒径MLLP。
3 结论
(1)纳米Fe3O4在LLP表面沉积后吸附粉末MLLP粒径有所增大,表面增加了Fe元素(8.76%);LLP表面清晰可见颗粒状物质的堆积,比表面积增加,亲水性增强,可以更快速均匀地分散在水中。
(2)MLLP对MB吸附能力随pH值的增加先增加,并于pH=7后趋于平缓;LLP粒径越小,越易于被Fe3O4包覆,部分空隙结构被填埋,吸附容量稍有降低;随温度升高,MLLP平衡吸附量略有下降。MLLP吸附MB的过程符合Langmuir吸附等温模型,拟合的最大吸附量达156.25 mg/g。吸附过程可以用准二级动力学曲线很好地拟合,相关系数R2接近于1,荷叶表面的活性官能团发挥主要吸附作用。
(3)MLLP的吸附速率和吸附量均高于LLP;同时,MLLP可以采用外加磁场进行分离回收,简易高效,3 min内回收率大于90%。因此,MLLP是一种适用于MB废水处理有潜力的吸附材料。
