脂肪来源的间充质干细胞保护糖尿病大鼠肾损伤的作用机制
2022-11-21林思彤
林思彤
(北华大学附属医院,吉林 吉林 132011)
糖尿病肾病(Diabetic nephropathy,DN)为糖尿病(Diabetes mellitus,DM)常见微血管并发症,同时也是终末期肾病最主要病因[1].目前,治疗DN的主要手段为药物治疗控制血糖,但大多数药物无法延缓对肾脏损伤.因此,寻找可阻止DN发生的治疗方法意义重大[2].间充质干细胞(Mesenchymal stem cells,MSCs)系一类具有高度自我更新能力和多向分化潜能的多能干细胞,能分化成成骨细胞、肌原细胞、软骨细胞、脂肪细胞等.已有研究[3]表明,MSCs移植是治疗DM及其并发症的有效方式.目前的研究[4]多为骨髓MSCs,但骨髓采集为有创操作,且骨髓MSCs体外培养周期长,不利于研究.自体脂肪间充质干细胞(Adipose-derived mesenchymal stem cells,ADMSCs)和骨髓MSCs相比来源更广泛,不会给患者带来痛苦,且体外培养时间短,具有更高的研究价值.为此,本实验通过移植自体ADMSCs至1型糖尿病大鼠体内,探究其对DM大鼠肾损伤的保护机制,为DN临床诊治提供参考.
1 材料与方法
1.1 实验材料
动物材料:健康雄性SD大鼠30只(由广州弗尔博生物科技有限公司提供),体质量200~250 g,清洁级.根据实验目的将30只SD大鼠分为DM组(n=10)、ADMSCs移植组(n=10)和对照组(n=10).
试剂与仪器:Ⅰ型胶原酶、链脲佐菌素(Sigma-Aldrich公司,美国);胎牛血清、DMEM培养基(Gibco公司,美国);CytoFLEX型流式细胞仪(Beckman Coulter公司,美国);ADVIA 1800型全自动生化分析仪(Siemens公司,美国);Forma i160型CO2培养箱(Thermo Forma公司,美国);PE-CD29、FITC-CD34、FITC-CD45、FITC-CD90抗体(Invitrogen公司,美国);Bcl-2、Bad、Bax抗体(Abcam公司,美国);其余试剂与仪器由实验室自备.本实验涉及的动物均严格按照《实验动物管理条例》进行实验.
1.2 实验方法
1.2.1 构建1型糖尿病动物模型
连续5 d将链脲佐菌素(40 mg/kg)腹腔注射至大鼠体内,监测大鼠血糖水平,若出现多饮、多食及多尿等情况且血糖水平>16.7 mmol/L时表明1型糖尿病动物模型构建成功.建模4周后,随机将20只SD大鼠分为DM组、ADMSCs移植组.对照组大鼠注射柠檬酸-柠檬酸钠缓冲液(40 mg/kg).
1.2.2 自体ADMSCs分离及培养
分离:取大鼠腹股沟皮下脂肪组织,先采用PBS缓冲液将残留血液清洗干净并剔除血管,采用Ⅰ型胶原酶在37℃温度下消化1 h,然后滴加含胎牛血清(10%)的DMEM培养液终止消化,所得消化液依次经100、25 μm尼龙膜过滤后将未消化组织去除,再行离心处理收集细胞.
培养:滴加含胎牛血清(10%)的DMEM培养液重悬细胞,然后于5% CO2细胞培养箱中(37 ℃)培养24 h;72 h后移除悬浮细胞,观察到贴壁细胞生长、融合至80%~90%时进行传代和纯化处理.
1.2.3 ADMSCs鉴定、诱导及移植
鉴定:取第三代ADMSCs滴加PE-CD29、FITC-CD34、FITC-CD45、FITC-CD90抗体及同型阴性对照小鼠单克隆抗体,震荡摇匀,避光孵育(4 ℃,30 min).以PBS缓冲液冲洗,离心弃上清,滴入含0.1%多聚甲醛的PBS缓冲液(200 μL)混匀固定,并采用流式细胞仪检测其表型抗原.
诱导:取第三代ADMSCs分别于成骨细胞、成脂细胞诱导培养基中培养,观察到细胞分化稳定后采用油红O染色,观察脂质空泡情况,然后采用茜素红染色观察钙结节情况.
移植:建模4周后,经尾静脉注射ADMSCs(1×106个/500 μL)至ADMSCs移植组大鼠体内,DM组与对照组大鼠注射等体积DMEM培养液.
1.3 指标检测
ADMSCs移植8周后取大鼠至代谢笼中,采集24 h尿液样本,充分摇匀,取5 mL样本冷存待检(-20 ℃),并取5 mL颈动脉血离心分离血清后冷存待检(-20 ℃).采用全自动生化分析仪检测3组大鼠血糖、胰岛素、24 h尿蛋白、尿素氮、血肌酐.干预12周后以腹腔过量肌注水合氯醛方式处死大鼠,无菌条件下取1 mg肾脏组织,按照文献[5]方法,采用蛋白质印迹法检测凋亡相关蛋白(Bcl-2、Bad、Bax)表达,测量各组大鼠肾质量、体质量,并计算肾质量/体质量值.
1.4 统计学分析

2 结 果
2.1 ADMSCs体外培养、分化及鉴定结果
本研究结果显示:第三代ADMSCs呈成纤维细胞样梭形贴壁,茜素红染色观察到钙结节,表明ADMSCs分化为成骨细胞,油红O染色观察到脂质空泡阳性,表明ADMSCs分化为成脂细胞.流式细胞仪鉴定结果显示,ADMSCs中CD29、CD90高表达,而CD34、CD45低表达.
2.2 3组大鼠检测指标
干预12周后,ADMSCs移植组、DM组SD大鼠血糖、24 h尿蛋白、尿素氮、血肌酐、Bad蛋白、Bax蛋白表达水平及肾质量/体质量比值等均明显高于对照组SD大鼠,而胰岛素、Bcl-2蛋白表达水平均低于对照组SD大鼠(均P<0.05);与DM组SD大鼠相比,ADMSCs移植组SD大鼠血糖、尿素氮、Bad蛋白、Bax蛋白表达水平及肾质量/体质量比值更低,而胰岛素、Bcl-2蛋白表达水平更高(均P<0.05);ADMSCs移植组SD大鼠24 h尿蛋白、血肌酐虽较DM组SD大鼠水平降低,但差异无统计学意义(P>0.05).见表1.
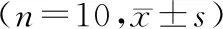
表1 3组大鼠检测指标
3 讨 论
DM患者由于自身胰岛β细胞损伤诱发高血糖,而长期高血糖状态可引发一系列并发症,其中DN的危害性最高[6].目前,控制血糖为治疗DN主要手段,如口服降糖药、注射胰岛素等,但该方法仅可缓解DM及其并发症症状,无法彻底治愈[7].研究[8-9]证实,MSCs移植治疗对DM及肾脏疾病具有较高的应用价值,尤以骨髓MSCs移植最为广泛,但因骨髓穿刺疼痛感及纯度不足问题限制其在临床中的应用.近年来研究[10]显示,ADMSCs多向分化及自我复制能力与骨髓MSCs相当,培养更容易且耗时短,短期内即能获取所需治疗用量.因此,ADMSCs被认为是治疗DM及其并发症最理想的潜在MSCs来源.
本实验通过连续腹腔注射链脲佐菌素成功构建1型糖尿病动物模型,结果表明,SD大鼠经链脲佐菌素干预12周后,其血糖、24 h尿蛋白、尿素氮、血肌酐水平均明显高于对照组大鼠,而胰岛素水平明显低于对照组大鼠,说明模型大鼠处于肾功能紊乱状态;此外,模型大鼠肾质量/体质量比值亦显著增高,提示模型大鼠肾脏肥大.目前,链脲佐菌素诱导时机多为4周左右,此时模型动物表现出轻微蛋白尿但不会呈现明显肾组织病理改变[11].因此,本实验以4周为节点,在注射链脲佐菌素4周后进行ADMSCs移植.体外培养ADMSCs后发现,ADMSCs从第2天起开始伸展并沿特定方向呈成纤维细胞样梭形生长,且多次传代后细胞增殖速度无明显衰减;此外,诱导培养后发现,ADMSCs分化为成骨细胞、成脂细胞,反映出ADMSCs分化能力.而在表型抗原鉴定中发现,ADMSCs高表达CD29、CD90,而低表达CD34、CD45,和闵小春等[12]结果类似.
移植ADMSCs 8周后发现,ADMSCs移植组大鼠的血糖、尿素氮、肾质量/体质量比值均明显低于DM组大鼠,胰岛素水平明显高于DM组大鼠,而24 h尿蛋白、血肌酐与DM组大鼠无明显差异,该结果表明,移植ADMSCs可一定程度上减轻DM大鼠的肾损伤,并抑制肾脏肥大.CHEN L等[13]研究显示,MSCs无论在体内还是在体外均能分化成胰岛β细胞;而余佳珊等[14]报道则指出,MSCs移植可有效控制1型糖尿病小鼠血糖水平,并能修复受损胰岛细胞.结合本实验结果,推测ADMSCs保护DM大鼠肾损伤可能机制之一:ADMSCs分化为胰岛β细胞后通过修复受损胰岛细胞而促进胰岛素mRNA表达,进而抑制胰岛细胞凋亡,通过特异性mRNA刺激血管生成,并建立完善血氧供应环境,从而降低大鼠高血糖状态,进而减轻因高血糖导致的肾损伤.
ZHANG F P等[15]研究显示,DN患者在持续的高血糖状态下经过缓慢的生化重组可大量产生AGEs,人体组织中的AGEs大量聚集可促进肾小球系膜增生和肾小球基底膜增厚,另外还存在足细胞过度凋亡情况.B细胞淋巴瘤性白血病-2(B-cell lymphoma/leukemia-2,Bcl-2)家族为已知的参与细胞凋亡的重要组成部分,而Bcl-2基因被证实为一种抗凋亡基因;此外,Bcl-2家族还包括Bad、Bax蛋白,与Bcl-2蛋白不同的是此两种蛋白为促凋亡蛋白,过度表达会促进细胞凋亡[16].本实验发现链脲佐菌素干预12周后,ADMSCs移植组、DM组大鼠肾脏组织中Bcl-2蛋白相对表达量明显低于对照组大鼠,而Bad、Bax蛋白相对表达量明显高于对照组大鼠,且ADMSCs移植组大鼠Bcl-2蛋白相对表达量低于DM组大鼠,Bad、Bax蛋白相对表达量高于DM组大鼠,该结果提示,ADMSCs可通过抑制肾脏组织细胞凋亡保护DM大鼠肾损伤.分析其可能的机制为ADMSCs通过降低Bad、Bax蛋白表达并上调Bcl-2蛋白表达,抑制肾脏组织细胞凋亡,并逆转氧化应激以修复肾脏损伤[17].
综上所述,ADMSCs可能通过促进胰岛素分泌控制血糖以及对肾脏组织细胞抗凋亡作用两种可能机制保护DM大鼠肾损伤.但本研究受设备及时间限制,仅探讨了控制血糖、抗细胞凋亡两大可能机制,且具体机制尚未完全探明.此外,ADMSCs的制备及质控尚无统一标准,缺乏ADMSCs治疗DN长期疗效证据支持.相信随着研究的深入,ADMSCs有望成为治疗DN的重要手段.
