食品冻干粉中霉菌和酵母平板计数的不确定度评估
2022-11-21陈楷,林秀敏,肖剑
许多天然发酵的食品是由霉菌、酵母菌和细菌共同作用而产生的,但它们也是导致大量食品被销毁的罪魁祸首,同时是影响食品加工和贮藏的主要因素。部分霉菌在特定条件下会产生真菌毒素,这些毒素对人类是有害的[1]。所以霉菌和酵母作为指示菌被用于食品的卫生质量评价,霉菌和酵母计数又被用于评估食品受污染情况。我国的食品安全国家标准中对糕点、面包、饮料等食品中的霉菌和酵母均有严格的限量要求,且限量值较低[2-3]。此外霉菌孢子易扩散,稍有偏差检验结果就可能超出限量值,因此检验过程中需要做好质量控制,确保结果的准确可靠。
不确定度评估作为衡量检测结果质量的指标,可为检测报告提供准确、可靠的科学依据。在《检测和校准实验室能力认可准则在微生物检测领域的应用说明》(CNAS-CL01-A001:2018)[4]中要求在微生物检测过程中,考虑测量不确定度对于检测结果的重要性,列出各主要的不确定度分量,并作出合理的评估。本实验依据《食品安全国家标准 食品微生物学检验霉菌和酵母计数》(GB 4789.15—2016)[5]中平板计数法的要求对食品冻干粉中霉菌和酵母进行检验,并参照《测量不确定度的要求》(CNAS-CL01-G003:2018)[6]、《食品微生物学测量不确定度评估指南》(SN/T 4091—2015)[7]和《食品微生物定量检测的测量不确定度评估指南》(RB /T 151—2016)[8]中的相关标准和规范要求,评估了检验结果的不确定度,并分析与评定了各不确定度分量的影响。为实验室进行食品中霉菌和酵母计数结果的准确测定提供科学参考。
1 材料与方法
1.1 材料与试剂
霉菌和酵母食品冻干粉(特性值:290 CFU·mL-1),中国检验检疫科学研究院测试评价中心;孟加拉红琼脂培养基,广东环凯微生物科技有限公司;氯化钠,广东广试试剂科技有限公司。
1.2 仪器与设备
GB85DR高压灭菌器,致微(厦门)仪器有限公司;霉菌培养箱,上海一恒科学仪器有限公司;生物安全柜,赛默飞世尔(上海)有限公司。
1.3 试验方法
1.3.1 样品制备
食品冻干粉的使用:无菌开启西林瓶,样品开启后,随即添加5 mL无菌生理盐水重新水化冻干粉,待冻干粉溶解后,将溶液转移至无菌三角瓶内,然后用剩余的无菌生理盐水反复冲洗西林瓶的内壁,并将清洗液回收至上述无菌三角瓶内,此溶液即为待测样品原液,等同于60 mL的食品样品。
1.3.2 检验检测
依据《食品安全国家标准 食品微生物学检验霉菌和酵母计数》(GB 4789.15—2016)[5]中的第一法霉菌和酵母平板计数法进行操作。使用10 mL无菌吸管从1.3.1制备的样品中吸取25 mL溶液至装有225 mL无菌生理盐水的三角瓶内,振摇均匀后制得1∶10的样品匀液。使用2 mL的无菌吸管吸取2 mL 1∶10的样品匀液,释放1 mL至装有9 mL无菌生理盐水的试管内,涡旋搅拌均匀后制得1∶100的样品匀液。在进行上述10倍递增稀释操作过程中,分别吸取1 mL每个稀释度的样品匀液(包括原液)至2个无菌平皿中。同时各吸取1 mL无菌生理盐水至2个无菌平皿中作为空白对照。在制备好的平皿中倾注20~25 mL保温至50 ℃的孟加拉红琼脂,并转动平皿混均。随后正置在水平台上待培养基冷却至完全凝固后,正置在(28±1)℃培养箱内进行培养,培养到第5天时对结果进行观察和记录。在实验条件相对不变的情况下对该样品进行10次重复检测。
1.3.3 结果计算
选取单个平皿上菌落数分布于10~150 CFU的相同稀释度的2个平皿进行计数,计数结果计算公式为

式中:N为样品的菌落数,CFU;∑C为计数平板的菌落数之和(CFU);n为计数平板个数;d为稀释因子。
2 结果与分析
2.1 不确定度来源分析
根据不确定度来源的分析,本实验对称样制备、稀释、加样体积、培养基的菌落生长率以及重复测量的不确定度分量进行分析,详见表1。

表1 霉菌和酵母计数测量不确定度的主要来源表
2.2 不确定度评估
2.2.1 样品制备、稀释及加样中产生的不确定度
本次实验选取稀释因子为10-1的平板结果进行计数报告,主要涉及样品原液的制备和225 mL稀释液的使用,所用的量器为250 mL的量出式量筒和10 mL的流出式分度吸管,加样过程中使用的是2 mL的流出式分度吸管,参照《常用玻璃量器》(JJG 196—2006)[9]中检定规程的规定,20 ℃时,250 mL量筒(量出式)的容量允差是2.0 mL;10 mL移液管(A级)的容量差是0.05 mL;2 mL移液管(A级)的容量允许偏差是0.012 mL,取矩形分布为
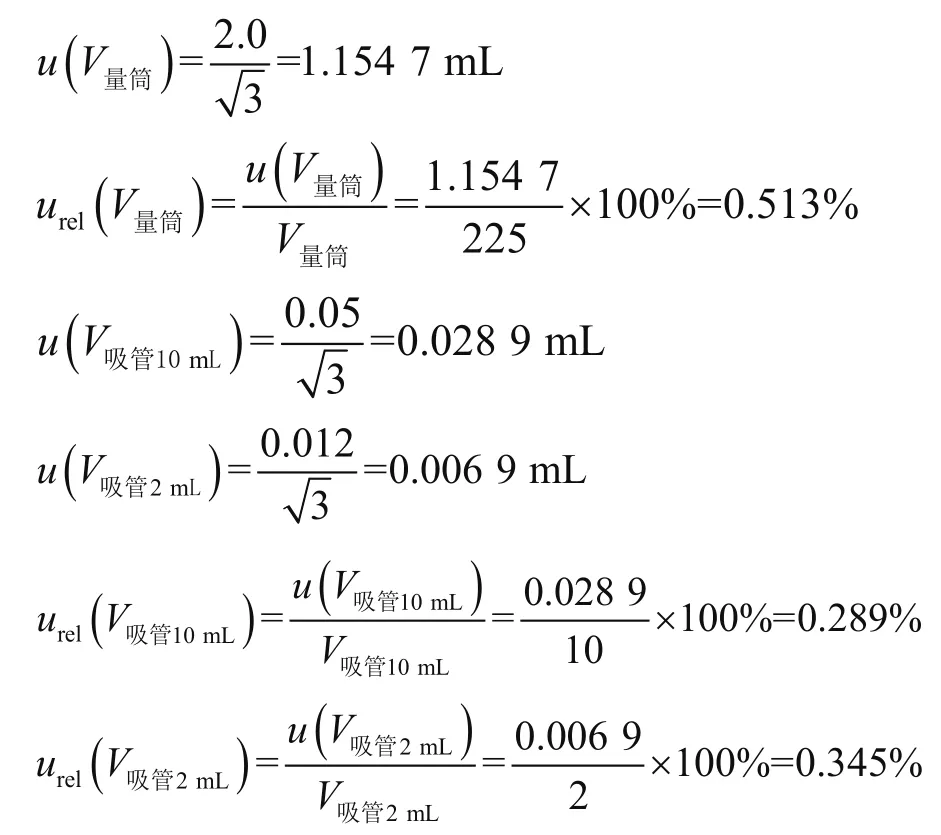
因此,样品稀释过程中所产生的不确定度为

由于该实验是在20 ℃相对恒定的条件下进行的,因此不考虑容量瓶、溶液温度和校准时温度不同所引起的不确定度。若温度不是20 ℃,则需计算温度对体积的影响。
2.2.2 培养基菌落生长率的不确定度
本次实验选用孟加拉琼脂红培养基作为霉菌和酵母计数的平板计数琼脂,该培养基为商品化培养基,根据《食品安全国家标准 食品微生物学检验 培养基和试剂的质量要求》(GB 4789.28—2013)[10]中目标菌半定量划线法获得孟加拉红琼脂培养基的生长指数G,并依据G的大小对培养基的质量进行评价。每个培养皿上的G值最大是16,通过对孟加拉红琼脂进行目标菌半定量划线,得到6批孟加拉红琼脂的G值平均数为14.95,即菌落生长率R为

菌落生长率误差范围为1-0.9344=0.0656,假定菌落生长率服从矩形分布,则其不确定度为

2.2.3 重复性检验的不确定度
在相同条件下,对同一份冻干粉样液进行10次检测,由于10次检测结果发散性较大,故对检验结果取对数后进行不确定度计算,检测结果见表2。由10次检验结果求得的平均值为223 CFU·mL-1,依据GB 4789.15—2016检验结果计数规则,结果采用两位有效数字,故平均值取220 CFU·mL-1进行计算。

表2 样品测量结果表
霉菌和酵母计数结果的对数算术平均值为

单次检验结果的不确定度为

重复性检验结果的不确定度为

2.2.4 检测结果的合成不确定度
检测结果的合成不确定主要由样品稀释过程中所产生的不确定度、菌落生长率的不确定度和重复性检验结果的不确定度进行拟合,结果为

2.2.5 检测结果的扩展不确定度
选取置信概率p为95%,则自由度v=10-1=9,由t分布表可得检测结果的扩展不确定度包含因子k=1.833 1,则扩展不确定度为Urel=k×urel=1.833 1×4.36%=7.99%。
霉菌和酵母计数结果的对数算术平均值=2.342 4,因此,U=Urel×=7.99%×2.342 4=0.187
当检验结果表示为对数的平均值时,其取值区间为±0.187,即2.342±0.187。当检验结果表示为平均值时,检验结果的取值区间分布可通过对数值的取值再取反对数得到,即10(2.342±0.187)CFU·mL-1,故本次实验中测定的霉菌和酵母数量分布于140~340 CFU·mL-1。
3 结论与讨论
本次实验主要对样品、菌落生长率和重复性检验结果的不确定度进行评估,从相对标准不确定度计算的结果对比,培养基菌落生长率引入的不确定度(3.79%)最大,重复性检验(2.04%)次之,样品的制备稀释(0.682%)最小。郭丽艳[11]等通过对能力验证样品中霉菌和酵母的检验结果不确定评估显示,不确定度影响最大的是加样体积;胡婕[12]等通过对面包中霉菌的检验结果不确定度评估显示,不确定度影响最大的是检测过程中的重复性检测,但二者均未对培养基中菌落生长率的不确定度进行评估;赵丽[13]等通过对糕点中菌落总数检验结果的不确定度评估显示,不确定度影响最大的是重复性检验和培养基的菌落生长率,其分析和评估结果与本实验基本一致。因此,对于微生物检测过程中培养基的配制时间、灭菌温度、质量控制等应加强实验室管理,制定相关的作业指导书,保证检测过程中培养基的质量;在样品检验中,应通过加强质量控制,对检测人员应通过人员比对、质控样品等质量控制方式进行质量监督,对天平和常用玻璃器皿等设施设备应定期进行计量校准,平时使用过程中还可通过期间核查的方式进行检查,并严格按照仪器设备的操作规程进行使用,确保仪器设备的准确性,最大程度减少这些分量引入的不确定度。
