三勒浆安全性评价及功能作用研究
2022-11-19莫太刚樊三虎郑有德陈小红孟伦秀骆学庆张立实张定堃
莫太刚 樊三虎 郑有德 陈小红 孟伦秀 骆学庆 张立实 黄 辉 张定堃
(1 成都三勒浆药业集团四川华美制药有限公司,成都,610045; 2 乳品营养与功能四川省重点实验室,成都,610023; 3 成都三勒浆药业集团-成都中医药大学产学研联合实验室,成都,610045; 4 新控国际健康管理有限公司,成都,610045;5 四川大学华西公共卫生学院,成都,610044; 6 成都中医药大学药学院,成都,611137)
三勒浆源于李肇《唐国史补》“三勒浆……法出波斯,三勒者谓庵摩勒、诃梨勒、毗梨勒”,唐代时从丝绸之路传入我国,成为当时的宫廷饮品并延续至今,由使君子科植物诃梨勒(诃子TerminaliachebulaRetz.)和毗梨勒[毛诃子Terminaliabellirica(Gaertn.)Roxb.],与大戟科植物庵摩勒(余甘子PhyllanthusemblicaL.)3种植物果实制作而成[1-2]。“三勒”也称“三果”,3种药材被奉为藏药之王,藏药经典《晶珠本草》和《中国藏药》《中华人民共和国药典》中均有收录[3]。在印度阿育吠陀传统医药文化中,三果(Triphala)是最著名的常用药物之一,也是日常食用的果品和咀嚼料[4]。三勒浆牌三勒浆饮品(以下简称“三勒浆”)是在此基础上辅以L-精氨酸、L-天门冬氨酸、蜂蜜等组成的保健食品,其中所含的多酚类成分可清除人体内的自由基,从而减轻自由基对人体的损伤,使其具有良好的调节免疫及抗疲劳等活性[5-8]。
本研究依据《食品安全性毒理学评价程序和方法》及《保健食品功能学评价程序和检验方法》[9-10],开展口服急性毒性、30 d喂养实验、埃姆斯(Ames)实验、小鼠微核实验、小鼠精子畸形实验研究[11],以及抗疲劳、免疫调节和耐缺氧的功能作用[12-14],为三勒浆作为保健食品的安全性与功效学提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物
1.1.1.1 经口急性毒性动物 2周龄,昆明种小鼠(合格证号:川实动管质第85号),体质量(20±2)g,40只,雌雄各半;6周龄,SD大鼠(合格证号:川实动管质第92号),体质量(200±20)g,40只,雌雄各半,均由四川省抗菌素工业研究所提供。
1.1.1.2 30 d喂养实验动物 6周龄,SD大鼠(合格证号:川实动管质第92号),体质量90~130 g,80只,雌雄各半,由四川省抗菌素工业研究所提供。
1.1.1.3 小鼠骨髓细胞微核实验动物 4周龄,雄性昆明种小鼠(合格证号:川实动管质第85号),体质量25~30 g,50只。
1.1.1.4 小鼠精子畸形实验动物 4周龄,雄性昆明种小鼠(合格证号:川实动管质第85号),体质量25~30 g,雌雄各半,25只。
1.1.1.5 抗疲劳功能评价实验动物 2周龄,成年雄性昆明小鼠(合格证号:川实动管质第98-6号),200只,由原卫生部生物制品研究所提供。
1.1.1.6 免疫调节功能实验动物 2周龄,雌性BALB/C小鼠(合格证号:川实动管质第64号),体质量(20±2)g,250只,雌雄各半,由华西医科大学实验动物中心提供。
1.1.1.7 耐缺氧功能评价实验动物 2周龄,昆明种小鼠(合格证号:川实动管质第67号),体质量(20±2)g,160只,由四川省抗菌素工业研究所提供。
1.1.1.8 饲养环境及条件 以上清洁级动物均常规饲养于洁净动物房(合格证号:川实动管81号),并提供动物全价基础营养饲料,动物自由摄食和饮水。
1.1.2 样品 三勒浆样品由四川华美制药有限公司提供(批号:9904009)。
1.1.3 试剂与仪器 丝裂霉素C(MMC,中国食品药品检定研究院,批号:19980706)、2-胺基芴(2-AF,上海皓鸿生物医药技术有限公司,批号:19980523),TA97、TA98、TA100、TA102:(美国分子毒理有限公司,批号:19981103)、环磷酰胺(CP,上海卓因生物医学技术有限公司,批号:19981101)、2,4,7-三硝基-9-芴酮(TNFone,上海皓鸿生物医药技术有限公司,批号分别为19971208、19980318)、叠氮化钠(科密欧化学试剂有限公司,批号分别为19980325)、动物肝细胞S-9混合液(无锡欣润生物科技有限公司,批号:19981106)、乙醚(成都科隆化学试剂厂,批号:19980612)、钠石灰,凡士林,亚硝酸钠(成都科隆化学试剂厂,批号分别为19980919、19980821、1998052)、绵羊红细胞(Sheep Red Blood Cel,SRBC)采自健康绵羊颈静脉、鸡培养红细胞(Cultured Red Blood Cell,cRBC)采自健康公鸡心脏血。希森美康血液分析仪(上海恺梵实业有限公司,型号:XT-2000i);电子秤(上海大和衡器常厂,型号:ACS-3);切片机(赛默飞公司,美国,型号:HM325)、自动组织包埋机(江苏常州中威电子仪器厂,型号:BMJ-Ⅲ)、病理组织漂烘仪[普瑞斯星(常州)医疗器械有限公司,型号:PHY-Ⅲ型];Nikon显微镜(上海衡浩仪器有限公司,型号:eclipse80i);酶标分析仪(上海第三分析仪器厂,型号:511)。
1.2 方法
1.2.1 安全性实验方法
1.2.1.1 急性毒性实验方法 霍恩法(Horn)小鼠和SD大鼠均按4.64、10.0、21.5 mL/kg系列剂量,给药1次,灌胃后连续观察2周。
1.2.1.2 30 d喂养实验方法 断乳SD大鼠,依据体质量按照随机数字表法随机分为4组(下同),每组20只,雌雄各半。低剂量组、中剂量组、高剂量组每日分别按2.5、5.0、10 mL/kg灌胃给三勒浆,共30 d。另设一空白对照组(剂量为0)。测定实验期内动物的每周饲料给料量和剩余量、体质量,计算摄食量、平均增重和食物利用率。实验结束后,进行血液学、血清生化及组织病理学的检查和脏器系数(器官对体质量的相对重量)测定。
1.2.1.3 Ames实验方法 按《食品安全性毒理学评价程序和方法》以TA97、TA98、TA100和TA102实验菌株进行加与不加大鼠肝S9的标准平板渗入法。实验样品设5个剂量:12.5、25.0、50、100、200 μL/皿。每次实验同时设阴性(蒸馏水100 μL/皿)和阳性对照。不加S9的阳性对照:TA97和TA98用TNFone,TA100用NaN3,TA102用MMC;加S9实验的阳性对照均用2-AF。每个实验剂量作3个平行皿,重复实验2次。
1.2.1.4 小鼠微核实验方法 昆明种小鼠按体质量随机分为5组,每组10只,雌雄各半。三勒浆2.5 mL/kg组、5.0 mL/kg组和10.0 mL/kg组;阴性对照组蒸馏水灌胃;阳性对照组,给环磷酰胺40 mg/kg。分别于第0小时和第24小时2次经口给药,第30小时处死小鼠,取胸骨骨髓制片,固定后染色,镜下观察1 000个嗜多染红细胞,记录带微核的细胞数。
1.2.1.5 小鼠精子畸形实验方法 雄性昆明种小鼠每组5只,共5组。3组三勒浆剂量:2.5、5.0和10.0 mL/kg;阴性对照组,蒸馏水灌胃;阳性对照组,给环磷酰胺40 mg/kg。灌胃给三勒浆5 d,于首次灌胃后第35天处死动物,取双侧附睾作精子涂片,固定后染色,镜下观察精子形态。每支动物观察1 000精子,记录形态异常的精子数。
1.2.2 抗疲劳功能实验方法 成年雄性昆明种小鼠,按体质量随机分为4组,即蒸馏水对照组和三勒浆2.5 mL/kg组、三勒浆5.0 mL/kg组、三勒浆10.0 mL/kg组(分别相当于推荐人体饮用量的5、10、20倍)。各组均按2%体积每天灌胃,连续30 d。于末次灌胃30 min后,分别进行负重游泳实验(小鼠尾部负重5%铁丝)、血清尿素氮、肝糖原、血乳酸含量测定。
1.2.3 免疫调节功能实验方法
1.2.3.1 动物分组与给药 雌性小鼠,基础饲料喂饲3 d后,按体质量随机分为三勒浆5.0 mL/kg组、三勒浆10.0 mL/kg组和三勒浆15.0 mL/kg组(分别相当于厂方推荐的成人日食用量的10、20和30倍及对照组,实验动物以相应剂量的三勒浆灌胃,对照组以蒸馏水灌胃,1次/d,连续灌胃25 d。
1.2.3.2 迟发性变态反应(足趾增厚法) 连续灌胃20 d后,用2%(v/v)SRBC腹腔免疫,每只0.2 mL,免疫4 d后,测量左后足趾部厚度,测定3次取平均值;然后在测量部位皮下注射20%(v/v)SRBC,每只20 μL注射后于24 h测量左后足趾部厚度,测定3次取平均值。计算攻击前后足趾厚度的差值,以差值表示小鼠的迟发性变态反应的程度,并进行统计学处理。
1.2.3.3 血清溶血素测定(血凝法) 连续灌胃20 d,每只小鼠腹腔注射2% SRBC 0.2 mL免疫,继续灌胃4 d后,摘除眼球取血于离心管内,放置1 h,剥离,2 000 r/min,离心半径16 cm,离心10 min,收集血清,用生理盐水将血清进行倍比稀释,每份稀释14孔,将不同稀释度的血清置于血凝板中,每孔100 μL,再加入0.5% SRBC悬液100 μL,混匀,置湿盒37 ℃ 3 h,观察结果,记录每孔的凝集程度,按公式计算抗体积数(抗体积数=S1+2S2+3S3+……nSn),并进行统计学处理。
1.2.3.4 小鼠腹腔巨噬细胞吞噬鸡红细胞实验(半体内法) 连续灌胃25 d后,于每鼠腹腔注射20%鸡红细胞悬液1 mL,30 min后,颈椎脱臼处死,将其固定在鼠板上,正中剪开腹壁皮肤,经腹腔注入生理盐水2 mL,转动鼠板1 min,吸出腹腔洗液1 mL,平均滴于2张载玻片上,置湿盒37 ℃ 30 min,取出在生理盐水中漂洗,晾干,固定,4%吉姆萨染色3 min,蒸馏水漂洗晾干,镜检。按公式计算吞噬百分率及吞噬指数,进行统计学处理。
1.2.3.5 自然杀伤细胞活性测定 连续灌胃25 d后,颈椎脱臼处死动物,取出脾脏,撕碎,过200目筛网后,用汉克平衡盐溶液洗3次,用完全1640培养液配成5×106个/mL细胞悬液。将各只鼠的细胞悬液取300 μL分置于96孔培养板中,每孔加靶细胞(YAC-1细胞,1×105个/mL)100 μL,同时做靶细胞自然释放孔(靶细胞100 μL+培养液100 μL)及最大释放孔(靶细胞100 μL+1% NP-40 100 μL)各3孔,37 ℃ 5% CO2培养4 h,取出1 500 r/min,离心半径16 cm,离心5 min。将各孔上清液100 μL置于另一培养板中,每孔再加入100 μL基质液,10 min后加入1 mol/L HCl 30 μL终止反应,在490 nm处测定吸光度值,按公式计算自然杀伤细胞活性,并进行统计学处理。
1.2.4 耐缺氧功能实验方法
1.2.4.1 常压耐缺氧实验 小鼠按体质量随机分为5 mL/kg组、10 mL/kg组、15 mL/kg组(相当于人体推荐食用量的10、20、30倍)及对照组。各剂量组每日经口灌胃相应浓度的三勒浆,对照组灌胃等量蒸馏水,连续30 d。末次灌胃后1 h,将各组小鼠分别放入盛有15 g钠石灰的250 mL磨口广口瓶内(每瓶1只),用涂有适量凡士林的瓶塞盖紧瓶口,立即计时,以呼吸停止为指标,观察记录小鼠因缺氧而死亡的时间。
1.2.4.2 急性脑缺血性缺氧实验 小鼠按体质量随机分为上述4组。各剂量小鼠每日经口灌胃相应浓度的三勒浆,对照组灌胃等量蒸馏水,连续30 d。末次灌胃后1 h,各组小鼠在乙醚浅麻醉的情况下自颈部逐只断头,立即计时,观察记录小鼠断头后至张口喘气停止时间。
1.2.4.3 亚硝酸钠中毒存活实验 小鼠按体质量随机分为上述4组。各剂量小鼠每日经口灌胃相应浓度的三勒浆,对照组灌胃等量蒸馏水,连续30 d。末次灌胃后1 h,各组小鼠均腹腔注射亚硝酸钠220 mg/kg立即计时,观察记录小鼠死亡的时间。

2 结果
2.1 安全性实验结果
2.1.1 口服急性毒性实验结果 在整个观察期内,无论小鼠或大鼠,各三勒浆组均无动物死亡,三勒浆对小鼠和大鼠的经口半数致死剂量均大于21.5 mL/kg。
2.1.2 30 d喂养实验结果 经过30 d喂养实验后,各组动物平均增重和食物利用率测定测定结果:三勒浆给药各组平均增重和食物利用率与对照组比较差异均无统计学意义(均P>0.05)。见表1。血液学指标白细胞计数、红细胞计数、血红蛋白和血小板含量三勒浆给药各组与对照组比较均差异无统计学意义(均P>0.05)。见表2。血糖、胆固醇、三酰甘油和肝肾功能实验等所检测的10项血清生化指标,三勒浆给药各组测定值与对照组间差异均无统计学意义(均P>0.05)。见表3。脏器系数结果:与对照组比较,差异均无统计学意义(均P>0.05)。大体解剖结果,三勒浆给药各组动物未见异常。对心、肝、肾、胃、肠等器官的组织病理学镜检,三勒浆给药各组也未见任何具有病理学意义的改变。见表4。

表1 三勒浆灌胃30 d对大鼠平均增重和食物利用率的影响

表2 三勒浆灌胃30 d对大鼠血液学指标的影响

表3 三勒浆灌胃30 d对大鼠血清生化指标的影响

表4 三勒浆灌胃30 d对大鼠脏器系数的影响
2.1.3 Ames实验结果 无论加与不加S9混合液的实验,阳性对照组皿的平均回变菌落数(+S9,TA102除外)均大于阴性对照组(剂量0)的2倍;而实验样品各剂量组的平均回变菌落数与阴性对照组相近。见表5。

表5 三勒浆每皿回变菌落数个/皿)
2.1.4 小鼠骨髓细胞微核实验结果 小鼠骨髓细胞微核实验结果。阳性对照组的平均微核出现率明显高于阴性对照组(P<0.01),三勒浆各剂量组的微核率与阴性对照组差异无统计学意义。见表6。
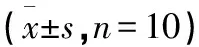
表6 三勒浆小鼠微核实验结果
2.1.5 小鼠精子畸形实验结果 小鼠精子畸形实验结果:阳性对照组的平均精子畸形率明显高于阴性对照组(P<0.01),而三勒浆各剂量组与阴性对照组比较,差异无统计学意义(P>0.05)。见表7。

表7 三勒浆精子畸形实验结果(n=5)
2.2 抗疲劳作用结果 负重游泳实验、血清尿素氮、肝糖原与血乳酸含量实验结果:对照组小鼠的平均游泳时间仅为(6.70±2.26)min,灌胃三勒浆30 d后,各剂量组均能显著延长小鼠的负重游泳时间(P<0.01),且三勒浆10.0 mL/kg组效果最优,平均负重游泳时间接近0.5 h,约为对照组的5倍。血清生化指标表明,服用三勒浆后,各剂量给药组小鼠血清尿素氮含量显著低于对照组,肝糖原含量明显高于对照组,血乳酸含量显著低于对照组。见表8。

表8 三勒浆对抗疲劳实验结果
2.3 免疫调节作用结果 三勒浆对小鼠迟发性变态反应的影响结果、对小鼠血清溶血素的影响结果、对小鼠巨噬细胞吞噬功能的影响结果、对小鼠自然杀伤细胞活性的影响结果:在小鼠迟发变态反应实验中,与对照组比较,三勒浆10.0 mL/kg组和三勒浆15.0 mL/kg组小鼠的足趾肿胀度差异有统计学意义(P<0.01)。在血清溶血素实验中,各剂量组与对照组比较,其抗体积数差异均有统计学意义(均P<0.01)。在小鼠腹腔巨噬细胞吞噬鸡红细胞实验中,三勒浆10.0 mL/kg组和三勒浆15.0 mL/kg组与对照组比较,其吞噬百分率及吞噬指数差异均有统计学意义(P<0.01)。在自然杀伤细胞活性实验中,各剂量组与对照组比较,其自然杀伤细胞活性差异均无统计学意义(均P>0.05)。见表9。

表9 三勒浆对小鼠免疫调节的影响
2.4 耐缺氧作用结果 三勒浆对小鼠常压耐缺氧时间的影响:给予小鼠三勒浆30 d后,各三勒浆剂量组小鼠的常压耐缺氧时间均有增加趋势,但差异无统计学意义。但三勒浆对小鼠急性脑缺血性缺氧时间有明显影响,3个剂量小鼠的急性脑缺血性缺氧时间与对照组比较均有显著延长(P<0.05或P<0.01)。见表10。三勒浆对小鼠亚硝酸钠中毒存活时间的影响结果:给予三勒浆30 d后,三勒浆10.0 mL/kg组、三勒浆15.0 mL/kg组小鼠的亚硝酸钠中毒存活时间与对照组比较显著延长(P<0.05或P<0.01)。见表11。

表10 三勒浆对小鼠耐缺氧时间的影响

表11 三勒浆对小鼠亚硝酸钠中毒存活时间的影响
3 讨论
按照评价依据:三勒浆对小鼠和大鼠的经口半数致死剂量都大于21.5 mL/kg,急性毒性属实际无毒(级);大鼠30 d喂养实验的无作用剂量大于10.0 mL/kg;3项遗传毒性实验均为阴性结果;三勒浆具有明显的抗疲劳作用、具有免疫调节和耐缺氧作用[9-10]。
本研究证实了三勒浆具有很好的安全性和确切的抗疲劳、免疫调节和耐缺氧作用,这也为传统经典名方三果汤散(Triphala)的现代开发以及中药保健食品走向世界提供了科学依据[15]。基于本实验研究当时是依据首次颁布的保健食品毒理学及功能学评价程序,经过20余年的科技进步,保健食品注册法规体系不断完善和修订[16-18]。三勒浆历经30余年的市场检验,受众易疲劳者、免疫力低下者及处于缺氧环境者,获得良好口碑。但目前我们对疲劳的分类、疲劳与抗疲劳的机制处于探索阶段,近期研究从细胞能量代谢的角度来建立疲劳的细胞模型,以解决快速筛选疲劳组分的方法,为抗疲劳功能保健食品研发提供新思路[19-20]。鉴于三勒浆中植物成分的复杂性,特别富含多酚类成分,具有广泛活性的特点,尚需深入研究其特征活性成分与疲劳的相关性,为抗疲劳作用提供理论支撑。
