余甘子加工沉淀固废物中活性成分鉴定与提取工艺优化
2022-11-19李格菲谭庆刍林俊芝罗传红樊三虎曹志坚张定堃黄浩洲
李格菲 谭庆刍 林俊芝 罗传红 樊三虎 曹志坚 张定堃 黄浩洲 韩 丽
(1 成都中医药大学药学院/创新产业研究院,西南特色中药资源国家重点实验室,成都,611137; 2 成都中医药大学附属医院,代谢性疾病中医药调控四川省重点实验室,成都,610072; 3 成都市三勒浆药业集团四川华美制药有限公司,成都,610045; 4 楚雄州百草岭药业发展有限公司,昆明,650031)
余甘子PhyllanthusemblicaL.是大戟科叶下珠属植物,其成熟果实余甘子,亦称油柑子、滇橄榄、山油甘、庵摩勒等[1]。余甘子风味独特、营养丰富、保健功能显著,具有清热凉血,消食健胃,生津止咳等功效,在降糖、调节血脂代谢、预防牙龈炎等方面作用突出[2-3],是极具特色的中藏药传统药材及药食同源品种,具有较高的大健康产品与食品开发价值[4]。
余甘子鲜汁系余甘子鲜果直接压榨而成,是余甘子产品的重要形式,也是开发相关饮片及提取物的重要原料[5]。据余甘子相关生产企业调查,仅云南省境内,余甘子鲜汁半年生产周期产量已达3 500吨,预计次年年产量将突破15 000吨。然而,余甘子鲜汁在贮存过程中会产生大量乳白色或灰白色沉淀,约占鲜汁总质量的5%~20%。目前,相关保健品或饮料生产企业均对该类沉淀物缺乏相应的研究与认识,并将之视为生产固废物,主要采用生物氧化等方式对其进行无害化处理[4]。该处理方法不仅面临巨大的生态环境压力,还会造成资源浪费与生产成本的增加。为进一步合理利用资源,急需寻找新的解决途径。
课题组前期研究显示,余甘子鲜汁沉淀中除大量植物组织残渣、杂质外,还含有大量鞣花酸,天然丰度10%左右[6]。以此估算,沉淀物中鞣花酸资源蕴藏量极高,极具开发潜力。鞣花酸是没食子酸的二聚衍生物,具有抗氧化、抗癌变、抗诱变、抗炎、抗菌和抗病毒等作用[7],被广泛应用于食品、医药、医疗和化妆品等领域[8-9]。目前,鞣花酸主要是五倍子浸出液水解制得的,其资源有限,粗提物每吨售价20万元以上[10]。而合成法因制备工艺复杂,存在杂醌类物质而较少使用[11]。余甘子固废物沉淀鞣花酸天然含量可达7%~10%以上,单个药企年产量可达数吨到数十吨,资源蕴藏量十分可观,有望成为潜在的鞣花酸新来源。据此,本研究首先采用超高效液相色谱与串联四极杆飞行时间质谱联用技术(Ultra-performance Liquid Chromatography to Quadrupole Time-of-flight mass Spectrometry,UPLC-Q-TOF-MS)结合傅里叶变换红外(Fourier Transform Infrared,FT-IR)光谱仪、扫描电镜等,对余甘子鲜汁沉淀物的物质基础进行分析。其次,基于沉淀物的物质构成以及鞣花酸的性质,采用醇提、酶提、碱溶酸沉法提取鞣花酸。以鞣花酸的含量、纯度、外观为指标,对鞣花酸的提取方法、提取工艺进行了优化与评价。上述研究旨在基于精细高值资源化模式,辨识余甘子鲜汁沉淀物的化学构成,优化鞣花酸富集工艺,在实现其潜在价值的同时有望降低因处理加工固废物所产生的碳排放。为构建余甘子高品质、超循环的全产业链产品体系,实现开源节流、绿色生产,推进余甘子全产业链发展提供一定参考。
1 仪器与试药
1.1 仪器 十万分之一分析天平(Sartorius公司,德国,型号:BT25S),万分之一分析天平(Sartorious公司,德国,型号:BSA224S),高效液相色谱仪(岛津公司,日本,型号:LC-20AT),Milli-Q超纯水仪(Millipore公司,美国,型号:UPR-11-5T),扫描电镜(赛默飞公司,美国,型号:FEI Insepect F50),EDAX OCTANESUPER能谱仪(依达克斯有限公司,美国,型号:SEM5000),数控超声仪(昆山市超声仪器有限公司,型号:KQ-500DE),傅里叶变换红外光谱仪(赛默飞Nicolet公司,美国,型号:IS 50),高分辨飞行时间质谱仪(Water公司,美国,型号:SYNAPT XS),高速冷冻离心机(四川蜀科仪器有限公司,型号:TGL-16)。
1.2 试剂 鞣花酸对照品(四川维克奇生物科技有限公司,批号:wkq21010403,质量分数≥98%),纤维素酶(上海源叶生物科技有限公司,货号:S10041-5g,500 U/mg),果胶酶(上海源叶生物科技有限公司,货号:S10007-5g,50 U/mg),甲醇(Sigma公司,美国,货号:WXBD7361V),磷酸(Sigma公司,美国,货号:WXBD2060V),氢氧化钠(成都市科隆化学品有限公司,批号:20110715),盐酸(四川西陇科学有限公司,批号:2106081),乙醇(成都市科隆化学品有限公司,批号:2021082302)。
1.3 分析样品 余甘子鲜汁沉淀物(成都市三勒浆药业集团四川华美制药有限公司提供),经真空干燥后粉碎过三号筛备用。
2 方法
2.1 沉淀FT-IR分析 取溴化钾于玛瑙研钵中,在红外烤灯下研磨成细粉;转移至压片模具中,将模具置于压片机中压实,得半透明薄片,即溴化钾空白片。取余甘子鲜汁沉淀物粉末适量,与溴化钾在玛瑙研钵中研磨,压片制成样品片,将样品片置于红外光谱仪中,扫描得到样品片的一维红外光谱。
2.2 沉淀UPLC-Q-TOF-MS分析
2.2.1 色谱条件 色谱柱Thermo Scientific Accucore C18柱(100 mm×2.1 mm,2.6 μm);流动相0.1%甲酸水(A)-乙腈(B),梯度洗脱(0~1 min,2%B;1~2 min,2%~5%B;2~4 min,5%~7%B;4~6 min,7%~24%B;6~10 min,24%~42%B;10~12 min,42%~54%B;12~15 min,54%~76%B;15~18 min,76%~100%B);流速0.2 mL/min;柱温30 ℃;进样量5 μL[12]。
2.2.2 质谱条件 采用加热电喷雾离子源(Heated Electric Spray Ion,HESI),在正、负离子模式条件下进行检测。具体参数设置如下:喷雾电压3.5 kV(+)/3.0 kV(-),离子源温度350 ℃,鞘气流速35 arb,辅助气流速10 arb,离子传输管温度320 ℃,离子扫描范围 m/z 100~1 500,碰撞能量梯度为20、40、60 eV。
2.2.3 供试品溶液制备 鲜汁沉淀物:精密称定干燥后的沉淀物粉末10 mg,置于250 mL棕色容量瓶中并用甲醇定容,称定质量,超声30 min(300 W,40 kHz),放冷,加甲醇补足减失的质量,摇匀,过0.22 μm微孔滤膜,即得。
2.2.4 数据分析及成分分析 将采集得到的原始数据导入Compound Discoverer 3.1质谱数据处理软件中,建立未知化合物鉴定的工作流程,设置一级及二级质量偏差<5×10-6,进行峰提取、峰对齐。根据一级准分子离子峰质荷比获得精确质量数及化合物分子式,结合二级碎片离子信息、MassFrontier软件、mzCloud网络数据库、mzVault本地中药成分数据库、文献报道及部分对照品比对,进行化合物的分析鉴定。
2.3 沉淀物中鞣花酸的提取纯化工艺优选
2.3.1 醇提法 精密称定沉淀物粉末20 g,配置60%乙醇溶液,按照料液比1∶30(g/mL),于60 ℃条件下回流提取80 min,提取3次,于50 ℃水浴中用旋转蒸发仪蒸干溶剂,取沉淀,水洗3次后干燥粉碎。
2.3.2 酶提法 精密称定沉淀物粉末20 g,配置质量浓度为2%的复合酶(纤维素酶与果胶酶质量比为2∶1)水溶液,设置料液比1∶30(g:mL),酶解温度60 ℃,并使用1 mol/L盐酸溶液调节pH值至4,放入恒温振荡箱中(80 r/min),酶解反应4 h,离心取沉淀,水洗3次后干燥粉碎。
2.3.3 碱溶酸沉法 精密称定沉淀物粉末20 g,以料液比1:50(g:mL)加入1 mol/L的NaOH溶液,超声(300 W,40 kHz,30 min)并离心(3 000 r/min,离心半径6 cm,离心5 min),取上清液,加入1 mol/L HCl调节pH值至3,离心(3 000 r/min,离心半径6 cm,离心5 min),取沉淀,水洗3次后干燥粉碎。
2.4 鞣花酸含量测定
2.4.1 色谱条件 色谱柱Welchrom C18柱(4.6 mm×250 mm,5 μm);流动相0.2%磷酸水溶液(A)-甲醇(B),梯度洗脱(0~6 min,5%B;6~15 min,5%~7%B;15~20 min,7%~15%B;20~25 min,15%~21%B;25~31 min,21%~22%B;31~41 min,22%B;41~47 min,22%~28%B;47~51 min,28%~32%B;51~57 min,32%~38%B;57-70 min,38%~45%B;70~80 min,45%~65%B);检测波长270 nm;体积流量1.0 mL/min;柱温25 ℃;进样量10 μL[13]。
2.4.2 对照品溶液的制备 精密称取鞣花酸对照品适量,置于10 mL棕色容量瓶中,加甲醇定容至刻度制成浓度为99 μg/mL的鞣花酸对照品溶液。称定质量,超声30 min使溶解,静置冷却至室温,加甲醇补足减失的质量,摇匀,过0.22 μm微孔滤膜,即得。
2.4.3 供试品溶液的制备 鲜汁沉淀物:制备方法同2.2.1项下。鞣花酸提取物:制备方法同2.2.1项下。
2.4.4 精密度实验 取2.4.2项下制备的鞣花酸对照品溶液适量,按2.4.1项下色谱方法条件连续进样6次,计算相对标准偏差(Relative Standard Deviation,RSD)。
2.4.5 线性关系考察 将“2.4.2”项下制备的鞣花酸对照品溶液,按照“2.2.1”项下色谱条件进样,进样体积分别为3、5、7、10、13、15 μL,以峰面积为纵坐标(Y),对照品质量浓度为横坐标(X),绘制标准曲线。
2.4.6 重复性实验 取同一批果汁沉淀粉末,按“2.4.3”项下方法平行制备供试品溶液6份,按照色谱方法条件进行测定,计算RSD。
2.5 扫描电镜-能谱仪检测 采用扫描电子显微镜(Scanning Electron Microscope,SEM)对余甘子鲜汁沉淀粉末、鞣花酸提取物粉末进行表面微观分析。分别取干燥后的样品粉末,将样品粉末均匀分布于导电胶表面,用洗耳球吹去小颗粒,采用真空镀膜法在4 Pa以下高真空、电流20 mA条件下喷镀铂金属2 min使样品导电。仪器的加速电压为10.0 kV,工作距离为9.8 mm。在扫描电镜1 000倍镜下,联用能谱仪对余甘子果汁沉淀进行表面元素分析。
3 结果
3.1 沉淀粉末元素分析 在扫描电镜5 000倍镜下,联用能谱仪对供试品表面元素进行分析。见图1。元素分析结果发现,沉淀中C元素相对含量为43.08%,O元素相对含量为53.85%,为主要元素,还含有少量的Cl,K等其他元素。见表1。
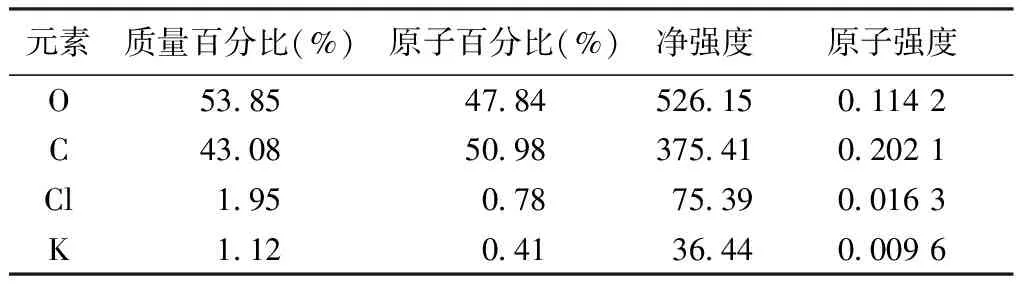
表1 沉淀物主要元素占比
3.2 FT-IR结果分析 由沉淀的FT-IR谱图可见,在3 288.175 0~3 417.387 0、1 720.265 0、1 452.197 0~1 621.909 0、1 118.558 0、1 059.737 0、919.917 5、667.277 6 cm-1处检查到主要吸收峰度,其中3 288.175 0~3 417.387 0 cm-1是酚羟基拉伸振动吸收峰,1 720.265 0 cm-1可能为芳香酮振动吸收峰,1 452.197 0~1 621.909 0 cm-1为苯环骨架振动吸收峰,1 118.558 0、1 059.737 0 cm-1为C-O伸振动吸收峰,919.917 5 cm-1可能是OH弯(面内)振动吸收峰,667.277 6 cm-1可能是NH2振动吸收峰。见图2。
3.3 沉淀化合物的分析与鉴定 从余甘子鲜汁沉淀物中共鉴定出12种化合物。见表2。由表2信息可知,余甘子原汁沉淀中鞣花酸占比为39.91%,为沉淀中天然丰度最高的物质。其次,较高含量的为没食子酸、柠檬酸、苹果酸。此外,还检测到一些氨基酸,例如脯氨酸、谷氨酸、异亮氨酸。

表2 沉淀物化学成分分析
3.4 鞣花酸提取工艺筛选与优化
3.4.1 方法学考察 1)精密度考察:各色谱峰相对保留时间的RSD值均<0.1%,相对峰面积的RSD均在2.0%之内,表明仪器的精密度良好。2)线性关系考察:由“2.4.5”项下方法得到鞣花酸线性回归方程为:Y=9.141 1X+13.471(R2=0.999 2)。结果表明鞣花酸浓度在29.7~148.5 μg/mL内线性关系良好。3)重复性试验:各色谱峰相对保留时间的RSD均<0.1%,相对峰面积的RSD均在2.0%之内,提示本方法重复性良好。
3.4.2 纯化工艺筛选 结果显示了工艺1(醇提法),工艺2(酶提法),工艺3(碱溶酸沉法)3种工艺提取制备得到的鞣花酸粗品的色谱图,可直观看出工艺3对鞣花酸的提取纯化效果显著,因此确定较优工艺为碱溶酸沉法。见图3。
3.4.3 碱溶酸沉法工艺优化 1)料液比。设置氢氧化钠溶液浓度为1.5%,超声提取30 min。设置料液比分别为1∶20,1∶30,1∶40,1∶50。考察不同料液比对鞣花酸含量的影响。由图4A可以看出,料液比对鞣花酸含量有显著影响。鞣花酸含量随料液比增加呈现先增高后降低的趋势。料液比为1∶40时,鞣花酸含量最高。当鞣花酸完全溶出后,进一步增加溶剂体积,鞣花酸含量不但不会增加,且还可能由于体积过大,鞣花酸分子分散程度高,不利于后续酸性条件下鞣花酸结晶的析出,呈现下降趋势。因此,确定较优的料液比为1∶40。2)超声提取时间。设置料液比为1∶40,氢氧化钠溶液浓度为1.5%。设置超声提取时间分别为10 min,20 min,30 min,40 min。考察不同超声提取时间对鞣花酸含量的影响。图4B为超声时间对鞣花酸含量的影响。当超声提取时间为20 min时,鞣花酸含量呈最大值。因此,确定较优的超声提取时间为20 min。3)NaOH浓度。设置料液比为1∶40,超声提取30 min。设置氢氧化钠溶液浓度分别为1%,1.5%,2%,2.5%。考察不同NaOH浓度对鞣花酸含量的影响。图4C为NaOH溶液浓度对鞣花酸含量的影响。鞣花酸含量随NaOH浓度增大呈先升高后降低的趋势。氢氧化钠浓度在1%~2%范围内时,随着浓度增加,鞣花酸得率呈增长趋势。当NaOH浓度超过2%时,鞣花酸得率显著降低,这可能与pH值过高导致其他不溶性沉淀溶出,使最终提取物中鞣花酸的含量降低有关。因此,确定2%的NaOH溶液较优。
3.4.4 鞣花酸含量及纯度分析 本研究对鞣花酸的碱溶酸沉提取纯化工艺进行优化,优化得到的工艺参数为:料液比1∶40(g∶mL)提取时间20 min,氢氧化钠浓度2%。由沉淀物的色谱相关数据计算可得,沉淀中鞣花酸的平均天然丰度为20.1%。以优化后的碱溶酸沉工艺对鞣花酸进行提取,通过色谱相关数据计算得到鞣花酸含量为47.38%,纯度(峰占比)为94.22%。
3.5 纯化前后样品表面形态分析 采用扫描电子显微镜对纯化前后的样品粉末进行分析。由图5C和5D可见,沉淀物粉末颜色呈淡黄色,而纯化后的粉末色泽呈深绿色。将提取前的沉淀物粉末与鞣花酸提取物分别置于扫描电镜下(×1 000)观察。由图5E可见,沉淀物粉末中含有大量晶状、纤维状、不规则块状的植物组织。由图5F可见,提取物粉末主要为柱状晶体,且部分聚集成簇状。推测为鞣花酸分子平面聚合形成。
4 讨论
近年来,我国中药制药行业与大健康产业快速发展,已逐渐成为部分地区社会经济发展的重要引擎之一。但中药工业化生产阶段、生产过程中会产生大量固废物,这些固废物由于缺乏有效利用途径而被废弃,不仅造成资源的严重浪费,还伴随大量的碳排放[14]。随着我国“双碳”目标稳步推进,如何实现多层次的中药生产固废物资源化利用模式,降低工业化生产过程中的碳排放,成为亟待解决的问题。
研究表明,实现鞣花酸工业化制备的方法为五倍子单宁酸氧化法,在实际生产中仍存在纯度不高(80%~90%)、耗时长(24~36 h)等突出问题[15]。余甘子果实中鞣花酸含量为0.65%~2.49%[16],由于鞣花酸不溶于水,余甘子鲜汁沉淀中游离鞣花酸自然富集后含量即可达10%左右,是十分理想的鞣花酸天然来源途径。研究根据沉淀物构成特征,初步设计并对比了3种不同的提取纯化工艺。醇提法是依据沉淀物中各组分极性不同,以60%乙醇为提取溶剂,对鞣花酸进行分离[17]。酶提法则是考虑到余甘子鲜汁经鲜果压榨而成,沉淀物中必然包含部分难溶的植物组织。加入适量的纤维素酶及果胶酶,有利于破坏细胞壁、转化不溶性的纤维素等成分,释放非游离鞣花酸[18],提高沉淀物中鞣花酸的纯度。天然鞣花酸呈反式没食子酸单宁结构,为浅黄色粉末,常温虽下不溶于水,却溶解于碱性溶液[19],降低pH值至酸性后又会沉淀产生鞣花酸结晶,因此还采用了碱溶酸沉法。以提取物中鞣花酸含量为指标,发现碱溶酸沉法为较优工艺。进一步对碱溶酸沉法中关键工艺参数——料液比、提取时间及碱浓度进行优化[10],最终得到一个较理想的鞣花酸提取纯化工艺。
研究以余甘子鲜汁沉淀为原料,优化得到的鞣花酸提取纯化工艺流程简易、成本低廉、有望实工业化且最终含量及纯度均较为可观。但化妆品、食品、医疗等领域,对鞣花酸的纯度及色泽等还具有更为严格的要求,目前的生产工艺还需进一步优化[20]。本研究充分利用了余甘子生产产生的固废物,实现变“废”为宝,且鞣花酸富集过程中,涉及到电能、热能、有机溶剂均消耗较低,总体碳排放量较低,不仅提高了余甘子相关产业附加值,也为进一步合理利用资源,节能减排,构建余甘子资源综合循环利用的全产业链产品体系提供参考。
