基于高通量测序技术研究栽培苍术根际土壤微生物变化
2022-11-18牛俊峰陈利军王世强董忠民王喆之
徐 燕 牛俊峰 陈利军 王世强 董忠民,2 王喆之
(1西北濒危药材资源开发国家工程实验室,710119,中国陕西西安;2圣玛丽大学生物系,B3H3C3,加拿大新斯科舍哈利法克斯)
苍术为菊科多年生植物,分为茅苍术[Atractylodes lancea(Thunb.)DC.]和北苍术[Atraetylodes chinensis(DC.)Koidz.],主要分布于我国东北、华北及安徽、江苏、河南、陕西和湖北等地。苍术的干燥根茎可入药,具有燥湿健脾和祛风散寒的功效,临床上用于治疗脘腹胀满、湿阻中焦、风寒感冒、风湿痹痛和眼目昏涩等症。多地地方植物志对其均有收录,《中华人民共和国药典》[1]也将其收入书中。
随着自然环境的破环,野生苍术资源越来越少,人工种植苍术成为发展趋势[2]。而目前人工种植苍术仍存在一定的技术问题。在获得成熟的根茎入药之前,苍术需要较长的生长年限,种植过程中病虫害频发和药材质量下降已成为影响苍术人工种植的主要问题。研究[3]发现,随着苍术种植年限的增加,病害逐渐增多,影响产量和质量。已有研究[4]表明,长期种植同一作物会改变微生物的群落结构以及土壤理化性质,使得土壤传染性病虫害加重,出现药用植物化感自毒作用等现象。土壤微生物能够分解土壤中的有机质,释放各种营养元素,从而给作物提供较好的土壤环境,通常土壤质量的好坏可由土壤微生物的数量、功能和结构来反映,土壤微生物的变化也揭示了土壤质量的变化。苍术栽培多年后病害通常会增加,但病害菌的来源尚不清楚。据报道[5],苍术的一些病害是由病害孢子在入冬时埋藏于土壤,第2年入侵植株从而引发病害,比如苍术叶斑病。
微生物数量庞大,结构复杂多样,在传统的土壤微生物研究方法中,较常用到的是平板培养法、生物化学方法、生物标记法和分子生物学方法[6-7]。但因鉴定出的微生物种类不全且操作复杂,以上研究方法并不能很好地对微生物进行研究。相较于传统的研究方法,高通量测序因具有高覆盖度、高灵敏度和高准确性的特点而在各领域得到了广泛的应用[8]。利用高通量测序技术对栽培3年后的苍术根际土壤微生物进行研究,初步确定苍术种植前后根际土壤微生物的变化情况,探讨苍术根际土壤微生物的变化与苍术病害间的关系,为种植中的病害频发问题的解决提供参考。
1 材料与方法
1.1 试验材料
于2019年8月在陕西省柞水县下梁镇北苍术基地(109°10'52.57"E,33°39'52.704"N)采集试验材料。基地年均降水量742mm,年日照时数1860.2h,采集地人工起垄,排水性能良好,土壤湿度适中,田间管理主要是定期进行人工除草,在7-8月高湿高温季节,基地的苍术时有病害发生。土壤材料为同一地块内以“S”形方法分别采集5份土壤(深10~30cm)进行混合,装入无菌自封袋中,低温避光条件下带回实验室。种植苍术3年的根际土壤标记为ZX3,未种植土壤标记为ZXCK,每个处理组进行3次生物学重复,ZX3.1、ZX3.2、ZX3.3为样品 ZX3的 3个重复,ZXCK1.1、ZXCK1.2、ZXCK1.3为样品ZXCK的3个重复,所有土壤过2mm筛后保存于-80℃冰箱备用。
1.2 试验方法
1.2.1 土壤基因组DNA的提取和纯化 采用天根生化科技(北京)有限公司的土壤基因组DNA提取试剂盒,参照说明书提取土壤微生物的DNA。使用天根生化科技(北京)有限公司的DNA回收试剂盒对电泳产物(25V,8h)进行回收。使用Nordrop 2000测定DNA浓度,OD260/OD280值应在1.7~1.9,检测合格后于-20℃保存。
1.2.2 PCR扩增 取适量各样品DNA,然后稀释至1ng/μL,并以此为模板,使用带Barcode的特异引物扩增rRNA和ITS rRNA的基因序列。16SV4区引物为515F-806R,ITS1区引物为ITS1F-ITS2,ITS2区引物为ITS2-3F-ITS2-4R。
PCR反应体系为 30μL:15μL Mix,2μL引物,10μL DNA,补ddH2O 至30μL。PCR 程序:98℃预变性1min;98℃变性10s,50℃退火30s,72℃延伸30s,共30个循环;最后72°C保持5min。
对PCR产物进行纯化并使用2%浓度的琼脂糖凝胶进行电泳检测,剪切回收目标条带。
1.2.3 文库构建与测序 使用赛默飞世尔科技(中国)有限公司的Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建,使用赛默飞世尔科技(中国)有限公司的Ion S5TMXL进行上机测序。16S与ITS区域扩增子测序工作在北京诺禾致源科技股份有限公司完成。
1.3 数据处理
测序数据处理:首先使用Cutadapt[9]对数据进行低质量部分剪切,再根据Barcode从得到的数据中拆分出各样品数据,截去Barcode和引物序列初步质控得到原始数据(raw reads),对上述数据进行去除嵌合体序列的处理,数据序列通过https://github.com/torognes/vsearch/[10]与物种注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列,得到最终的有效数据(clean reads)。
OTU聚类和物种注释:使用Uparse软件[11]对所有样品的全部Clean read进行聚类,以>97%的一致性(identity)系数将序列聚类成为OTU,同时选取OTU的代表性序列,依据其算法原则,筛选OTU中出现频数最高的序列作为OTU的代表序列。再对OTU序列进行物种注释,用Mothur方法与SILVA132[12]的SSUrRNA数据库[13]进行物种注释分析(设定阈值为0.8~1.0),获得分类学信息,并分别在各分类水平上统计各样本的群落组成。使用MUSCLE软件[14](Version 3.8.31)进行多序列比对,再以各样品中数据量最少的为标准进行均一化处理,用于后续样本的多样性分析(Alpha和Beta)。
使用Qiime软件(Version 1.9.1)计算香农指数(Shannon),使用R软件(Version 2.15.3)进行Alpha多样性指数组间差异分析,分别进行有参数检验和非参数检验。
2 结果与分析
2.1 种植苍术前后土壤细菌及真菌的OTU变化
稀释曲线用于检测测序量是否充足,图1显示了样品ZX3和ZXCK的3个重复样品的细菌和真菌稀释曲线。以抽取数据量序列数目为横坐标,对应的细菌和真菌物种数OTU为纵坐标构建曲线。随着测序数目的增加,曲线趋于平坦,说明增加更多的测序量只会出现少量的新物种(OTU);随着苍术根际土壤样本细菌和真菌序列数目的增多,稀释曲线逐渐呈现平缓的趋势,测序结果已基本覆盖到样品中所有的物种信息。

图1 种植苍术前后土壤细菌及真菌的稀释曲线Fig.1 The dilution curves of bacteria and fungi in soil before and after planting A.lancea
韦恩图可以直观地体现2个样本土壤细菌群落OTU组成的差异性及重叠情况,共有的OTU越多,说明二者的相似性越大。从图2a可知,ZX3独有的OTU数量为765个,ZXCK独有的数量为950个,样本ZX3和ZXCK共有的数目为2528个,共有的OTU占据总量的59.58%。从图2b可知,ZX3独有的OTU为1050个,ZXCK独有的为912个,样本ZX3和ZXCK共有的数目为1185个,共有的OTU占据总量的37.65%。从连作后样本ZX3和ZXCK中细菌及真菌共有的OTU可知,连作后细菌和真菌的结构均发生了变化,且真菌的变化较细菌更大。

图2 种植苍术前后土壤细菌及真菌的韦恩图Fig.2 The venn diagrams of bacteria and fungi before and after planting A.lancea
2.2 种植苍术前后土壤细菌及真菌的Alpha多样性分析
Alpha多样性可反映微生物群落的丰度和多样性。从表1可知,细菌多样性中试验组ZX3的Chao1指数为2103.02,Ace指数为2135.13,均比ZXCK低;ZX3的Shannon和辛普森指数均比ZXCK低。真菌多样性指数显示,ZX3组的Chao1和Ace指数比ZXCK组低,说明真菌群落丰富度ZX3组较低,连作后真菌的丰富度降低,而ZX3组的Shannon和辛普森指数比ZXCK组高,说明ZX3组真菌群落多样性比ZXCK组高。连作后细菌群落多样性和丰富度下降,真菌群落多样性下降、丰富度上升,且细菌较真菌具有更高的稳定性。

表1 细菌和真菌的Alpha多样性指数表Table 1 The diversity index of bacteria and fungi
2.3 种植苍术前后土壤细菌及真菌门水平的相对丰度分析
对细菌的物种丰度在门分类水平上进行了分析,图3显示了细菌物种相对丰度排名前10的物种,分别为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、硬壁菌门(Firmicutes)、奇古菌门(Thaumarchaeota)和匿杆菌门(Latescibacteri)。其中变形菌门在ZX3和ZXCK组中的相对丰度分别为38.139%和38.715%;放线菌门在ZX3和ZXCK组中的相对丰度分别为18.020%和21.085%;酸杆菌门在ZX3和ZXCK组中的相对丰度分别为20.196%和22.334%;ZX3和ZXCK组相比,变形菌门和放线菌门的丰度下降,而酸杆菌门的相对丰度上升。

图3 种植苍术前后土壤细菌物种门分布Fig.3 Distribution of soil bacteria phyla before and after planting A.lancea
在门分类水平上对真菌的物种丰度进行分析,图4显示细菌物种相对丰度排名前10的物种,分别为子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、担子菌门(Basidiomycota)、毛霉亚门(Mucoromycota)、壶菌门(Chytridiomycota)、捕虫霉门(Zoopagomycota)、罗兹菌门(Rozellomycota)、球囊菌门(Glomeromycota)、隐孢子菌(Aphelidiomycota)和新美鞭菌门(Neocallimastigomycota)。子囊菌门在ZX3和ZXCK组中的相对丰度分别为29.602%和41.530%;被孢霉门在ZX3和ZXCK组中的相对丰度分别为37.170%和21.669%;担子菌门在ZX3和ZXCK组中的相对丰度分别为2.704%和18.893%;与ZXCK组相比,ZX3组中子囊菌门和担子菌门的相对丰度下降,被孢霉门相对丰度上升。三者的相对丰度在ZX3和ZXCK组中差异较大。
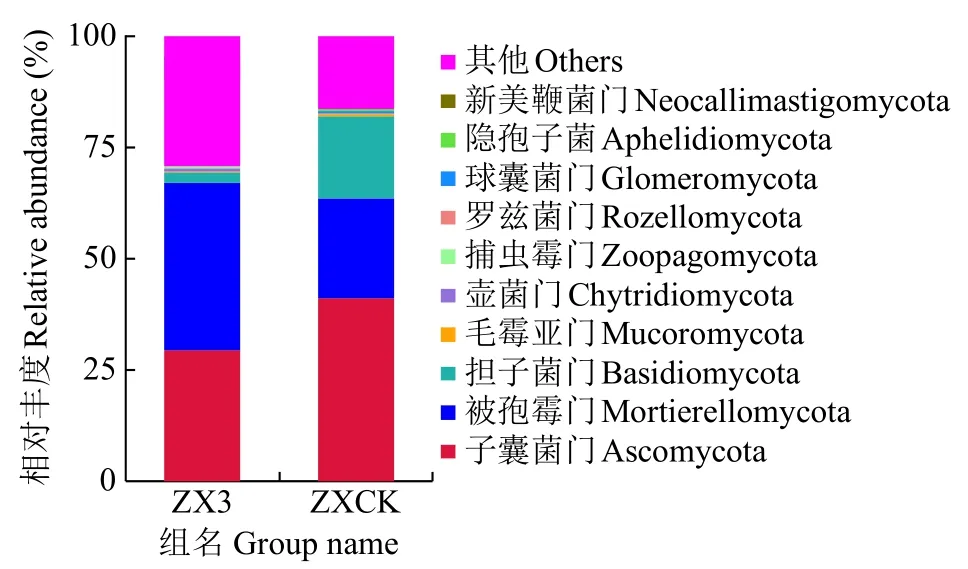
图4 种植苍术前后土壤真菌物种门分布Fig.4 Distribution of soil fungal phyla before and after planting A.lancea
2.4 种植苍术前后土壤细菌及真菌属水平的差异物种分析
细菌物种差异分析(图5)显示,慢生根瘤菌属(Bradyrhizobium)和节杆菌属(Arthrobacter)在2组样品中物种差异最为显著,在ZX3组中,其中慢生根瘤菌属具有非常显著的差异。节杆菌属在2组样品中有差异,但没达显著性。

图5 种植苍术前后土壤细菌物种差异分析Fig.5 Analysis of different species of soil bacteria before and after planting A.lancea
如图6所示,Dactylonectria、曲霉属(Aspergillus)、腐质霉属(Humicola)和Striaticonidium在2组样品中均具有显著性差异,其中Dactylonectria和Striaticonidium具有极显著差异。

图6 种植苍术前后土壤真菌差异物种分析Fig.6 Analysis of different species of soil fungi before and after planting A.lancea
选择ZX3和ZXCK组中细菌丰度前10的细菌从属水平上进行分析,如图7所示,这10个属的细菌总丰度占所有检测到的属水平的细菌物种的73.2%和76.2%,涵盖了大部分的物种。由图7可知,鞘氨醇单胞菌属(Sphingomonas)、念珠菌属(Solibacter)、罗丹杆菌属(Rhodanobacter)、杆菌属(Bryobacter)和Haliangium的丰富度在ZX3组中有下降趋势,Burkholderiaceae、节杆菌属(Arthrobacter)、γ-变形菌(Gammaproteobacteria)、慢生根瘤菌属(Bradyrhizobium)和链霉菌属(Streptomyces)的丰度有所增加。其中鞘氨醇单胞菌属在ZX3和ZXCK组所占的比例分别为4.6%和5.7%,Burkholderiaceae为6.3%和1.0%,罗丹杆菌属为2.1%和3.0%,节杆菌属为4.5%和1.7%。4个属在2组样本间的差异明显。

图7 种植苍术前后土壤细菌优势属分析Fig.7Analysis of dominant genes of soil bacteria before and after planting A.lancea
根据细菌优势属聚类热图(图8)可知,同一样品中不同组的物种存在一定差异,但ZX3和ZXCK组间差异更为明显,其中链霉菌属的丰度在样品ZX3中较高,而罗丹杆菌属在样品ZXCK中丰度较高。

图8 种植苍术前后土壤细菌优势属的聚类热图Fig.8 Cluster heat map of the dominant genera of soil bacteria before and after planting A.lancea
选择ZX3和ZXCK组中真菌丰度为前10的真菌从属水平上进行分析(图9),10个属的真菌总丰度占所有检测到的属水平的真菌物种的67.1%和50.4%。由图9可知,被孢霉属(Mortierella)和假单胞菌属(Pseudogymnoascus)在样品ZXCK中的丰度有所降低,其中Scleroderma、镰刀菌属(Fusarium)、青霉菌属(Penicillium)、绿僵菌属(Metarhizium)、曲霉属、毛囊菌属(Trichocladium)和府球菌属(Epicoccum)丰度增加。其中Scleroderma在ZX3和ZXCK组中所占的比例分别为0.001%和14.2%,被孢霉属为14.2%和4.0%,青霉菌属为1.9%和6.7%。3个属的真菌在2组样品间的差异较为显著。由此推测,苍术的连作与Scleroderma、被孢霉属和青霉菌属有着较为密切的关系。

图9 种植苍术前后土壤真菌优势属分析Fig.9 Analysis of the dominant genera of soil fungi before and after planting A.lancea
根据真菌优势属聚类热图(图10)可知,假裸囊菌属和被孢霉属在样品ZX3中丰度较高,府球菌属和Scleroderma在ZXCK中丰度更高。
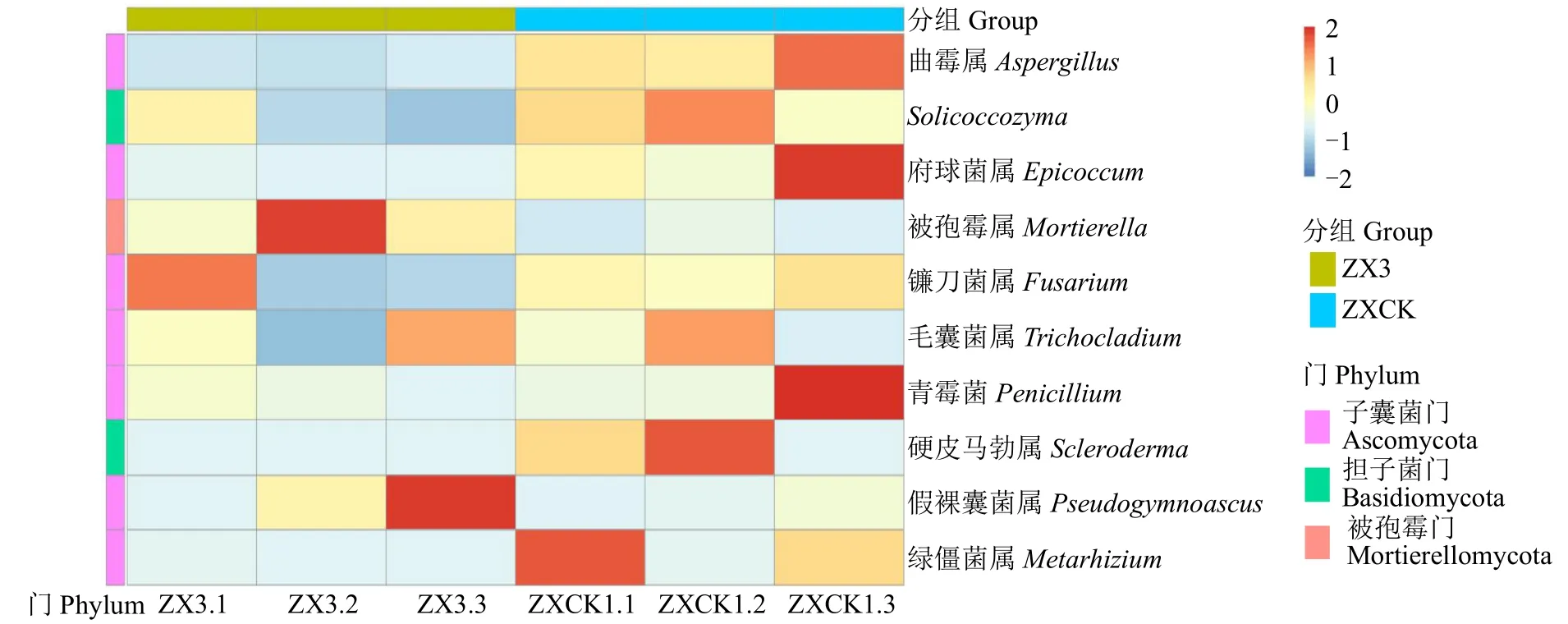
图10 种植苍术前后土壤真菌优势属的聚类热图Fig.10 Cluster heat map of the dominant genus of soil fungi before and after planting A.lancea
3 讨论
研究[15]表明,长期单一栽培方式会降低作物产量并对品质产生不利影响。大多数以根茎入药的植物都存在此问题,如三七、人参和白术[16]。土壤微生物结构的改变、作物病害虫的加重和药用植物的自毒现象都是作物长期连续栽种中容易出现的问题[17-18]。其中,土壤微生物结构的改变对作物生长产生较大的影响。土壤微生物可调节土壤环境,疾病的发生通常与微生物异常有关,土壤中的病害菌可导致作物病害的发生,有益菌可增强作物的抗逆性和整体适应性[19],微生物多样性被认为是预防疾病的关键因素[20]。不同类型的土壤和植被可产生不同的生物区系,这与土壤微生物相互作用的复杂性有关,包括微生物与土壤和植物的相互作用[21]。
本研究发现,苍术栽培3年后呈现出细菌群落多样性和丰富度降低而真菌群落丰富度降低、多样性升高的现象。郭兰萍等[22]对种植苍术的土壤微生物研究结果显示,栽培2年的苍术根际土壤细菌和真菌的微生物群落结构均低于1年生样品,与本研究结果相似,即栽培苍术前后根际土壤的微生物结构发生改变。此外,本研究发现,栽培苍术后根际土壤微生物呈有益菌下降、有害菌增长的趋势,部分重要微生物的结构失衡。其中有益菌变形菌门、放线菌门、子囊菌门、担子菌门和罗丹杆菌属等的丰度下降。研究[22]表明,变形菌和放线菌与疾病抑制有关,放线菌能够促进植株的生长和病害的防治,是植株根际重要的有益菌。子囊菌门和担子菌门是土壤中重要的分解者,大多数的子囊菌门为腐生菌,可以分解很多难降解的有机质,在养分的循环中起着重要作用[23]。连作后子囊菌门和担子菌门丰度下降,根际土壤养分循环受影响,可能会导致苍术药材品质下降。罗丹杆菌属有助于作物的生长,其可拮抗根腐菌,对作物来说是有益菌。有害菌被孢霉门、青霉菌属和Dactylonectria相对丰度上升,多数被孢霉门可在土壤中进行腐生,少数是树木的菌根菌,在发病的土壤中被孢霉门的丰度通常会偏高,在大豆的连作障碍研究中发现,青霉菌属中的紫青霉菌分泌的毒素会抑制大豆的生长[24],青霉菌属的部分物种还可导致果实的腐烂,部分菌属与生物碳复合,降低土壤中有效砷的含量,改变土壤中的微生物环境[25-26]。Dactylonectria真菌大多与植物病害发生有关[27-30]。慢生根瘤菌属、关节细菌属、酸杆菌门、鞘氨醇单胞菌属、伯克式菌属(Burkholderiaceae)、节杆菌属、硬皮马勃属(Scleroderma)和被孢霉属等菌群连作前后发生变化。酸杆菌门的平衡与作物的生长也有着密切的关系[31]。慢生根瘤菌属是变形菌门α变形菌纲的一种根瘤菌[32],可变换大气中游离氮形式,从而利于寄主生物充分利用,例如氨(NH3)或铵(NH4+)[33],两者均与植株的生长有关联。鞘氨醇单胞菌属可降解纤维素,其通过吸收利用葡萄糖可解除葡萄糖对纤维素酶的抑制作用[34]。栽种苍术后,以上菌群发生改变。
有研究[35]显示,随栽培年限的增加,植株根际分泌物增加,此往往会促进某一类或几类微生物数量的增加或减少,影响微生物结构,同时土壤本身的理化性质以及作物的田间管理也会影响到土壤微生物的结构以及作物的生长状况。研究[36-38]表明,选用高抗品种,实行合理的轮作间作、施用有机肥和菌肥,对土壤进行定期的消毒,连作后进行深耕等可以缓解连作带来的不良影响。因此,建议在种植苍术时可与玉米和花生等作物进行间作或轮种,施用石灰和有机肥对土壤进行处理等,综合利用多种措施改善苍术的种植条件,减少病虫害的发生,提高人工栽培的苍术品质。
4 结论
栽培3年后的苍术根际土壤与未种植过苍术的根际土壤相比,土壤细菌和真菌结构发生变化,细菌群落多样性和丰富度下降,真菌群落多样性下降、丰富度上升。其中有益菌相对丰度下降,有害菌相对丰度增加,一些重要菌群失衡。说明苍术的多年栽培引起了根际土壤菌群的改变,这些改变可能使得土壤的养分循环和理化性质等受到影响,进而引起苍术病害的发生,造成药材品质的下降。因此维持苍术根际土壤微生物菌群的平衡是防治苍术病害发生和提高药材品质的有效途径之一。
