吉林省主推玉米品种的SSR分子标记纯度鉴定
2022-11-18段梦冉刘丰泽葛建镕易红梅杨洪明高玉倩岳鹏武马文宇班秀丽2王凤格
段梦冉 刘丰泽 葛建镕 易红梅 杨洪明高玉倩 岳鹏武 马文宇 班秀丽2, 王凤格
(1北京市农林科学院玉米研究所玉米DNA指纹及分子育种北京市重点实验室,100097,北京;2吉林农业大学农学院,130118,吉林长春;3全国农业技术推广服务中心,100125,北京;4吉林省种子管理总站,130022,吉林长春)
玉米作为拥有粮食、饲料和工业原料三重属性的粮食作物,在我国农业生产中占据着不可替代的位置。玉米产量占全国粮食产量近40%。吉林省是我国主要的商品粮产区之一[1]。位于世界三大黄金玉米带之一的吉林黄金玉米带2020年玉米产量达2973.44万t,占吉林省粮食总产量的78.2%[2],占全国玉米产量的11.4%[3]。种子纯度作为评价种子质量的一项重要指标,与玉米产量有着密不可分的关系[4],生物混杂或机械混杂会导致玉米种子不纯,因此加强对吉林省玉米种子质量控制,特别是准确鉴定玉米种子纯度对全省玉米产量至关重要,随着玉米新品种的逐年增多,对于玉米种子纯度鉴定也提出了更高的要求。
玉米种子纯度鉴定的主要方法有田间鉴定法[5]和盐溶蛋白鉴定法[6],田间鉴定法耗时耗力,易受环境影响;盐溶蛋白鉴定法对于亲缘关系较近的品种鉴定困难。近20年来,SSR分子标记技术以其多态性好、灵敏度高、操作简便、用时短及准确率高等优点在品种纯度、真实性鉴定以及品种权保护等方面得到广泛应用。已制订了玉米品种真实性和纯度SSR分子标记检测标准[7],赵久然等[8]利用40对核心引物构建中国玉米品种标准样品的SSR指纹库,李锐等[9]以224份山西玉米自交系构建了68份核心种质,杨扬等[10]对308个糯玉米品种从审定年份和适宜种植区角度分析了遗传多样性特点和发展趋势。SSR分子标记技术还可用于玉米抗病和抗虫种苗的选育[11]。此外,SSR分子标记技术在小麦[12]、水稻[13]和高粱[14]等种子的真实性和纯度鉴定、新品种辅助育种和遗传多样性分析等方面也发挥着不可替代的作用。
本试验以吉林省主推的50个玉米品种为材料,通过SSR分子标记法利用40对引物进行扩增,结合每对引物的遗传稳定性、多态性以及样品区分能力等进行筛选,最终获得一组适用于吉林省主推玉米品种种子纯度鉴定多重扩增及多重电泳的引物,为吉林省主推玉米品种种子纯度鉴定提供了一套科学高效的方案。
1 材料与方法
1.1 试验材料
依据全国农业技术推广中心统计的2020年度农作物品种推广情况,选择在吉林省种植推广面积排名前50的主推玉米品种,该50个品种种植面积占吉林省玉米种植面积的61.73%(表1)。样品种子来源于吉林省种子市场。
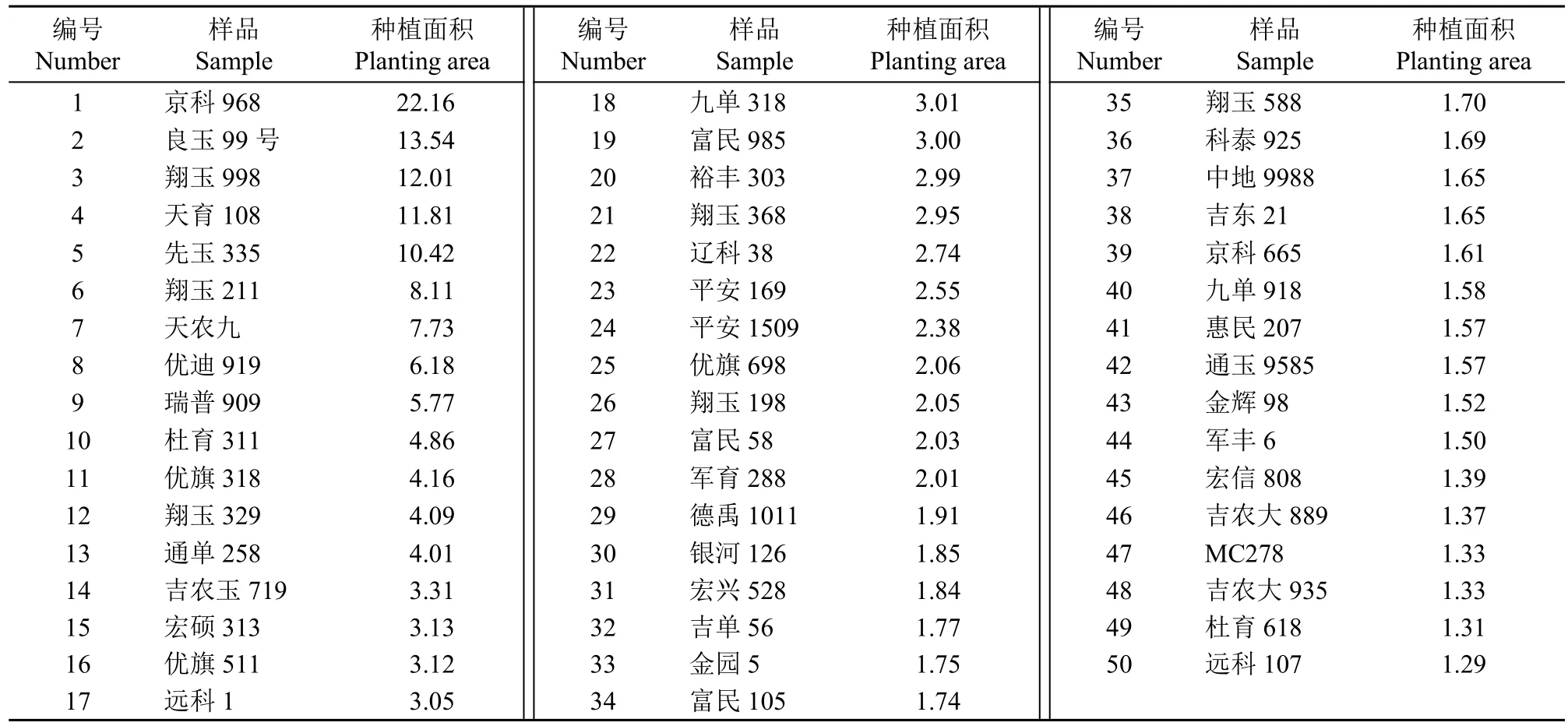
表1 50份样品信息Table 1 The informations of 50 samples ×104hm2
1.2 试验方法
1.2.1 小区田间种植 为验证SSR分子标记鉴定法与田间鉴定法结果的一致性,使2种方法所用材料一一对应,将试验材料于吉林省长春市公主岭市陶家屯镇种植基地单粒点播种植,每行播种50粒,每个品种播种100粒,待植株所有性状都表现出来后进行田间鉴定并取样,从距叶尖30cm处取单株叶片,对每个品种的100个单株逐个取样,取样完成后分别包装保存。
1.2.2 DNA提取 取适量叶片,剪碎于1.2mL的离心管中,加入钢珠后将管放入96孔深孔板中,采用磁珠法提取DNA[15],用紫外分光光度计(Nanodrop 2000)检测DNA浓度,将DNA稀释到约100ng/μL,采用琼脂糖凝胶电泳法对DNA进行质量检测。
1.2.3 引物 选择GB/T 39914-2021中公布的40对引物,采用PET、NED、VIC和FAM 4种荧光染料,标记每对引物中的其中一条的5′端,由Applied Biosystems公司(美国)合成引物。
1.2.4 PCR扩增 PCR体系20.00μL:模板DNA 2.00μL,2×TaqPlus Master Mix(近岸蛋白质科技有限公司)10.00μL,ddH2O 7.75μL,引物0.25μL。多重扩增时根据该体系中增加的引物量相应减少ddH2O的量,PCR扩增反应程序:94℃预变性5min;94℃变性40s,60℃退火35s,72℃延伸45s,35次循环;72℃延伸10min,扩增产物放于4℃保存。
1.2.5 电泳检测 利用ABI 3730XL DNA分析仪进行荧光毛细管电泳,对扩增产物进行检测,根据SSR分子标记扩增片段大小及引物上标记荧光颜色的不同,选择10重引物组合进行电泳,根据不同的Panel组合,将同组的扩增产物等体积混合,震荡混匀。将2.0μL混合样品和10.0μL含有1%GS3730-500分子量内标的去离子甲酰胺加入到DNA分析仪专用96孔电泳板中,在PCR扩增仪上95℃变性5min,4℃保存10min,离心30s后,于ABI 3730XL DNA分析仪上进行荧光毛细管电泳。15kV预电泳2min,15kV电泳30min。
1.2.6 数据处理 利用ABI3730XL DNA分析仪上自带的Date Collection V1.0软件收集电泳原始数据,形成FSA文件,将FSA文件上传到SSR指纹分析器SSR Analyser[16],经分析后上传到SSR指纹数据库中,对样品指纹图谱进行分析。采用Power-Marker ver 3.25统计SSR引物位点的等位基因频率、基因型数、等位基因数、基因多样性、杂合度及多态性信息量(polymorphism information content,PIC)值等,采用WPS Office进行样品杂合位点数分布图的绘制及鉴别力(DP值)的计算,用IBM SPSS Statistics 23统计相关性及显著性系数。
1.2.7 多重扩增体系优化 根据各引物在多重扩增体系中的表现,利用IBM SPSS Statistics 23设计多因素多水平的正交试验方案,将2×TaqPlus Master Mix及引物的用量设置为考察因素,参照原体系中2×TaqPlus Master Mix量及引物量,针对每个考察因素分别设置4个水平,根据试验结果找出每个因素的最佳水平,然后进行验证试验,确定9重扩增体系的最佳组合。为验证该多重扩增体系可用于吉林省主推玉米品种的纯度鉴定,随机选择6个品种(编号为D1、D2、D3、D4、D5和D6)各100个单株进行鉴定,并将鉴定结果与田间鉴定结果进行比较分析。
2 结果与分析
2.1 DNA提取浓度及质量检测
所有样品 DNA 浓度均在 300~700ng/μL,OD260/280值在1.8~2.0,提取的DNA质量较高,达到了试验要求。
2.2 纯度鉴定引物的筛选
根据40对引物的毛细管电泳结果,通过对各位点杂合度、遗传稳定状况、染色体位置、多重扩增及多重电泳潜力等的评估,筛选出一套适用于吉林省主推玉米品种种子纯度鉴定的核心引物。
2.2.1 试验材料SSR标记指纹图谱库的构建 用40对引物对50个玉米品种进行单重引物扩增,将扩增产物混合成4组,每组包含10对引物,进行多重电泳检测。依据电泳结果对40对引物的多态性进行分析,结果(表2)显示,40对引物多态性较高,40个位点的总基因型数为414,变化范围在4~24,平均值为10.35;总等位基因数为276,变化范围在3~15,平均值为6.9;等位基因频率在0.34~0.88,平均值为0.54;基因多样性变化范围在0.22~0.78,平均值为0.59;杂合度在10%~96%,平均杂合度为68.1%,最低的是P02位点,杂合度为10%,最高的是P03、P05和P10位点,杂合度为96%。PIC值为0.21~0.76,平均PIC值为0.55,最低的是P07位点,为0.21,最高的是P22位点,为0.76。

表2 50个吉林省主推玉米品种SSR引物多态性分析Table 2 SSR primer polymorphism analysis of 50 main maize varieties in Jilin province

续表2 Table 2(continued)
2.2.2 核心引物筛选 依据50份样品在40对SSR基础引物的指纹数据及引物多态性信息,选择杂合度高于80%的引物进入核心引物的候选名单,进一步优选出 P03、P05、P08、P10、P11、P13、P14、P17、P23、P25、P30、P31、P33、P35 和 P37,共15对引物。
根据引物的片段大小、标记的荧光颜色及在染色体上的位置,筛选出P03、P05、P08、P10、P11、P17、P25、P31和P37共9对引物为吉林省主推玉米品种纯度鉴定的核心引物。这9对核心引物杂合度在82%~100%,平均杂合度为91.5%,PIC值在0.44~0.75,平均PIC值为0.63,相比于基础引物均有所提高。平均DP值为0.73,最高为0.81,最低为0.52,在0.50~0.60的引物有1对,在0.60~0.70的引物有2对,在0.70以上的引物有6对。在50份样品中,有9个杂合位点的样品量最多,占样品总数的56%,杂合位点在5个及以上的占样品总数的100%,杂合位点在6个及以上的占样品总数的98%(图1)。

图1 SSR引物组合在50份样品中杂合位点的分布Fig.1 Distribution of heterozygous loci of SSR primer combinations in 50 samples
利用SSR标记法进行纯度鉴定时主要依靠双亲互补位点,在双亲信息缺失而无法判断双亲互补位点的情况下,品种的杂合度是判断某组引物能否用于该品种纯度鉴定的重要标准,50份样品在40对引物中的杂合度在55.00%~85.00%,平均杂合度为68.55%,在GB/T 39914-2021《主要农作物品种真实性和纯度SSR分子标记检测 玉米》中推荐的8对引物中杂合度在50.00%~87.50%,平均杂合度为75.75%,而在9对引物中的杂合度为56.00%~100.00%,平均杂合度为91.56%,高于在40对基础引物及行业标准提供的8对引物中的杂合度,更适用于吉林省主推玉米品种的纯度鉴定(图2)。

图2 50份样品分别在8对、9对及40对引物中的杂合度Fig.2 The heterozygosities of 50 samples in eight pairs,nine pairs and 40 pairs of primers,respectively
2.3 核心引物多重扩增体系的构建
将筛选出的9对引物组成2重、4重、6重、8重及9重扩增体系,随机从50份样品中选择6个品种进行多重扩增体系的构建(图3),多重体系的扩增效果大都表现良好,无异常扩增,但由于存在竞争关系,多重扩增体系部分引物间的电泳图谱峰高差距较大,且随着多重体系的增加差距逐渐增大,从9重体系扩增结果来看,引物P03、P05、P08及P31的峰值整体低于其他引物,主要基因型峰值在2000~4000,推测可能由于扩增效率较低导致;P37的峰值远高于其他引物,超过22 000;其余引物的主要基因型峰值在4000~9000,引物间峰值差异较大,会影响软件数据自动化采集,导致最终的纯度鉴定结果出现误差。

图3 各多重组合电泳结果Fig.3 Electrophoresis results of multiple combinations
2.4 核心引物多重扩增体系的优化
针对9对引物的表现,对核心引物多重扩增体系进行优化,以2×TaqPlus Master Mix量(A)、峰值较低的引物(B)、峰值一般的引物(C)和峰值较高的引物(D)为考察因素,每个因素各4个水平(表3),利用IBM SPSS Statistics 23软件设计L16(44)正交试验(表4),对各组试验结果比较,分析每个因素下各水平组电泳结果,选择每个因素下引物峰高表现最佳的水平,确定核心引物多重扩增的最佳体系组合为2×TaqPlus Master Mix 14.00μL,P03、P05、P08 和 P31 各 0.45μL,P10、P11、P17和 P25各 0.15μL,P37 0.10μL。

表3 正交试验设计因素水平Table 3 Factor level of orthogonal experimental design μL

表4 L16(44)正交试验表Table 4 L16(44)orthogonal experiment table μL
用确定的最佳扩增体系组合进行验证试验,电泳结果如图4所示,9对引物的主要基因型峰值在3000~9000,经过优化后的体系各引物间峰值差异过大的情况得到明显改善。

图4 优化扩增体系后电泳结果Fig.4 Electrophoresis results after optimizing amplification system
2.5 试验材料种子纯度鉴定的引物推荐
依据筛选出的9对引物在样品中的扩增效果及是否为杂合位点,针对50个吉林省主推玉米品种选出4对候选引物和2对优选引物用于品种种子纯度检测(表5)。当只需鉴定品种种子的自交苗时,选择2对优选引物进行鉴定,当还需鉴定品种种子中的异交种及混杂株时,选择4对候选引物可满足鉴定需求。

表5 50个吉林省主推玉米品种种子的纯度鉴定引物推荐Table 5 Seed purity identification and primer recommendation of 50 main maize varieties in Jilin province

续表5 Table 5(continued)
2.6 核心引物的纯度鉴定结果分析
用筛选出的核心引物检测随机选择的6个品种,每个品种各检测100个单株,将SSR分子标记鉴定结果与田间鉴定结果进行比较(表6),田间鉴定检测出6份样品平均自交苗、异型株和纯度值比例分别为1.67%、1.17%和97.17%,SSR分子标记技术分别为1.67%、1.16%和97.17%。经t检验相关性分析,2种方法检测的纯度相关性系数为0.766,相关性较高,差异不显著。针对田间鉴定与SSR分子标记鉴定存在的差异,推测由于田间鉴定时植株受到环境条件的影响,导致个别植株性状表现不完全或表现异常,此外还受检验员的经验影响,导致可能出现将异型株误判为小苗、将正常株误判为异型株的情况。

表6 6份样品纯度鉴定结果Table 6 Purity identification results of six samples %
3 讨论
种子纯度的高低关系到粮食的产量,GB 4404.1-2008《粮食作物种子 第1部分:禾谷类》规定,玉米种子纯度指标不低于96.0%。影响纯度指标的因素主要有在玉米制种过程中出现的自交、异交及混杂株等,种子收获后要进行品种纯度鉴定检测。目前纯度鉴定检测方法有田间种植鉴定法、盐溶蛋白电泳鉴定法和SSR分子标记鉴定法。田间种植鉴定需要一个玉米生育周期,鉴定时间长。目前采取的田间种植鉴定法一是冬天在海南种植鉴定,但成本高,二是本地同期种植鉴定,但结果滞后。盐溶蛋白电泳鉴定法和SSR分子标记鉴定法是实验室快速检测纯度的方法,不受生长季节的限制,在实验室1d就可完成检测。盐溶蛋白电泳鉴定法采用从种子中提取的盐溶蛋白在聚丙烯酰胺凝胶的浓缩效应、分子筛效应和电流分离的电荷效应作用下进行分离,通过染色显示蛋白质谱带类型,不同玉米品种由于遗传组成的不同,种子内所含的蛋白质种类有差异,这种差异可利用电泳图谱加以鉴别,从而对种子品种纯度进行鉴定,但该方法对亲缘关系较近的品种无法鉴定。SSR分子标记鉴定法能准确鉴定出品种的差异,结果一致性高,且本试验使用荧光毛细管电泳平台,通过SSR指纹分析专用软件SSR Analyser[17]分析数据,比较峰值图差异,以此来对品种纯度进行鉴定,该平台用时短且分辨率高[18],区分能力强,对于一些亲缘关系相近的品种也可准确将其区分开来。本试验建立的纯度鉴定体系中,利用荧光毛细管电泳平台,只需经过1次扩增1次电泳即可完成纯度鉴定,大大缩短了鉴定时长。对于SSR分子检测而言,筛选合适的引物进行纯度鉴定是至关重要的一步,品种不同,用于纯度鉴定的引物也有所不同,相同品种,选择不同的引物也可能会导致结果出现差异[19],而本试验所建立的吉林省主推玉米品种纯度鉴定体系避免了因所筛选引物不同而导致纯度鉴定结果出现差异的情况。
目前,种子纯度鉴定的需求主要有企业自控以及政府外控。对于企业而言,需要在生产过程中及收货后销售前控制品种纯度,检测的品种背景清晰,检测重点在于自交苗,因此,选择本文中推荐的2对优选引物进行鉴定可满足一般需要,也可降低检测成本,如还需鉴定种子中的异交种及混杂株,选择4对候选引物可满足鉴定需求。在玉米品种纯度的政府外控监督抽查时,面对品种数量多、样品数量大且制种过程不清楚,则需要选择更多的标记以保证鉴定结果的准确性,本试验筛选出的9对引物对于吉林省主推的50个玉米品种至少有5个位点为杂合,可将自交苗及主要异型株辨别出来,建立的玉米品种纯度鉴定体系节约了筛选引物以及单重扩增的时间和成本,提高了检测效率。相比于纯度鉴定标准中推荐的8对引物,本试验筛选出的9对引物着眼于吉林省主推玉米品种,更高程度地满足了吉林省玉米品种种子纯度检测的需要,为质量监管部门打击假劣种子、保护品种权利提供技术支撑,为农业粮食安全提供保障,也为构建其他地区玉米纯度鉴定体系提供参考。
4 结论
基于SSR分子标记检测技术,针对吉林省主推的50个玉米品种,从40对引物中筛选出9对杂合度和多态性较高的引物用于纯度鉴定,分别为P03、P05、P08、P10、P11、P17、P25、P31 和 P37,并优化为9重扩增体系,体系中2×TaqPlus Master Mix 14.00μL,P03、P05、P08 和 P31 各 0.45μL,P10、P11、P17和 P25各0.15μL,P37为 0.10μL。建立的纯度鉴定多重扩增体系可用于吉林省主推玉米品种的纯度鉴定,针对不同的应用场景,为兼顾检测效率和成本,可从本试验所筛选出的9对引物中灵活选择纯度鉴定引物,为其他作物建立通用的高效纯度鉴定方案提供参考。
