高胆红素致耳蜗核神经元超兴奋的机制研究△
2022-11-18尹新璐陈博婕刘汉玮徐雅男王家东
尹新璐 陈博婕 刘汉玮 徐雅男 王家东
高胆红素血症是新生儿常见的疾病之一,在发展中或低收入国家,每年约有110万新生儿患重症高胆红素血症甚至发展成为胆红素脑病,严重危害新生儿的健康和生命[1]。近年来,由于检测技术精准度的提高以及筛查力度的加大,高胆红素血症的发生率逐年增高。高胆红素血症的发生和预后有年龄依赖性,尤其早产儿发病率更高,预后更差(Watchko等,2006)。听觉中枢核团对胆红素高度敏感,游离胆红素可通过血脑屏障选择性沉积在听觉脑干核团引起听力障碍,兴奋毒性是胆红素脑病引起听觉损害的主要机制[2-4],但其兴奋毒性机制目前并未十分明确。γ-氨基丁酸(GABA)、甘氨酸(Glycine)以及谷氨酸是神经系统最常见的神经递质。神经突触传递在信号传导以及维持神经元兴奋性中起到非常重要的作用(Gonzalez-Islas等,2006)。谷氨酸是兴奋性递质,在发育初期,GABA/Glycine是兴奋性突触递质,随着神经元的发育,胞内氯离子浓度下降导致GABA/Glycine能突触传递向抑制性发展[5]。除了外界突触介导的神经元放电,神经元自身具有的放电现象为内源性放电。故本研究拟从神经突触传递以及内源性放电两方面来探讨胆红素引起耳蜗核(cochlear nuclear, CN)神经元超兴奋性的可能机制。
1 材料与方法
1.1主要试剂及设备 主要试剂有:荷包牡丹碱(Bicuculine,生产批号:101926979),士的宁(Strychnine,生产批号:1001253093),磷酸二氢钾(KH2PO4,生产批号:815660),乙二醇二乙醚二胺四乙酸 (EGTA,生产批号:100288144),羟乙基哌嗪乙硫磺酸(HEPES,生产期号:1002772747),谷氨酸钾(K-gluconate,生产批号:1003004028),以上试剂均购与Sigma公司。所有药物配置后均在-20 ℃储存,使用前用人工脑脊液稀释至使用浓度。
主要设备有:膜片钳放大器(HEKA, EPC-10)、显微操作仪(Sutter, MP-225)、倒置显微镜(Nikon, TE2000-U)、振荡切片机(Leica, VT-1000S)、解剖显微镜(SOIEC, XTL-2400)、电极拉制仪(NARISHIGE, PC-10)水浴槽(精宏,XMTE-8112)、天平(Sartorius, BS 124s)。
主要试剂配置:①孵育液(单位mM/L):124NaCl, 5 KCl, 1.2KH2PO4, 1.3MgSO4, 2.4CaCl2, 24NaHCO3以及10 glucose; 将上述药剂成分在精准天平上称量后倒入1 L蒸馏水后用搅拌子进行混合溶解,用缓冲剂Tris-base调节PH至7.2。在配置过程中,持续给与95%O2+5%CO2充氧。②记录自发性放电、内源性放电以及超极化激活环磷腺苷依赖性阳离子通道(hyperpolarization-activated and cyclic nucleotide-gated channels,HCN)电流通道电流的电极内液(单位mM/L):97.5 K-gluconate, 32.5 KCl, 0.5 EGTA, 10HEPES, 1 MgCl2以及4ATP-Mg。Tris-base调节PH至7.2。③记录自发性兴奋性突触后电流(spontaneous excitatory postsynaptic current, sEPSC)的电极内液(单位mM/L):127 CH3CsO3S,20 NaCl, 20 HEPES, 0.4EGTA, 5Tetraethylammonium Chloride (TEA-Cl), 3QX314-Cl, 2.5 Na-ATP,以及0.3-GTP。④记录自发性抑制性突触后电流(spontaneous inhibitory postsynaptic current, sIPSC)的电极内液(单位mM/L):92 CsCl, 50 Cs methanesulfonate, 5TEA-Cl, 2 EGTA, 4 ATP-Mg, 10 HEPES。根据内液成分的不同,记录的分别是自发性抑制性或者兴奋性突触后电流(sIPSC或者sEPSC)。配制电极内液时,可将各成分进行换算后在精准天平上称量然后倒入100 ml蒸馏水中进行混合溶解,并且分装。
1.2实验动物及分组 实验动物选用生后1~9 d(P1~9)的C57Bl/6J小鼠60只[上海杰思捷实验动物有限公司,许可证号:SCXK(沪)2018-004)],雌雄不限,发育良好。分组:选择状态好的神经元,在人工脑脊液中进行全细胞或者细胞贴附式记录,未进行任何药物处理的神经元放电频率或者阻断神经突触后的内源性放电频率记为对照组(内源性放电)(图中已标注);随后在灌流装置中加药,如:加入6 μm胆红素作用9 min记为胆红素组;在药物作用后,将灌流液重新回归至人工脑脊液,记为洗脱组。
1.3制备带有CN神经元的脑片 小鼠戊巴比妥(55 mg/kg,ip)麻醉后切断后颈部,将头皮沿一侧外耳道剪向另一侧外耳道,之后垂直该刀口剪向鼻前侧,暴露出颅骨。之后,沿外耳道将头皮延纵向剪开,剪向另一侧外耳道呈十字剪开颅骨,用镊子拨开颅骨后暴露脑组织,再用尖头手术刀沿冠状面切下含有小脑及脑干的脑组织,立即置于充满人工脑脊液的冰水混合物培养皿中,人工脑脊液提前用混合气(95% O2+5% CO2)进行氧饱和。在正置体式显微镜下迅速剥离脑组织表面的脑膜血管,随后将脑组织置于0℃人工脑脊液震荡切片机中进行切片,脑片厚度为300 μm;将带有CN核团的脑片转至37℃的人工脑脊液中进行充氧孵育一个小时;最后将脑片转移至记录槽内进行形态学观察以及电生理记录。
1.4膜片钳记录内源性放电频率、SEPSC/sIPSC以及HCN电流变化 本实验所采用的膜片钳记录方式包括细胞贴附式和全细胞式,主要是细胞贴附式,记录模式包括电压钳以及电流钳;采用膜片钳放大器持续测量细胞膜电位或电流。膜电流低通滤波频率为1~3 kHz,采样频率为10~12 kHz,使用Patch-master 3.5进行数据采集。选用外径1.5 mm、内径0.86 mm的玻璃电极进行记录,记录电极由两步电极拉制仪拉制,充灌好电极内液后的电阻为6~8 MΩ(电极内液Ph调至7.2,渗透压300 mM Osm),电极使用前进行抛光处理;补偿串联电阻至90%以上。进行细胞贴附式记录时,高阻封接达到2 GΩ以上,并维持稳定至少25 min。在电压钳下将细胞钳制在-60 mV,在电流钳下注入0 pA电流以确保所记录的神经元没有受到任何刺激;进行全细胞记录时,漏电流小于100 pA。每根电极用于记录只能使用一次,每个脑片加药之后只记录一次数据。电极入水后进行液接电位的补偿,所有试验均在室温下进行(22~26℃)。
1.4.1记录CN神经元自发性放电频率的变化 制备新鲜含CN神经元的脑片,神经元孵育在ACSF灌流液中。在60倍显微镜下用细胞贴附式或者全细胞式记录神经元的自发性放电频率持续3 min,然后在加药装置中加入6 μm胆红素持续灌流6 min,最后,再次灌流同对照组的ACSF持续3 min。
1.4.2记录CN神经元sIPSC和sEPSC频率的变化 制备新鲜含CN神经元脑片,神经元孵育在ACSF灌流液中。微电极中灌流记录sIPSC或者sEPSC的内液(见上述试剂配制)。在全细胞式记录模式下,稳定记录sEPSC或sIPSC频率维持3 min, 然后在加药装置中加入6 μm胆红素持续灌流9 min,最后,再次灌流间对照组的ACSF维持3 min。
1.4.3记录CN神经元内源性放电频率的变化 在细胞贴附式或者全细胞式模式下记录ACSF孵育液中CN神经元自发性放电频率,维持3 min;同时加药NBQX(6 μm)、APV(50 μm)、Bicuculline(50 μm)和Strychnine(1 μm)持续9 min以阻断兴奋性和抑制性神经突触传递;最后灌流液更换成ACSF持续3 min。记录内源性放电频率维持3 min后,分别加入2 mMCsCl、80 mM ZD7288维持9 min;最后洗脱至同对照组的灌流液中。
1.4.4记录HCN离子通道激活电流 按上述方法稳定记录内源性放电维持3 min,灌流6 μm胆红素6 min,然后洗脱至同对照组的孵育液中维持3 min,观察期间神经元放电频率的变化。记录HCN通道激活电流的方法:将细胞钳制在-60 mV 维持500 ms,给予 2 s步阶电流(从-60 mV 至-120 mV,每 10 mV 递增),紧接着回到-60 mV 持续 500 ms;灌流6 μm胆红素6 min后再次记录HCN通道电流。
1.4.5记录CN神经元自发性放电频率的变化 稳定记录神经元放电频率维持3 min,灌流HCN通道抑制剂2 mM CsCl维持9 min后,再同时灌流6 μm 胆红素维持6 min。
1.5统计学方法 统计分析数据所使用的软件是MiniAnalysis (synaptosoft,NT, USA)、Clampfit 10.2 software (Molecular Devices)和SPSS 23.0。Origin 8 (Microcal Software)、SigmaPlot12 (Systat Software)以及Adobe illustrator用于图形绘制。自发性放电频率对比是将对照组原始数据标准化到1.0,实验组数据同法标准化后与对照组相比较。实验数据均以均数±标准误表示。组间样本均数差异的比较采用Wilcoxon signed-ranks 检验,P<0.05为差异有统计学意义,NS代表无统计学差异,*代表P<0.05,**代表P<0.01,***代表P<0.001。
2 结果
2.1高胆红素对CN神经元自发性放电频率的作用 如图1a、b所示,胆红素组灌流6 μm胆红素后示例神经元的自发性放电频率由177次/分升至366.83次/分, 洗脱至ACSF孵育液后降至272.67次/分。图1c示高胆红素作用后,胆红素组神经元的自发性放电频率相对于对照组提升了250%±31.2%(n=5,P<0.001),洗脱后洗脱组放电频率降为对照组的162%±21.4%,洗脱组和胆红素组间有统计学差异(n=5,P<0.05)。
2.2高胆红素对sIPSC/sEPSC的作用 如图2a~c所示,高胆红素组神经元sEPSC的频率增加至对照组的193.2%±26.4%,对照组和高胆红素组相比有统计学差异(n=4,P<0.01);洗脱组又降至对照组的141.3%±37.6%,洗脱组与胆红素组间无统计学差异(n=4,P>0.05),说明高胆红素促进sEPSC频率的作用是不可逆的。图2d~f示高胆红素组sIPSC的频率升至对照组的135.3%±16.4%,胆红素组和对照组之间有显著的统计学差异(n=4,P<0.001);洗脱后降至对照组的121.3%±12.4%,洗脱组与胆红素组间无统计学差异。该部分结果证实,6 μm胆红素可以增大sIPSC和sEPSC的频率,即胆红素可以促进GABA/Glycine以及谷氨酸的突触传递。


2.3CN神经元自发性内源性放电观察结果 如图3a~c所示,同时加入四种神经突触阻断剂NBQX、APV、Bicuculline和Strychnine持续9 min后,示例神经元的自发性放电频率由对照组的488.3次/分降至240.78次/分,重新灌流ACSF后升至346.25次/分。标准化自发性放电频率后,发现抑制神经突触传递可以使放电频率降至对照组的60.7%±8.1%(n=7,P<0.05),洗脱至人工脑脊液后升至80.12%±10.2%,两者间有统计学差异(n=7,P<0.05)。HCN通道是一种非常常见的起搏通道,CsCl和ZD7288是其阻断剂,如图3d~f所示,2 mM CsCl和80 mM ZD7288都可以抑制自发性内源性放电的频率,其中CsCl可以将自发性内源性放电频率降至对照组的48.75%±9.23%(n=6,P<0.01),ZD7288作用后降至对照组的68.45%±10.39%(n=7,P<0.05);与对照组相比较,CsCl和ZD7288作用后自发性内源性的放电频率都有明显的统计学差异。

2.4高胆红素对HCN通道激活电流的作用 如图4a~c所示,胆红素组内源性放电频率增加至对照组的155.33%±17.36%(n=6,P<0.001),洗脱组降至对照组的129.43%±18.39%(n=6,P>0.05)。内源性放电是由HCN离子通道介导起搏的,如图4d所示,灌流2 mM CsCl维持9 min后再次记录HCN电流,发现记录电流被2 mM MCsCl完全阻滞,证实所记录的通道为HCN通道。另取CN神经元稳定记录HCN通道电流,灌流6 μm胆红素作用6 min后再次记录HCN通道电流(图4e),图4f提示,HCN通道的激活曲线向右(即去极化)移动,半激活电压(V0.5)对照组为-104.9±1.5 mV,而胆红素作用后V0.5=-95.4±2.2 mV,两者间有统计学差异(n=5,P<0.05)。如图4f示,在同等电压下, 6 μm胆红素作用后HCN通道电流相较于对照组更大,说明胆红素增大了HCN通道电流,促进了HCN通道电流的开放。该结果证实,胆红素是通过直接促进HCN离子通道的激活从而增加了内源性放电频率,使神经元处于放电频率升高的超兴奋状态。

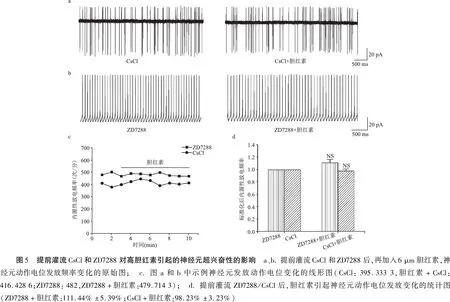
2.5CN神经元自发性放电频率观察结果 如图5a、c示,胆红素并未增大神经元的放电频率(CsCl: 395.333 3次/分,胆红素+CsCl: 416.428 6次/分(n=4,P>0.05)。图5b、c显示,ZD7288提前孵育后,6 μm胆红素维持6 min并未增大神经元的放电频率(ZD7288: 482次/分,ZD7288+胆红素:479.714 3/min)。将CsCl、ZD7288作用的数据标准化后,图5d示胆红素作用后放电频率与CsCl、ZD7288灌流时相比较没有明显统计学差异 (ZD7288+胆红素:111.44%±5.39%,n=5,P>0.05;CsCl+胆红素:98.23%±3.23%, n=5,P>0.05)。
3 讨论
游离的胆红素可通过血脑屏障,侵入新生儿神经系统对中枢神经组织产生损害,严重者可导致胆红素脑病即核黄疸[6]。胆红素脑病的临床表现与其选择性损伤中枢神经系统的特定部位有关。不同的中枢核团对高胆红素的敏感性不同,其中听觉核团如:CN、上外橄榄核和腹侧橄榄核,对高胆红素神经毒性尤其敏感,可能导致新生儿永久性听力障碍。胆红素神经毒性具有浓度依赖性和年龄依赖性,胆红素浓度越高、新生儿年龄越小,高胆红素神经毒性越显著,反之亦然[7]。兴奋毒性是目前比较公认的胆红素神经毒性机制,但是具体机制未明。
谷氨酸是最常见的兴奋性神经递质,本研究结果显示高胆红素可以增大sEPSC的频率,即促进了谷氨酸突触传递。GABA/Glycine是神经系统中最常见的抑制性神经递质,文中结果显示胆红素也可以促进GABA/Glycine能突触传递(图2)。GABA/Glycine在发育过程中存在着由兴奋性向抑制性逆转的变化。前期研究证实在CN神经元中确实存在GABA/Glycine的逆转现象,并且CN核团中的两类神经元Bushy和Stellate细胞完成逆转的时间分别为第7天和第14天[8]。高胆红素可以促进逆转前兴奋性GABA/Glycine能突触,与谷氨酸通路协同作用,这可能是高胆红素兴奋毒性年龄依赖性(对发育早期神经元毒性作用更强)的机制之一[9]。在药物抑制方面,利鲁唑(riluzole)是临床用来治疗肌萎缩侧索硬化症的常用药物,通过抑制谷氨酸以及天冬氨酸的释放及其活性来发挥神经保护作用[10]。有研究结果表明,利鲁唑可以通过抑制谷氨酸突触传递拮抗高胆红素引起的兴奋毒性[11]。牛磺酸作为GABA/Glycine受体的激活剂,也可以降低高胆红素引起的神经元放电频率增高[12]。
在发育早期,神经系统会产生自发性规律性的电活动,很多文献指出早期自发性电活动主导了突触的可塑性,对神经通路的成熟起到了非常重要的作用(Tritsch等,2007)。Gonzalez-Islas 等(2006)证实早期的自发性电活动可以调节兴奋性和抑制性突触的成熟。本研究发现,在P1-9 C57 Bl/6J小鼠CN神经元上阻断了谷氨酸和GABA/Glycine突触传递后,仍存在自发性放电,即不依赖于外界突触传递的内源性放电。内源性放电在神经发育过程中有非常重要的意义,有研究表明视网膜和苍白球中的内源性放电可以协调整个神经网络的发展以及完善突触精准连接的过程[13,14]。多功能干细胞中有内源性放电的起搏神经元也被证实可以调节神经通路的传导[15]。由此推测,在听力形成前,有自发性内源性放电的这部分听觉中枢神经元在调节神经元兴奋性、整合突触传递以及神经通路形成的过程中起到了至关重要的作用。HCN 通道最早是在哺乳类动物的浦肯野细胞中发现的,是细胞膜上的一种离子通道,可以非选择性的通透钠、钾离子,中枢神经系统中 HCN 通道的水平很高(Yi等,2010),已有文献报道,在听觉中枢的前庭毛细胞、 内耳毛细胞以及前庭核都有 HCN 通道的存在以及表达(Koch等,2004)。HCN通道是一种非常常见的起搏通道,CsCl和ZD7288是其阻断剂,本实验用外源性CsCl 以及 ZD7288 阻断HCN 通道后[16],自发性内源性放电的频率明显降低,说明内源性放电是由HCN通道介导的。更重要的是,将胆红素直接作用于HCN通道后发现其激活曲线明显右移,变得更加容易激活(图4)。提前阻断HCN通道然后再次灌流高浓度胆红素,神经元放电频率并未增加,进一步说明,胆红素是通过直接作用于HCN通道促进内源性放电频率增高发挥超兴奋作用的。
综上所述,胆红素所致超兴奋性的机制是多通路联合作用的结果,突触传递和不依赖于突触传递的内源性放电在胆红素超兴奋性机制中起重要作用。发育早期兴奋性GABA/Glycine协同谷氨酸共同作用,可能是高胆红素年龄易感性的原因之一。HCN通道介导的自发性内源性放电在整个听觉发育过程中起非常重要的作用,胆红素对HCN通道促进作用的机制以及年龄易感性的基础都有待于进一步探究。
