基于焦亡相关基因的肝细胞癌临床预后模型的建立和评估
2022-11-17刘川铭卢熙奎曾点点
刘川铭,李 谢,卢熙奎,曾点点,陈 洁
(1.大理大学药学院,云南 大理 671000;2.大理大学公共卫生学院,云南 大理 671000;3.昆明市第三人民医院药学部,昆明 650041)
肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌中最常见的一种类型,约占所有病例数的75%~85%,5年存活率仅为18%〔1〕。HCC早期无特异症状,患者就诊时多处于中晚期,预后较差。甲胎蛋白、分泌型蛋白Dickkopf-1和高尔基体蛋白73等生物标志物对于HCC的诊断和预后并不理想〔2〕。T、N和M分期作为一种传统的预后预测方法,由于其无法实现患者个体化的生存预测,故缺乏一定的准确性。因此,确立新的预后模型对于HCC患者来说是非常重要的。
细胞焦亡作为一种新的程序性细胞死亡方式,与肿瘤的发生、发展和抗肿瘤免疫功能的激活有关,由于其介导了白细胞介素(interleukin,IL)-1β和IL-18等可能促进癌症进展的炎症介质的释放,因此有研究认为细胞焦亡具有促进肿瘤发生的作用〔3〕,且IL-1β可提高HCC中缺氧诱导因子1α的表达水平,诱导上皮间质转化过程进而促进肿瘤转移〔4〕。既往的研究〔5-6〕也显示焦亡相关基因(pyroptosis-related genes,PRGs)可有效预测肺腺癌和卵巢癌等患者的预后情况。应乐倩等〔7〕的研究表明细胞焦亡与炎症反应评分对预测HCC患者的预后具有较高的准确性,且预测预后的有效性不亚于现有的临床病理指标。
本研究基于与HCC预后密切相关的PRGs构建了预后风险模型,该模型通过风险评分来预测和评估HCC的预后,为HCC患者的临床诊断和治疗指导提供个体化的模型,同时结合风险评估与临床特征绘制列线图以提高预测预后的效率。
1 材料与方法
1.1 材料
1.1.1 HCC患者数据的收集 在TCGA(https://portal.gdc.cancer.gov/)数据库中下载肝癌患者的转录组数据和临床数据,共获得50例正常样本和374例HCC样本,临床数据主要包括生存时间、生存状态、年龄、性别、分级、stage分期以及T、N和M分期。
1.1.2 PRGs表达量数据的获取 通过查阅相关文献〔5,8-11〕以 及 在GeneCards(https://www.genecards.org/)数据库中以“pyroptosis”作为关键词进行检索,收集到207个PRGs,利用“limma”软件包提取得到192个PRGs的表达量数据。
1.2 方法
1.2.1 PRGs的差异分析 利用R语言“limma”软件包中的“wilcox.test”筛选192个PRGs中具有显著差异表达的焦亡相关基因(differential expression of pyroptosis-related genes,DEPRGs),筛选条件为|log2FC|>1,FDR<0.05。
1.2.2 DEPRGs的GO功能富集和KEGG信号通路分析 利用“org.Hs.eg.db”和“clusterProfiler”软件包对DEPRGs进行GO功能富集分析。将DEPRGs上传至DAVID(https://david.ncifcrf.gov/)数据库进行KEGG信号通路分析,筛选P<0.01的条目。
1.2.3 HCC预后相关PRGs的确定 使用StrawberryPerl软件将DEPRGs与临床数据中的生存时间和生存状态进行合并,通过R语言中的“survival”软件包单因素COX分析出与HCC预后相关的PRGs,显著性过滤条件为P<0.05。
1.2.4 预后风险模型的建立 采用R语言“survival”软件包中的多因素COX分析进行优化,根据AIC值构建最优模型,获得用于构建预后风险模型的基因,并得到相应的回归系数(Coef)。根据风险基因的表达量和多因素COX分析得到的回归系数,建立风险评分公式,风险评分=(风险基因1的表达量×Coef1)+(风险基因2的表达量×Coef2)+(…)+(风险基因n的表达量×Coefn)。
1.2.5 预后风险模型的评估 以风险评分的中位数作为截断值,将患者分为高风险组和低风险组。采用K-M生存曲线评估高风险组和低风险组的生存率,绘制受试者操作特征曲线(receiver operator characteristic curve,ROC曲线),根据ROC曲线的曲线下面积(area under the curve,AUC)评估模型的预测价值。使用R语言对风险评分进行单因素和多因素的独立预后分析,并通过“rms”软件包绘制基于风险模型的列线图预测肝癌患者未来几年的生存概率。
1.2.6 统计分析 使用R语言和Perl语言包对数据进行分析处理及绘图,基因表达量数据统一进行对数转换,P<0.05为差异有统计学意义。
2 结果
2.1 识别显著DEPRGs筛选得到了58个DEPRGs,其中55个显著上调,分别为GSDMD、GSDME、GSDMB、GSDMC、NLRP1、CASP8、PYCARD、DHX9、NLRP9、CASP3、APIP、KCNQ1OT1、TREM2、MALAT1、GJA1、VDR、AGER、UTS2、CTSV、KLF3-AS1、BSG、IL32、CDKN2B-AS1、SQSTM1、IRF3、ADORA2A、METTL3、PECAM1、TRIM31、MIR25、MRE11、PARP1、MKI67、IL36G、VIM、BIRC3、LY96、GLMN、IRGM、NOS2、TP63、POP1、ANXA2、TLR9、ASIC1、CGAS、GAS5、NOD1、PLCG1、BAK1、BAX、CHMP3、CHMP4C、CYCS、IL1A;3个显著下调,分别为IL1B、IL1RN、IL6。
2.2 DEPRGs的GO功能富集和KEGG信号通路分析结果GO功能富集结果显示,生物过程方面主要涉及细胞焦亡、脂多糖反应、正向调节IL-6的产生和对肿瘤坏死因子产生的正向调节等;细胞组成主要涉及膜筏、炎性复合体、膜微区;分子功能主要涉及IL-1受体结合、BH结构域结合、磷脂酰肌醇磷酸结合。见表1。KEGG信号通路富集分析主要涉及NOD样受体信号传导途径、非酒精性脂肪性肝病、Toll样受体信号传导途径、乙型肝炎、癌症信号通路和肿瘤坏死因子信号通路等。见表2。
2.3 预后相关PRGs的筛选将58个DEPRGs的表达量数据与临床数据中的生存时间和生存状态进行合并,通过单因素COX分析过滤得到23个与HCC预后相关的PRGs。见表3。
2.4 PRGs预后风险模型的建立对23个预后PRGs进行多因素COX分析,确定其与HCC患者的预后显著相关,最终获得了8个可用来构建预后风险模型的基因,分别为DHX9、TREM2、CTSV、BSG、SQSTM1、PARP1、GLMN和NOD1。根据风险基因的表达量与多因素COX分析得到的回归系数计算风险评分。见表4。风险评分=(DHX9的表达量×0.443)+(TREM2的 表 达 量×0.135)+(CTSV的 表 达 量×0.224)+(BSG的表达量×0.228)+(SQSTM1的表达量×0.274)+(PARP1的表达 量×(-0.314))+(GLMN的表达量×0.608)+(NOD1的表达量×(-0.534))。
2.5预后风险模型的验证以风险评分的中位数作为截断值将患者分为高风险组(n=185)和低风险组(n=185),采用K-M生存曲线对高风险组和低风险组患者的生存率进行分析,结果显示高、低风险组患者的生存率差异有统计学意义(P<0.001)。见图1A。风险曲线中患者的风险评分按升序排列,从左到右患者的风险值逐渐增大。见图1B。患者的生存状态则以散点图的形式呈现,结合了风险评分、生存时间和生存状态,随着风险值的增大患者的病死例数增多,风险值减小时患者的病死例数下降。见图1C。
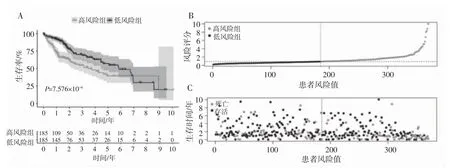
图1 预后模型的风险分析
在单因素的独立预后分析中,风险评分与生存时间和生存状态显著相关(HR=1.411,P<0.001)。多因素的独立预后分析也显示风险评分与生存时间和生存状态显著相关(HR=1.352,P<0.001),其他的临床数据并不是独立的预后因子(P>0.05)。见表5。此外,ROC曲线结果显示,相较于其他临床数据,风险评分的AUC最高(0.802),表明风险评分的预测价值高于其他临床数据。见表6。因此,风险评分在预测肝癌的临床预后方面具有可靠性,可作为独立预后因子。本研究通过将风险评分与年龄、性别及T、N和M分期等临床数据相结合,构建了用于预测肝癌患者1、3、5年生存率的列线图。见图2。
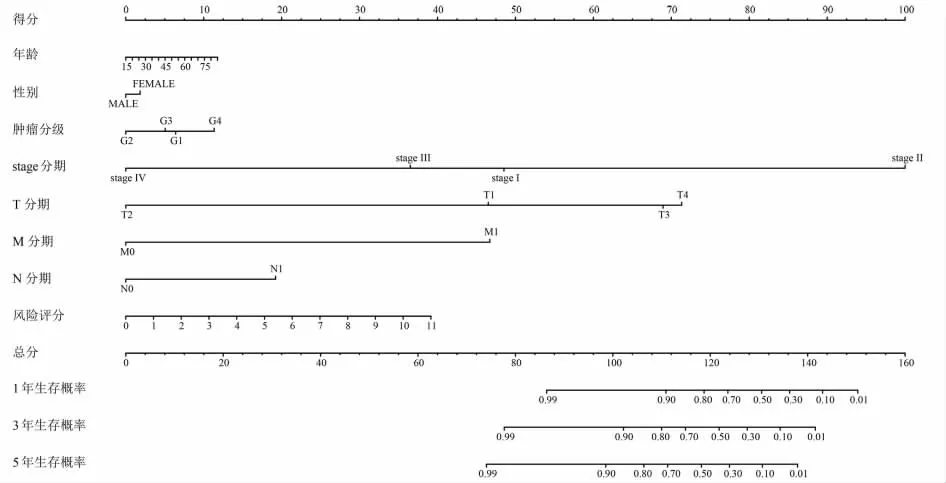
图2 肝癌患者预后的列线图
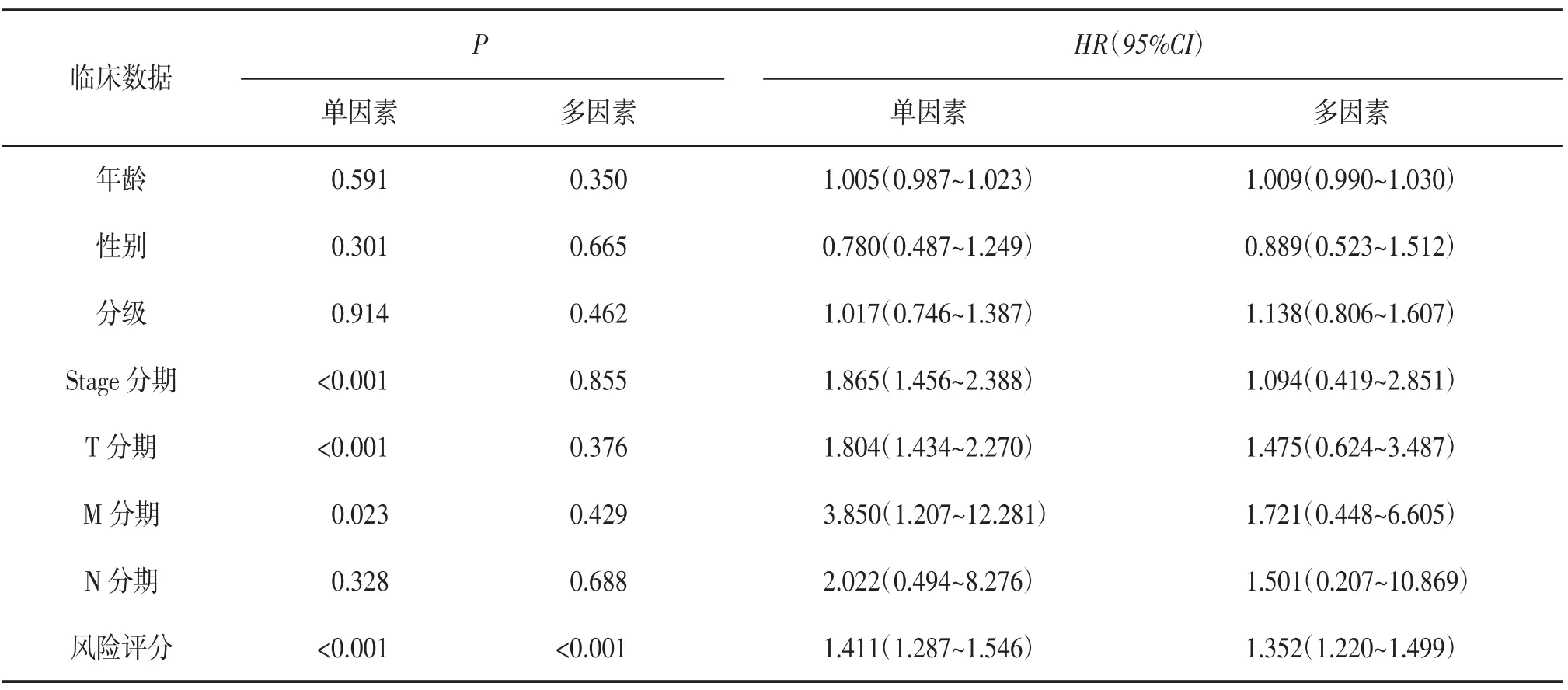
表5 风险评分的预后预测价值

表6 ROC曲线中各变量的AUC值
3 讨论
HCC是临床最常见的恶性肿瘤之一,尽管免疫疗法和靶向疗法等新的治疗方法对其治疗效果已有所提高,但患者5年的生存率仍然低于20%,许多患者确诊时疾病已进入晚期,患者的预后相对较差。生物信息学分析在阐明众多差异表达基因的作用机制以及评估HCC发生发展的复杂性方面具有重要意义,目前生物信息学分析已被证明在许多肿瘤的诊断、治疗和预后中都发挥着越来越重要的作用〔12〕。本研究利用单因素和多因素COX分析确定了8个与HCC预后显著相关的PRGs,即BSG、CTSV、DHX9、GLMN、NOD1、PARP1、SQSTM1和TREM2基因。
BSG作为一种免疫球蛋白超家族的跨膜糖蛋白,又称CD147或EMMPRIN,可参与免疫反应的调节,在活化的淋巴细胞中强烈表达。BSG在大多数人类恶性肿瘤中过度表达,肿瘤细胞中的BSG活性被认为是由肿瘤相关的与半乳糖凝集素-3、透明质酸和单羧酸转运蛋白4等具有结合活性的多糖过度表达而增强〔13-14〕。BSG在肿瘤中的过度表达通常被认为是一个不利的预后标志〔13,15〕,其可促进肿瘤细胞产生基质金属蛋白酶、血管内皮生长因子以及透明质酸,进而促进这些细胞的迁移、增殖和血管生成〔16-17〕。Xu等〔18〕的研究结果显示,CD147可通过促进肠上皮细胞中核因子κB(nuclear factor-κB,NF-κB)p65的磷酸化,增强肠上皮细胞中IL-1β与IL-18的表达和分泌,进而诱导肠上皮细胞的细胞焦亡。此外,有报道〔19〕HCC中组织蛋白酶L2(又称CTSV)的mRNA和蛋白水平均有所增加,蛋白酶L2的表达升高与HCC的不良预后相关。Leng等〔20〕的研究发现,高迁移率族蛋白B1(high mobility group protein B1,HMGB1)可增加膜穿孔蛋白D氨基末端的表达,沉默组织蛋白酶V可逆转HMGB1诱导的细胞焦亡;HMGB1可增加溶酶体的通透性,而沉默组织蛋白酶V可减弱HMGB1诱导的含半胱氨酸的天冬氨酸蛋白水解酶-1(cysteinyl aspartate specific proteinase-1,Caspase-1)激活。
DEAH盒解旋酶9(DEAH-box helicase 9,DHX9)是一种依赖三磷酸核苷酸的RNA解旋酶,属于DExD/H-Box超家族Ⅱ类解旋酶,它的过度表达与肿瘤细胞的增殖、转移及患者的预后密切相关。Shi等〔21〕检测了DHX9在肝癌组织中的表达及其在细胞中的功能,并进一步分析了DHX9与HCC患者预后的相关性,研究结果提示DHX9可能是一个促进肝癌细胞增殖、侵袭和转移的癌基因。此外,DHX9还可能在DNA介导的先天性免疫反应中发挥重要作用,DHX9通过其DUF1605结构域识别CpG-BDNA,并作为传感器激活Ⅰ型干扰素反应,将信号传递给免疫系统〔22〕。有研究〔23〕通过整合多个基因表达队列开发了一个基于免疫相关基因的肝癌预后标志,并通过独立队列和实验验证了该模型的稳定性和可靠性,该团队发现GLMN在肿瘤组织中的蛋白质和mRNA表达水平相较于癌旁组织显著增加,且在GSE6764和GSE14520队列中的差异表达结果也显示GLMN在肿瘤中高表达。此外,Suzuki等〔24〕的研究发现GLMN-cIAPs轴控制着炎性小体的激活,而IpaH7.8-GLMN-cIAPs轴则是志贺氏菌促进巨噬细胞焦亡并引起严重炎症的独特机制。
核苷酸结合寡聚化结构域(nucleotide-binding oligomerization domain,NOD)1作为NOD样受体亚家族NLRC中的主要代表与TLR、RIG样受体和C型凝集素家族共同构成了先天病原体模式识别系统。焦亡是Caspase-1依赖性炎症细胞死亡的一种形式,也可发生在吞噬细胞中,作为炎性小体激活的结果。NLR的家族成员是炎症体激活的核心成分,可作为与Caspase-1前体进行蛋白相互作用的平台。Guo等〔25〕的研究结果亦显示吴茱萸碱对肝癌细胞的抑制作用可能是通过抑制NOD1信号通路来实现的。研究发现聚(ADP-核糖)聚合酶1(poly(ADP-ribose)polymerase 1,PARP1)可激活NF-κB转录因子,该转录因子激活参与炎症和癌细胞存活的相关基因的转录,PARP1还通过激活细胞外调节蛋白激酶和c-Jun N-末端激酶信号通路来促进肿瘤的形成和转移〔26〕。在卵巢癌、肝细胞癌、结直肠癌和白血病等恶性肿瘤中,PARP1的mRNA、蛋白质和酶活性水平都有所升高〔27-29〕。刘梅等〔30〕的研究发现PARP1作为碘化钾诱导的高表达蛋白可参与调控NF-κB转录因子的活性,并促进炎症性细胞焦亡的发生。
Ichimura等〔31〕的研究发现p62S351位点的磷酸化显著增加了其在选择性自噬过程中与Keap1的结合亲和力,磷酸化p62的聚集持续激活了核因子E2相关因子2(nuclear factor erythroid 2-related factor,Nrf2)信号通路,将促进肝细胞癌的发展。此外,SQSTM1基因的过度表达或异常聚集和磷酸化可导致葡萄糖和谷氨酰胺的代谢紊乱,并通过持续激活Nrf2促进丙型肝炎病毒阳性HCC的肿瘤发展〔32〕。在肝脏中,髓样细胞触发受体2(triggering receptor expresses on myeloid cells-2,TREM2)表达于非实质细胞,如肝窦内皮细胞、Kupffer细胞和肝星状细胞〔33〕。TREM2在巨噬细胞和中性粒细胞中也有表达,可被募集到炎症部位与常驻免疫细胞一起参与先天免疫调节。有研究通过单细胞RNA测序在人和小鼠纤维化的肝脏中发现了一个与瘢痕相关的巨噬细胞亚群,该亚群由TREM2+和CD9+识别,它们通过TNFRSF12A、PDGFR和NOTCH信号通路与内皮细胞和间充质细胞一起促进肝脏的纤维化〔34〕。此外,在一项以HepG2细胞和HCC模型动物为实验对象的研究中,TREM2通过诱导PI3K/AKT信号通路进一步调节肿瘤细胞的生物学行为〔35〕。
综上所述,本研究建立了一个基于8个焦亡相关基因的预后风险评分模型,单因素和多因素COX分析表明该预后模型计算的风险值可作为HCC患者的独立预后因素,在ROC曲线中该模型风险评分的AUC值(0.802)为最高,表明其预测价值要明显优于其他临床数据,此外又构建了可用于预测结局事件发生风险的列线图以提高预测预后的效率。在后续的研究中,将通过体外的细胞分子生物学实验作进一步的验证。
