基于生物信息学分析TCEB1在肝癌中的表达及意义
2022-11-16李林海
陈 平,李林海,吴 为
(重庆大学附属三峡医院,中国重庆 404100)
肝癌是最常见的消化系统恶性肿瘤之一,也是全球癌症相关死亡的第4大病因,其中肝细胞癌(hepatocellular carcinoma,HCC)是最常见的病理类型[1]。由于高复发率和转移率,进展期肝癌患者的5年生存率仍较低。另一方面,肝癌细胞耐药的发展,使得现有靶向药物的治疗效果并不理想。因此,深入探索肝癌发生发展的分子机制,寻找与预后有关的生物标志物及潜在治疗靶点至关重要。转录延伸因子B1(transcription elongation factor B subunit 1,TCEB1),又名延伸蛋白C(elongin C,ELOC),和延伸蛋白A/A2、延伸蛋白B一起组成转录因子B(SⅢ)复合体,通过与RNA多聚酶Ⅱ的直接相互作用,激活转录延长[2]。研究表明,TCEB1基因的突变和拷贝数扩增分别与肾癌和前列腺癌的发生发展密切相关[3~5],但TCEB1基因在肝癌中的表达、改变情况及临床意义尚不清楚。本研究利用生物信息分析工具对肝细胞癌患者肿瘤样本、癌旁正常组织或健康对照样本进行数据挖掘分析,探索TCEB1基因在肝癌中的表达、改变情况、预后价值及其潜在的功能。
1 材料与方法
1.1 GEPIA2分析
GEPIA2(Gene Expression Profiling Interactive Analysis 2;http://gepia2.cancer-pku.cn;2021-07-05)[6]是一个可分析9 736个肿瘤和8 587个健康样本RNA序列数据的网站服务器,其样本来自于癌症基因组图谱(The Cancer Genome Atlas,TCGA)和基因型组织表达数据集(The Genotype-tissue Expression,GTEx)。本研究利用该平台分析TCEB1在肝癌组织和正常组织中的表达差异,以及TCEB1 mRNA水平和肝癌患者预后的关系。参数设置全部选择默认。
1.2 UALCAN分析
UALCAN(http://ualcan.path.uab.edu/;2021-07-05)[7]可在线分析TCGA数据,比较肿瘤分级、分期、患者年龄、种族、肿瘤分子亚型等不同临床病理特征与基因表达的相关性。本研究利用该平台分析TCEB1基因表达与肝癌患者临床病理特征的相关性。参数设置全部选择默认。
1.3 cBioPortal分析
cBioPortal(http://www.cbioportal.org;2022-09-28)[8]包含多个数据库,如TCGA和国际癌症基因组联盟(International Cancer Genome Consortium,ICGC)等,共涉及283项大型肿瘤相关的基因组和蛋白质组学研究,并提供分析癌症相关基因数据的可视化工具。本研究利用cBioPortal分析肝癌组织中TCEB1基因的改变情况(如基因突变、扩增等)及其与患者预后的关系。参数设置全部选择默认。
1.4 TCEB1相关基因及其富集分析
LinkedOmics(http://www.linkedomics.org/login.php;2021-07-05)[9]是一个基于网络的分析平台,可分析来自TCGA的32种原发性肿瘤的多组学数据。LinkFinder是LinkedOmics的一个分析模块,在本研究中用于探究TCEB1的相关基因,结果以火山图、热图呈现。条件设置如下:1)“Cancer cohort:TCGA_LIHC”;2)“Search dataset:TCGA LIHC RNAseq”;3)“Gene:TCEB1”;4)“Target dataset:TCGA LIHC RNAseq”;5)“Statistical method:Pearson correlation test”,以伪发现率(false discovery rate,FDR)<0.01为相关基因的筛选标准[10]。筛选P<0.05且相关系数绝对值大于0.5[11]的相关基因输入Metascape(http://metascape.org),种属选择H.sapiens,随后进行基因本体论(Gene Ontology,GO)功能注释、京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析,并利用在线工具微生信(http://www.bioinformatics.com.cn)对分析结果作图。
1.5 蛋白质互作网络构建
GeneMANIA(http://genemania.org/;2021-07-05)[12]可在线构建蛋白质-蛋白质相互作用(proteinprotein interaction,PPI)网络。该网站使用生物信息学方法可显示一系列相互作用的蛋白质,同时可显示蛋白质物理相互作用、共表达、共定位、基因富集分析和网站预测等。本研究利用Gene-MANIA构建TCEB1的PPI网络。参数设置全部选择默认。
1.6 统计学处理
采用GraphPad Prism 8.0进行统计分析。TCEB1基因不同拷贝数的组间比较,若符合正态分布,采用单因素方差分析(one-way ANOVA),若不符合正态分布,采用非参数检验。其余所有统计结果均为数据库自动计算生成。P<0.05为差异有统计学意义。
2 结果
2.1 TCEB1在肝癌和正常肝脏组织差异表达
通过GEPIA在线分析TCGA和GTEx数据集中肝癌组织和正常肝组织TCEB1 mRNA的相对表达量,我们发现,与正常肝组织比较,肝癌组织中TCEB1 mRNA的表达量显著增加(P<0.05)(图1)。

图1 TCEB1在肝癌组织和正常肝组织中的表达Fig.1 Expression of TCEB1 in HCC and normal liver tissues
进一步利用UALCAN分析TCGA数据,以了解不同临床病理特征肝癌组织中TCEB1的表达。结果显示:肝癌组织中TCEB1 mRNA水平越高,患者肿瘤分级越差(P<0.05)(图2A),但肝癌组织中TCEB1 mRNA水平在各肿瘤分期中无显著差异(图2B);TCEB1在男性患者肝癌组织中的mRNA表达量明显高于女性患者(P<0.05)(图2C);TP53突变的肝癌组织中TCEB1 mRNA水平较无突变的肝癌组织明显升高(P<0.05)(图2D)。

图2 TCEB1 mRNA表达水平与肝癌患者不同临床病理参数和基因表型的关系(*P<0.05)(A)TCEB1在肝癌不同分级中的表达;(B)TCEB1在肝癌不同分期中的表达;(C)TCEB1在不同性别肝癌患者中的表达;(D)TCEB1在不同TP53基因表型中的表达。Fig.2 Relationships between the expression level of TCEB1 mRNA and different clinicopathological features and between the expression level of TCEB1 mRNA and gene phenotypes in HCC patients(*P<0.05)(A)The expression level of TCEB1 in different grades of HCC;(B)The expression level of TCEB1 in different tumor stages of HCC;(C)The expression level of TCEB1 in male and female patients with HCC;(D)The expression level of TCEB1 in HCC with or without TP53 mutation.
2.2 TCEB1的表达水平与肝癌患者预后的关系
利用GEPIA在线分析TCGA数据集中364例肝癌组织TCEB1基因的表达水平与患者预后的关系。以TCEB1基因表达的中位数为标准,将患者分为TCEB1基因高表达组(n=182)和低表达组(n=182)。结果表明,TCEB1基因高表达组患者的总体生存时间显著低于低表达组(P=0.025)(图3A),但两组患者的无病生存时间无明显差异(P=0.16)(图 3B)。

图3 TCEB1基因表达与肝癌患者生存预后的关系(A)TCEB1基因表达与肝癌患者生存时间的关系;(B)TCEB1基因表达与肝癌患者无病生存时间的关系。Fig.3 Relationship between TCEB1 expression and the prognosis of HCC patients(A)Relationship between TCEB1 expression and the overall survival of HCC patients;(B)Relationship between TCEB1 expression and the disease free survival of HCC patients.
2.3 肝癌中TCEB1基因改变情况
为了解TCEB1在肝癌组织中是否存在基因突变或拷贝数扩增等基因改变,我们检索了cBio-Portal数据库,发现在7个研究共1 136例肝癌患者中有52例患者(5%)的TCEB1发生了基因改变(基因突变、拷贝数扩增或结构变异)(图4A)。TCEB1基因拷贝数扩增与其mRNA表达呈正相关(图4B)。数据分析中共有3个研究(MERiC,Basel 2021;AMC,Hepatology 2014;TCGA,Firehose Legacy)提供了患者的生存数据,其中,MERiC对患者生存数据的描述为患者生存状态,另外两项研究对患者生存数据的描述为患者总体生存状态。因此,我们只纳入了后两项研究进行生存分析,结果显示,发生TCEB1基因改变的肝癌患者的总生存时间显著低于无基因改变的患者(P=0.012 9)(图4C),但两组患者的无病生存时间无显著差异(P=0.379)(图4D),表明TCEB1基因改变可能提示预后不良。
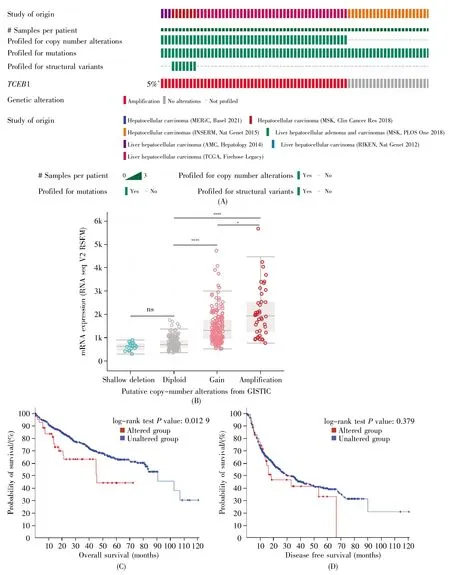
图4 肝癌组织中TCEB1基因改变情况及其与患者预后的关系(A)TCEB1基因改变视觉图;(B)TCEB1基因拷贝数变异与其mRNA表达的关系;(C)肝癌患者有/无TCEB1基因改变的总生存曲线;(D)肝癌患者有/无TCEB1基因改变的无病生存曲线。Fig.4 The gene alteration of TCEB1 in HCC tissues and its relationship with prognosis of patients(A)OncoPrint plot of TCEB1 alterations;(B)Relationship between TCEB1 expression and copy number variations(CNVs)in HCC;(C)The overall survival curve of HCC patients with/without TCEB1 alteration;(D)The disease free survival curve of HCC patients with/without TCEB1 alteration.
2.4 TCEB1相关基因及其富集分析结果
为探索TCEB1在肝癌发生发展中可能的生物学功能,我们利用LinkedOmics数据库分析TCGA_LIHC数据集中TCEB1的相关基因。结果表明,以FDR<0.01为筛选标准,共有9 554个相关基因,其中4 152个基因与TCEB1显著正相关,5 402个基因与TCEB1显著负相关(图5A)。图5B和5C分别显示与TCEB1呈显著正相关和负相关的前50个基因。
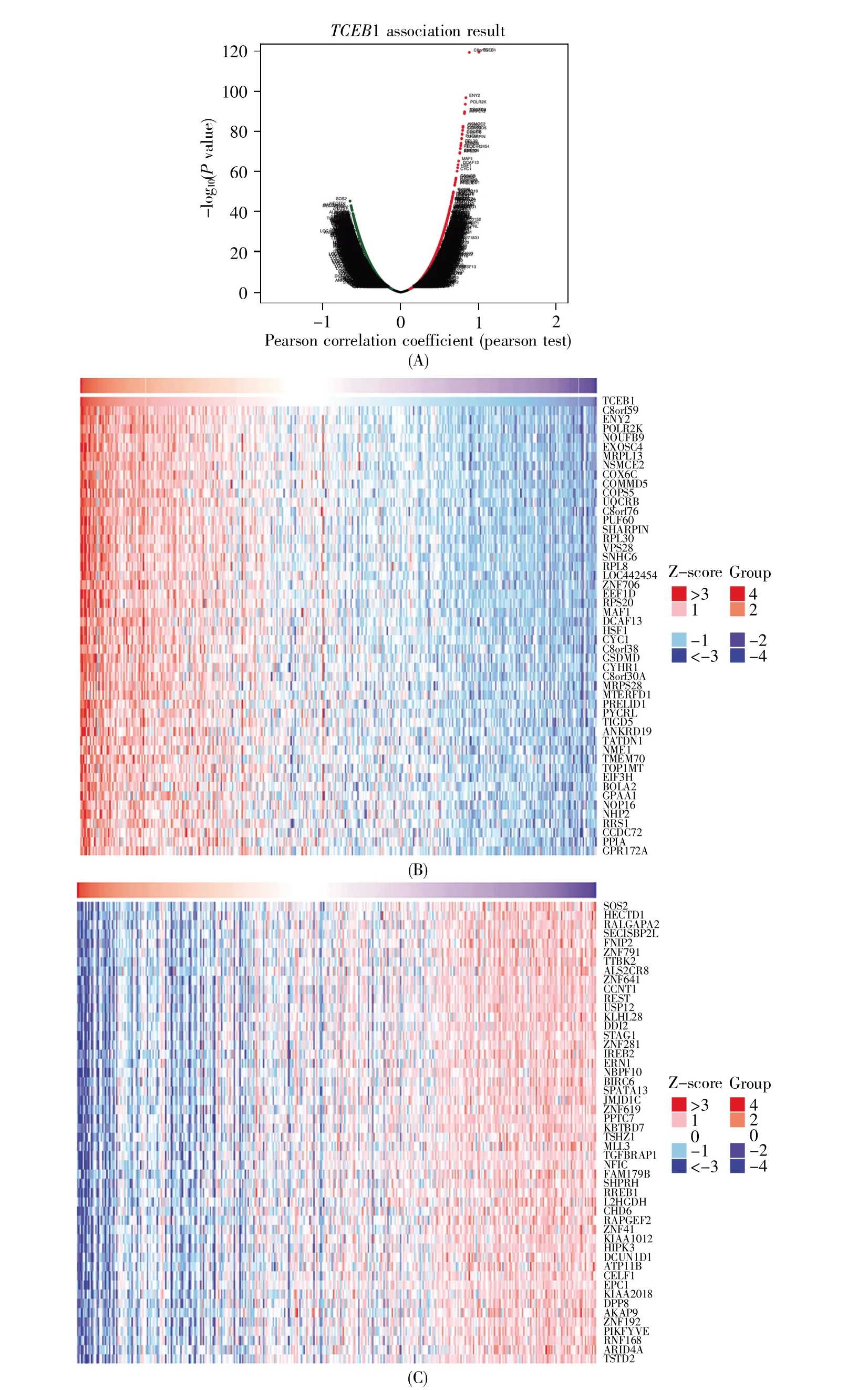
图5 TCEB1相关基因(A)TCEB1相关基因火山图;(B)TCEB1正相关基因热图(前50个基因);(C)TCEB1负相关基因热图(前50个基因)。Fig.5 TCEB1 correlated genes in HCC(A)Volcanic map showing the global highly correlated genes with TCEB1;(B)Heat map showing the top 50 genes positively correlated with TCEB1;(C)Heat map showing the top 50 genes negatively correlated with TCEB1.
我们进一步将P<0.05且相关系数绝对值大于0.5的相关基因通过Metascape进行GO注释和KEGG通路分析。GO注释结果表明,TCEB1及其相关基因在生物过程(biological process,BP)中主要富集在核糖核蛋白复合体生物合成、基因翻译、线粒体的组织等(图6A),在细胞组分(cellular component,CC)中主要富集在核糖体亚单位、包含线粒体蛋白的复合体、转移酶复合体等部位(图6B),在分子功能(molecular function,MF)中主要与转录因子结合、泛素样蛋白转移酶活性、钙黏着蛋白的结合等有关(图6C)。KEGG通路富集分析结果显示,TCEB1相关基因主要富集在核糖体、肾细胞癌、泛素介导的蛋白质水解等信号通路(图6D)。
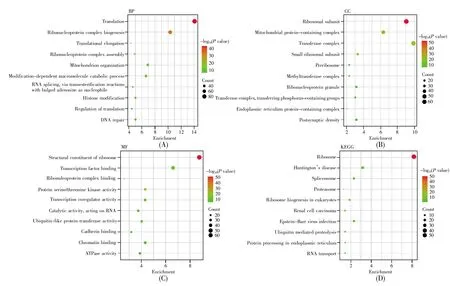
图6 TCEB1相关基因的前10条GO注释和KEGG通路分析(A)生物过程;(B)细胞组分;(C)分子功能;(D)KEGG分析。Fig.6 The top 10 significantly enriched GO annotations and KEGG pathways of TCEB1 related genes(A)The biological process;(B)Cellular component;(C)Molecular function;(D)KEGG analysis.
2.5 TCEB1蛋白相互作用网络
GeneMANIA分析共筛选出20个已证实或预测的与TCEB1相互作用的蛋白质,包括TCEB2、VHL、CUL2、PPRC1、SOCS1、CUL5、RAB40B、PRKAG2、CTD-2410N18.5、SKP1、RBX1、SLC25A39、CBFB、SOCS3、C6orf141、NEK9、STK16、NELFE、TCEB3、POLR2K,相互作用关系包括物理相互作用、共表达、共定位、共享蛋白质结构域、遗传互作(图7)。
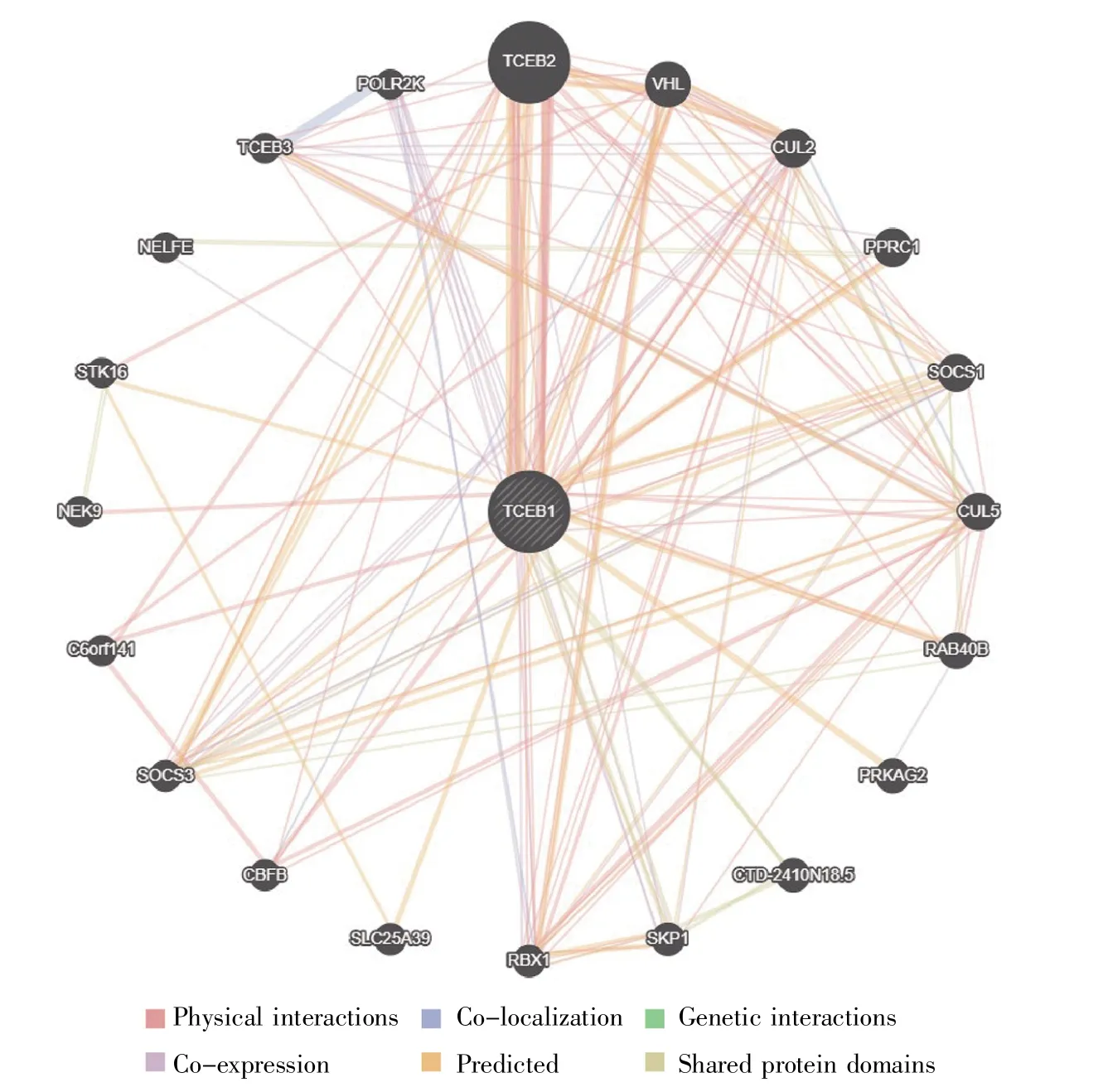
图7 TCEB1的蛋白质相互作用网络Fig.7 The protein-protein interaction network of TCEB1
3 讨论
TCEB1是转录激活因子延伸蛋白复合体(SⅢ)、VHL(von Hippel-Lindau)蛋白复合体和E3泛素连接酶的组成成分[13~15],在细胞中有许多功能。研究表明,含有TCEB1的泛素连接酶可作用于许多转录因子,如低氧诱导因子1α(hypoxia-inducible factor 1α,HIF1α)[16]、p53[17]、c-Myc[18]和核因子 κB(nuclear factor-κB,NF-κB)[19]。TCEB1 不仅可作为底物受体与泛素连接酶的底物直接相互作用[20],还可介导cullin蛋白与底物受体间的连接[21]。TCEB1位于8q21.11染色体区,近年来8号染色体长臂(8q)的扩增被认为与前列腺癌的浸润性进展和不良预后有关[22]。Porkka等[23]通过荧光原位杂交分析表明,23%的激素非依赖型前列腺癌有TCEB1基因扩增,且TCEB1基因扩增与进展期雄激素非依赖型前列腺癌有关,而激素依赖型前列腺癌没有TCEB1基因扩增。Agell等[22]的研究表明,在进展期前列腺癌中,TCEB1的基因和蛋白质表达明显增加。Jalava等[3]的研究表明,TCEB1可能通过增加侵袭相关基因的表达促进前列腺肿瘤细胞的侵袭。Hakimi等[24]通过对TCEB1基因突变的肾细胞癌进行遗传和病理特征分析发现,发生TCEB1基因突变的肾细胞癌是一种不同于透明细胞肾癌和透明细胞乳头状肾癌的特殊类型肾癌。
既往关于TCEB1在肿瘤中的研究主要集中在泌尿系统,尚无在肝癌中的报道。本研究通过对TCGA等数据库的数据挖掘和分析发现,TCEB1在肝癌组织中的表达显著高于正常肝组织(图1),且TCEB1 mRNA在男性患者、肿瘤分级高、合并TP53突变的肝癌组织中水平更高(图2),提示TCEB1可能作为促癌基因参与了肝癌的发生发展。TCEB1基因在肝癌中的表达与性激素、TP53突变的相关性及具体的分子机制值得进一步研究。生存分析结果表明,TCEB1 mRNA水平与患者生存时间呈负相关(图3),提示TCEB1可作为肝癌患者预后不良的预测因子。
通过cBioPortal在线分析7个研究共1 136例肝癌患者的肝癌样本,我们发现有52例(5%)样本存在TCEB1基因改变(图4A),且基因拷贝数扩增与TCEB1 mRNA水平呈正相关(图4B),提示TCEB1在肝癌组织中的表达量增加可能部分与基因拷贝数扩增有关。生存分析表明,与未发生TCEB1基因改变的肝癌患者比较,发生TCEB1基因改变的患者总生存时间显著缩短,提示预后不良(图4C)。但各研究中患者生存数据的定义可能不同,因此,TCEB1的基因改变与患者预后的确切关系有待进一步大样本研究证实。
为进一步探索TCEB1在肝癌中可能的生物学功能,我们对TCEB1相关基因进行了功能注释和通路富集分析,结果提示,TCEB1相关基因的分子功能主要富集于转录因子结合、RNA的催化活性、泛素样蛋白转移酶活性、钙黏着蛋白结合等(图6C),部分与已知TCEB1的功能相一致。钙黏着蛋白是一组跨膜糖蛋白,主要参与同源细胞间的连接。目前,至少有9种钙黏着蛋白亚家族与肿瘤有关,其中E-钙黏着蛋白的功能缺失被认为是上皮间质转化过程中的重要事件,而后者是肿瘤侵袭、转移的重要信号,因此,E-钙黏着蛋白被认为是肿瘤生长侵袭的重要抑制因子[25]。本研究提示,TCEB1相关基因的分子功能与钙黏着蛋白结合有关,说明TCEB1可能通过影响钙黏着蛋白的分子功能促进肝癌细胞的侵袭转移,但这一假设需进一步的实验研究证实。
通过GeneMANIA构建的TCEB1蛋白相互作用网络显示,TCEB2、VHL、CUL2(Cullin2)等在蛋白质网络中发挥重要作用(图7)。VHL是肿瘤抑制蛋白,研究表明在体外它可与延伸蛋白A竞争性结合延伸蛋白B和C,从而抑制延伸蛋白活性[26]。此外,VHL蛋白可与转录延伸蛋白B和C(TCEB2和 TCEB1)、CUL2、Rbx1形成 VCB-CR 复合体,参与低氧诱导因子(hypoxia inducible factor,HIF)的蛋白质降解[16,27~28]。另有研究表明,TCEB1突变可破坏TCEB1与VHL的结合,导致VHL介导的蛋白质水解功能缺失,这是透明细胞肾细胞癌的共同特征[29]。TCEB1突变在肝癌发生发展中的作用和具体机制有待进一步研究。
综上所述,本研究通过对TCGA等公共数据库的分析发现,TCEB1在肝癌组织中显著高表达,且为肝癌患者的不良预后因素,提示其可能参与了肝癌的发生发展;通过对TCEB1相关基因进行GO和KEGG分析以及构建TCEB1蛋白互作网络,初步探讨了TCBE1在肝癌发生发展中可能的生物学功能。本研究为肝癌患者的预后评估提供了新思路,为其治疗提供了新的潜在分子靶点。