自身免疫性肝炎不典型发作1例报告
2022-11-16周梦婷韩红梅
周梦婷,韩红梅
延边大学附属医院 消化内科,吉林 延吉 133000
自身免疫性肝炎(autoimmune hepatitis,AIH)是一种免疫介导的慢性炎症性肝病,其特点是血清转氨酶和免疫球蛋白IgG升高、血清自身抗体阳性以及特征性组织学异常[1]。AIH也是一种相对罕见,并在临床表现、实验室检查和肝组织病理学表现方面存在很大异质性的疾病[2-3]。AIH的发病率近年来有上升趋势,目前已经建立其临床诊断标准,但部分AIH发作时的表现不典型,10%~15%的患者在AIH急性发作时已知的自身抗体检测为阴性,但在疾病发展过程中出现自身抗体的阳性,自身抗体的存在并不是诊断AIH的先决条件[4]。部分AIH发作时不典型,早期难以诊断,易漏诊和误诊。
1 病例资料
患者女性,56岁,以“间断乏力、纳差、尿黄1个半月”为主诉于2021年10月28日入本院。该患者缘于入院1个半月前无明显诱因出现乏力、纳差,尿呈深黄色,无皮肤瘙痒及白陶土样便,在当地医院住院检查后考虑“急性肝损伤”,给予保肝(具体用药不详)治疗后,症状好转、转氨酶下降(具体不详)出院。于入本院1个月前开始无明显诱因再次出现上述症状,到本院门诊就诊并住院治疗,经系统检查后诊断为“急性肝损伤、EB病毒感染”,给予保肝及更昔洛韦抗病毒治疗后好转出院,出院后继续口服保肝药物。于入院7 d前上述症状再次出现,复查肝功能提示转氨酶较前明显升高,故为进一步诊治于2021年12月7日再次收住本院。患者既往有“甲状腺功能亢进症”病史1年半,口服甲硫咪唑片治疗,发现肝损伤后停用此药。入院查体:心率90次/min,全身皮肤黏膜及巩膜明显黄染,余查体未见明显异常。肝功能(2021年10月28日):AST 299 U/L,ALT 265 U/L,ALP 153 U/L,GGT 202 U/L,TBil 174.7 μmol/L,DBil 144.8 μmol/L,Alb 36 g/L,前白蛋白(PA)80 mg/L;出凝血时间正常;IgG 15.8 g/L;HAV、HBV、HCV、HEV病毒学标志物均阴性,EB病毒(EBV DNA)定量 4.87×102拷贝/mL,巨细胞病毒IgM抗体阴性;自身抗体(ANA、ASMA、抗LKM-1)阴性;游离甲状腺功能:TSH<0.005 μIU/mL,FT3 6.12 pg/mL,FT4 3.05 ng/dL。肝功能(2021年12月8日):AST 684 U/L,ALT 505 U/L,ALP 148 U/L,GGT 404 U/L,TBil 65.3 μmol/L,DBil 49.2 μmol/L,Alb 34 g/L,PA 72 mg/L;出凝血时间正常;IgG 20.80 g/L;铁蛋白248.00 ng/mL;游离甲状腺功能:TSH<0.005 μIU/mL,FT3 6.07 pg/mL,FT4 2.43 ng/dL;裂隙灯检查显示双眼未见K-F环;上腹部增强CT示:肝胆脾胰未见异常,肝内外胆管未见扩张。2021年12月10日检查显示,ANA(核型)阳性(均质型)、ANA(滴度)1∶320,抗dsDNA抗体阳性。2021年12月12日检查显示,EB病毒(EBV DNA)定量<4.00×102拷贝/mL;铜蓝蛋白 23.5 mg/dL。2021年12月13日胃镜示:慢性萎缩性胃炎C-1伴糜烂。2021年12月9日肝活检组织病理诊断(图1):AIH可能性大。综上,明确诊断为AIH(IAIHG的AIH简化诊断标准评分7分)Ⅰ型,甲状腺功能亢进症,入院后给予保肝、碘131治疗;确诊AIH后于2021年12月22日始加用糖皮质激素(美卓乐40 mg,1次/d,口服),并口服抑酸及补钙药物治疗。糖皮质激素治疗1周后肝功能(图2、3)基本恢复正常,故美卓乐每周减4 mg口服;糖皮质激素治疗2周后IgG基本恢复正常(图4);7周后复查ANA及抗dsDNA抗体均为阴性。糖皮质激素治疗期间出现短暂的不良反应,如血压和血糖升高:糖皮质激素治疗2 d后血压升高至160/90 mmHg,口服卡托普利片3 d后血压恢复至正常;糖皮质激素治疗7 d后空腹血糖升高至17.76 mmol/L,控制饮食7 d后空腹血糖降至5.21 mmol/L;另外,糖皮质激素治疗7 d后始出现轻度满月脸表现,但随着糖皮质激素减量其表现渐减轻。目前美卓乐8 mg/d维持治疗,肝功能和IgG一直属于正常值范围,目前仍在随访中。
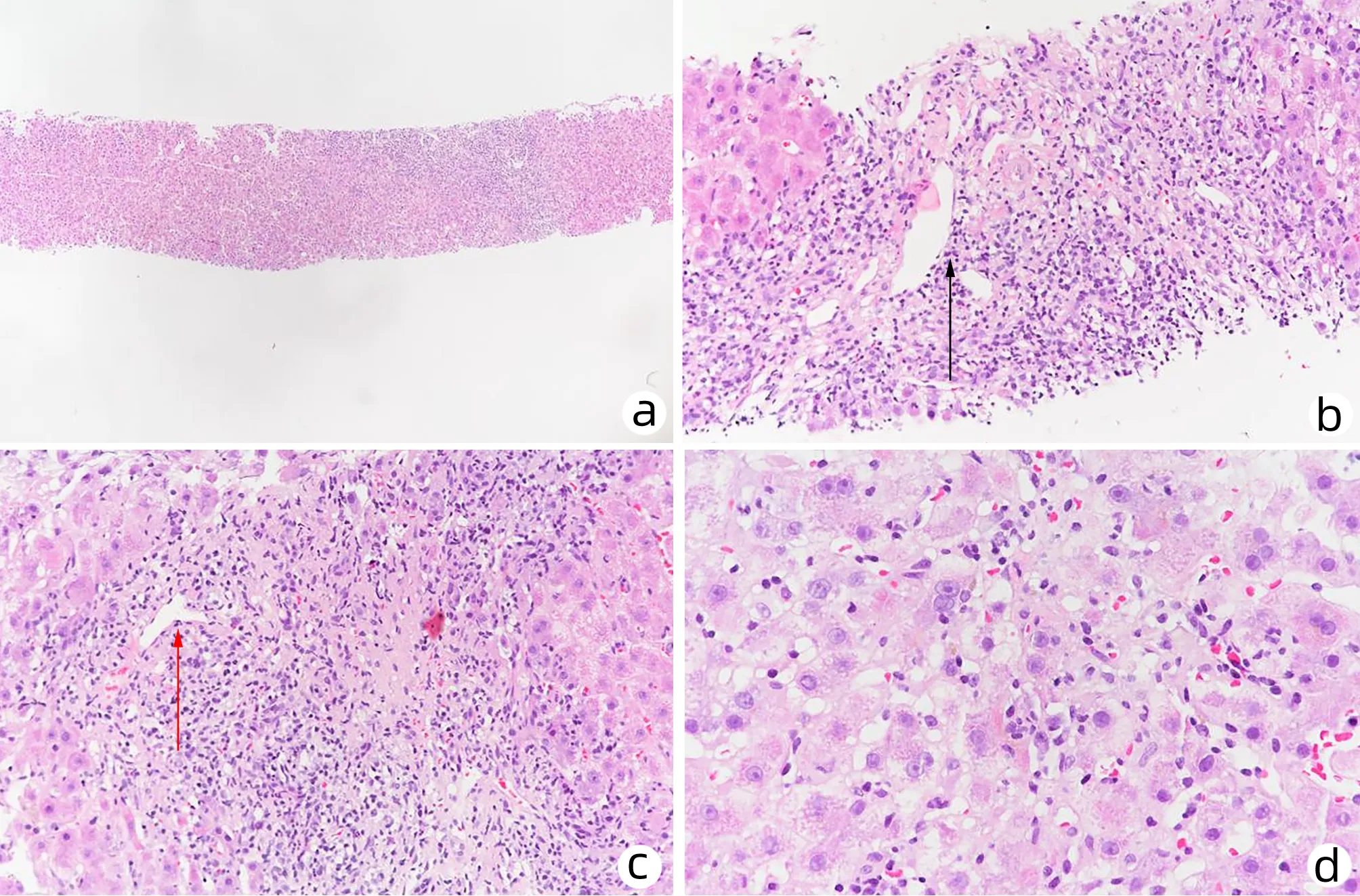
注:a,肝小叶结构轻度紊乱(HE染色,×40);b,汇管区可见浆细胞(黑色箭头所示);小胆管保留,上皮排列不整,可见炎性细胞浸润至胆管上皮间,汇管区周边可见轻度细胆管反应(HE染色,×100);c,汇管区扩大,中度炎性细胞浸润,以单个核细胞浸润为主,中度界面炎(红色箭头所示)(HE染色,×200);d,汇管区间质未见明显纤维组织增生,小叶内见点灶状坏死,部分坏死灶融合,窦内可见明显炎性细胞浸润,亦可见浆细胞(HE染色,×400)。
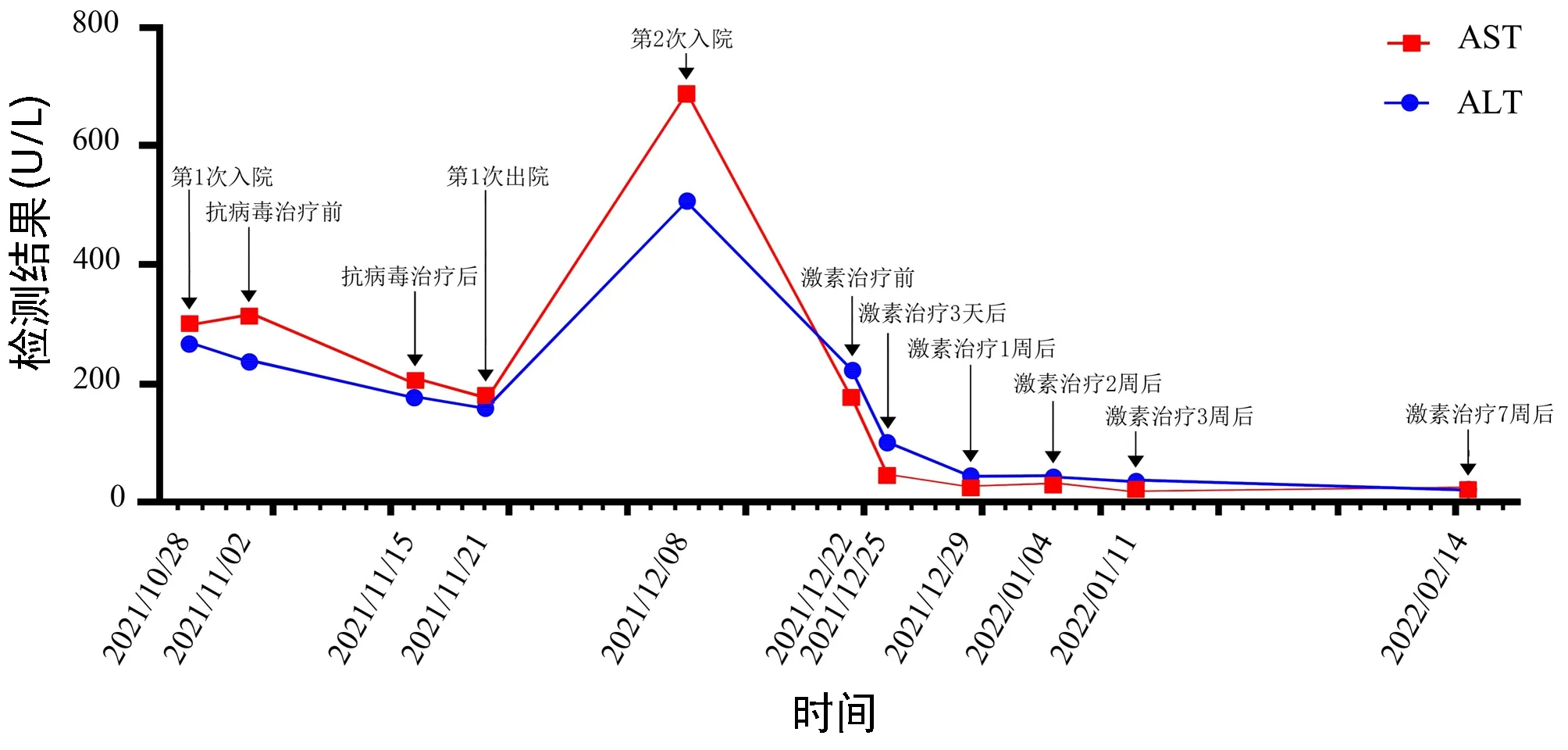
图2 AIH患者转氨酶变化
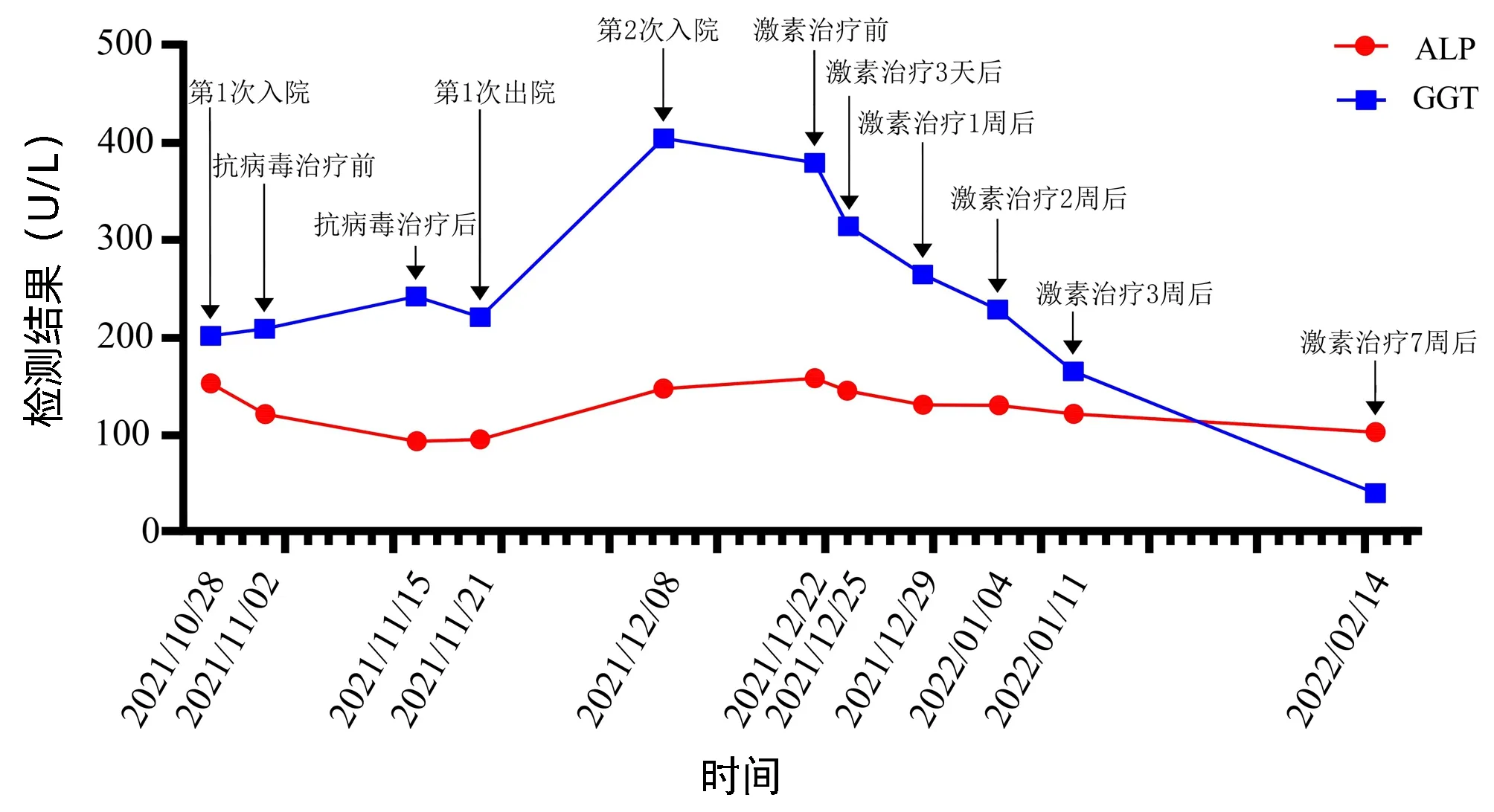
图3 AIH患者ALP、GGT变化

图4 AIH患者IgG变化
2 讨论
AIH是一种免疫介导肝脏炎症,是由机体对肝细胞产生自身抗体及T淋巴细胞介导的自身免疫应答所致。全球范围内流行病学资料显示,AIH好发于50~60岁,且男女比例为1∶4~1∶6[5]。AIH的年发病率0.67/10万人~2.0/10万人[6]。AIH常伴随肝外自身免疫性疾病的发生,它们可发生在AIH的任何阶段。流行病调查[7]显示,10%~23%的AIH患者伴有自身免疫性甲状腺功能亢进症。该患者符合AIH的流行病学特点。
AIH的发病机制尚未完全清楚,但目前在人类白细胞抗原(HLA)区域(HLA-DR3和 DR4)的基因中发现了最强的遗传相关性,参与向T淋巴细胞递呈抗原肽,因此AIH与适应性免疫应答的启动有关[8],且遗传变异、环境因素和表观遗传修饰之间具有复杂的相互作用[9]。至于病毒感染方面,病原体触发AIH的确凿证据仍缺乏。目前认为EB病毒感染后可通过触发识别肝脏特异性自身抗原的自身反应性CD4+T淋巴细胞而参与AIH致病过程[10]。对于该患者可能是EB病毒使处于休眠状态的AIH病情进一步发展或AIH合并EB病毒感染。然而,有趣的是抗病毒治疗后,EB病毒载量虽然降至正常范围,但转氨酶反而明显上升,EB病毒和AIH的关系仍需要进一步研究探讨。
对于AIH的诊断和鉴别诊断仍需综合分析临床症状、体征、血清生化、免疫学指标及肝脏组织学检查,并排除其他引起肝损伤的病因。然而,本病起病隐匿,临床表现复杂多样,容易漏诊、误治,约1/3的患者在诊断时已进展为肝硬化阶段[11]。该患者起病呈急性发作,发病时仅有乏力、纳差、尿黄等临床表现伴转氨酶升高,而IgG正常、AIH相关的自身抗体(包括ANA、ASMA、抗LKM-1)均为阴性,表现为不典型。但急性发作约1个半月后出现典型表现,如IgG升高、ANA阳性和AIH病理改变。该患者发病时AIH表现不典型,在疾病发展过程中才出现为ANA阳性、IgG升高等典型表现。目前临床上对AIH的诊断多采用国际AIH简化诊断标准,≥7分即可诊断为AIH。患者发病初期简化AIH诊断积分为2分,然而1999年版本AIH综合诊断积分系统评分为12分,符合“AIH可能”,故对于疑似AIH或不能排除AIH的患者,建议利用1999年AIH综合诊断积分系统进行评分以避免漏诊。如怀疑“AIH”则需进一步做肝组织活检以明确诊断。AIH的典型组织学特征是界面性肝炎、淋巴-浆细胞浸润、肝细胞呈“玫瑰花环”样结构和穿入现象[12]。
长期未治疗的AIH与肝硬化、肝衰竭和/或肝细胞癌的风险增加有关,病死率极高,及时诊断和积极治疗可降低患者不良结局发生。该患者为活动性AIH(血清转氨酶水平>3×ULN,组织学存在中度界面性肝炎),符合免疫抑制剂治疗指征,因患者不同意用硫唑嘌呤,故单用糖皮质激素治疗,目前该患者对糖皮质激素治疗应答良好,无明显严重不良反应,病情已达到缓解。该患者用糖皮质激素治疗1周后转氨酶基本恢复正常,2周后IgG基本恢复正常;7周后ANA阴性。遗憾的是,用糖皮质激素治疗期间未监测ANA的变化。今后将在临床工作中研究ANA在AIH发生和发展过程中的变化以及糖皮质激素治疗后的变化。美国肝病学会(AASLD)和欧洲肝病学会(EASL)的指南建议,免疫抑制剂治疗至少应维持2~3年,且停药前建议行肝组织学检查[13]。但停药后50%~90%的患者会在停药1年内复发[11]。停药后复发的AIH患者应以初始治疗相似的方案进行治疗,并推荐尽可能联合治疗并长期维持[1]。
总之,AIH的整个病程中临床表现复杂多变,是诊断与鉴别诊断的难点。尽管已经有AIH的临床诊断标准和评分系统,并且已经在实际临床工作中得到了广泛的验证,但由于缺乏特异性自身抗体,仍有部分不典型的AIH患者难以依赖现有的AIH诊断标准进行明确诊断。因此,在现有的诊断标准基础上,仍然需要继续探究更多的AIH的辅助诊断方法。
伦理学声明:本例报告已获得患者知情同意。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:周梦婷负责资料分析,撰写论文,修改论文;韩红梅负责拟定写作思路,指导撰写文章并最后定稿。
志谢:感谢北京友谊医院肝病中心赵新颜主任对肝脏组织病理学诊断的指导。
