曲美他嗪对胆管缺血再灌注损伤大鼠模型的影响及其机制
2022-11-16张锦锐张雅敏
张锦锐,吴 昊,白 易,张雅敏
1 天津医科大学一中心临床学院,天津 300070;2 卫生部危重病急救医学重点实验室,天津 300192;3 天津市第一中心医院 肝胆外科,天津 300192
缺血性胆管损伤(ischemic-type biliary lesions, ITBL)是肝移植术后严重并发症之一,往往需要反复进行侵入性胆道手术,最终可能导致患者再次移植甚至死亡[1]。ITBL的主要发病原因为器官的缺血再灌注损伤(ischemia-reperfusion injury, IRI),表现为供肝非吻合口部位变薄、狭窄、扩张等,影响患者肝功能,由于其发病率较高且患者预后较差,因此探究降低ITBL发生率的新方法,提高肝移植手术成功率具有重要临床意义[2-3]。曲美他嗪(Trimetazidine, TMZ)是一种调节代谢抗氧化抗缺血的药物,在临床上被广泛用于治疗缺血性心脏病,可通过提高细胞缺氧状态下的能量利用和抗氧化应激、抗凋亡能力等途径增强细胞的缺血缺氧耐受力[4]。已有相关研究[5]表明,TMZ可减轻大鼠肝脏IRI,但其对胆管IRI的作用尚不明确。本研究拟通过构建大鼠ITBL模型,探明TMZ对ITBL的保护作用及其潜在机制,为减轻ITBL丰富思路。
1 材料与方法
1.1 实验动物 雄性SPF级SD大鼠,体质量在200~250 g之间,购自北京维通利华有限公司,饲养在昼夜轮替各12 h的环境中,自由饮食,适应环境1周后开始实验。实验动物生产许可证编号:SCXK(京)2016-0006;实验动物使用许可证编号:SYXK(津)2019-0004。
1.2 主要试剂 TMZ(法国施维雅公司),水合氯醛(美国Sigma公司),超氧化物歧化酶(SOD)检测试剂盒、脂质氧化检测试剂盒、BCA蛋白定量试剂盒(上海碧云天公司),SDS-PAGE凝胶制备试剂盒(武汉博士德生物公司),兔抗人核因子红系2相关因子2(Nrf2)、血红素加氧酶-1(HO-1)、抗凋亡蛋白B细胞淋巴瘤-2(Bcl-2)、半胱天冬酶-3(Caspase-3)、β-肌动蛋白(β-actin)以及山羊抗兔IgG(英国Abcam公司)。
1.3 方法
1.3.1 分组 采用随机数字表法将40只大鼠随机分为4组:(1)假手术组(Sham组,n=10);(2)胆管缺血模型组(BIRI组,n=10);(3)术前6 h TMZ预处理组(TMZ-6h组,n=10),术前6 h TMZ灌胃(10 mg/kg);(4)术前3 d TMZ预处理组(TMZ-3d组,n=10),术前3 d每天TMZ灌胃(10 mg·kg-1·d-1)。Sham组、BIRI组、TMZ-6h组术前3 d每天给予和TMZ-3d组相同液体量的生理盐水灌胃。
1.3.2 大鼠ITBL模型构建和取材 术前12 h禁食,4 h禁水。5%水合氯醛(0.6 mL/100 g)腹腔注射麻醉,常规备皮,消毒铺巾,取腹部正中切口进入腹腔;充分暴露肝脏及其周围组织,离断肝脏周围韧带,再向上翻动肝脏,显露胆总管、门静脉及肝固有动脉,同时离断胃及十二指肠周围韧带。使用无损伤血管夹在近肝门处夹闭肝固有动脉和胆总管远端,30 min后松开血管夹恢复血供并关腹。Sham组仅充分暴露肝脏并翻动肝脏后关腹。各组大鼠术后24 h再次麻醉后开腹,使用5 mL注射器从下腔静脉采血2~3 mL,4 ℃ 3000 r/min离心10 min,收集血清-80 ℃保存。每组各取5只大鼠胆管组织浸泡于10%多聚甲醛中固定。每组剩余的5只大鼠胆管组织在冰面上用组织剪剪碎后放入-80 ℃冰箱保存。
1.3.3 胆管组织病理学检查 取出固定48 h后的胆管组织,修剪后冲洗、脱水,再放入二甲苯中进行透明处理,然后石蜡包埋,切片,60 ℃烤箱烘烤2 h,置于载玻片后放入45 ℃恒温箱中烘干;二甲苯脱蜡、组织软化,苏木精、伊红染色,显微镜下观察胆管形态。
1.3.4 血清生化检测 取已收集的血清采用全自动生化分析仪检测 ALT、ALP、DBil等指标。
1.3.5 SOD活性、丙二醛(MDA)水平检测 每组取出5只大鼠胆管组织分别称重,加入RIPA进行匀浆;将匀浆液4 ℃ 12 000×g离心5 min收集上清作为待测样品,用BCA法检测各组裂解液中蛋白浓度。依据说明书步骤完成每步操作,并使用酶标仪测量相应波长的吸光度。再根据各组蛋白浓度计算出每毫克蛋白的SOD活力单位和MDA水平。
1.3.6 Western Blot检测蛋白表达 将第5步所得剩余样本,98 ℃金属浴10 min使蛋白充分变性。依次进行电泳、转模、封闭、一抗孵育过夜,TBST洗涤3次,每次10 min,二抗孵育,TBST再次洗涤3次,曝光。

2 结果
2.1 胆管病理变化 术后24 h(再灌注24 h),Sham组大鼠胆管组织上皮细胞连续性完整,结构正常;BIRI组可观察到大鼠不连续的胆管上皮,伴坏死脱落,少量炎细胞浸润;TMZ-6h组与BIRI组相比,无明显改善;TMZ-3d组大鼠胆管上皮边缘较清晰,少量坏死脱落细胞,与BIRI组相比显著好转(图1)。
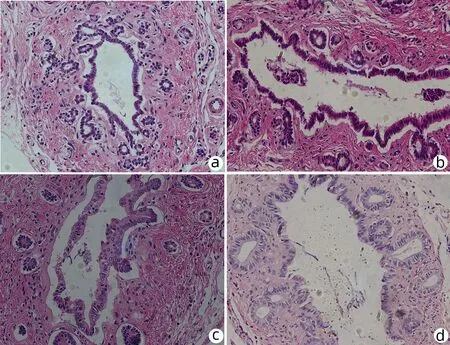
注:a,Sham组;b,BIRI组;c,TMZ-6h组;d,TMZ-3d组。
2.2 血清ALT、ALP、DBil变化 与Sham组相比,BIRI组ALT、ALP、DBil水平均明显升高(P值均<0.05);TMZ-6h组与BIRI组相比,ALT、ALP、DBil水平差异均无统计学意义(P值均>0.05);TMZ-3d组与BIRI组相比,ALT、ALP、DBil水平均显著降低(P值均<0.05)(表1)。
2.3 胆管组织SOD、MDA变化 与Sham组相比,BIRI组胆管组织中的SOD活性显著降低(P<0.05),TMZ-6h组与BIRI组相比无统计学差异(P>0.05),TMZ-3d组则显著高于BIRI组(P<0.05)(表1)。与Sham组比较,BIRI组胆管组织中MDA水平明显升高(P<0.05),TMZ-6h组相较于BIRI组无统计学差异(P>0.05),TMZ-3d组与BIRI组相比显著降低(P<0.05)(表1)。

表1 各组大鼠血生化指标和胆管组织氧化应激指标比较结果
2.4 氧化应激和凋亡相关蛋白表达变化 与Sham组相比,BIRI组Nrf2、HO-1及活化的Caspase-3蛋白表达水平均显著升高,Bcl-2蛋白表达水平显著降低(P值均<0.05);TMZ-6h组Nrf2、HO-1、Bcl-2及活化的Caspase-3蛋白表达水平与BIRI组相比差异均无统计学意义(P值均>0.05);TMZ-3d组Nrf2、HO-1和Bcl-2蛋白表达水平较BIRI组明显增高,而活化的Caspase-3表达水平明显降低(P值均<0.05)(图2)。

图2 各组大鼠胆管组织氧化应激与凋亡相关蛋白表达水平
3 讨论
目前常用的大鼠胆管IRI模型有:Kamada等[6]的“双袖套法”原位肝移植模型,Zhao等[7]建立的大鼠自体肝移植模型,以及夹闭再通肝左、右动脉和胆管的IRI模型[8]。原位肝移植模型虽最真实地还原了临床肝移植手术过程,但存在操作难度大、术后异体免疫排斥反应等缺点。自体肝移植模型虽无异体免疫排斥反应,但因上肝和下肝等所有操作均在同一只大鼠身上完成,存在手术时间过长等问题。夹闭再通肝动脉和胆管这一方法操作简便,且较好地模拟了胆管组织缺血和再灌注的全过程,是研究胆管IRI的较理想方法。因此笔者团队选择该方法作为研究胆管IRI的模型。
TMZ作为良好的抗心绞痛药物,其作用机制是通过促进细胞在缺氧状态下ATP的形成和减轻酸中毒来改善缺血心肌的代谢[9]。2021年一项关于猪肾移植的研究[10]表明,TMZ可通过减轻氧化应激、炎症细胞因子的释放,维持线粒体功能、细胞能量平衡,发挥肾脏保护作用。另一项关于大鼠肝移植的研究[11]揭示了TMZ可通过激活AMPK途径抑制细胞内质网应激,减轻肝移植供肝的IRI。这些研究均提示TMZ对细胞IRI具有一定的保护作用。为探究TMZ对肝移植术后缺血胆管组织是否具有保护作用,笔者利用大鼠胆管缺血性损伤模型加以验证。首先TMZ预处理6 h后,胆管IRI并未明显改善;随后参考文献[12]方法将TMZ预处理时间延长至3 d,胆管IRI发生了较显著改善。这表明TMZ对大鼠胆管 IRI的保护作用并不能立即生效,而需要一定的作用时间,原因可能是由于TMZ发挥作用具有一定的时间依赖性。另外,本研究只观察了再灌注24 h的胆管组织,而TMZ对再灌注更长期的胆管组织变化的影响仍需进一步明确。血清ALT、ALP、DBil等是临床上常用的胆道疾病检测指标,具有较好的特异性。通过对这些指标的检测,说明了TMZ对胆管IRI的保护作用。
当器官发生IRI时,细胞产生大量活性氧自由基(ROS),诱导细胞大分子氧化修饰,抑制蛋白质功能,损伤线粒体DNA等,促进细胞凋亡,导致器官损伤[13]。SOD是组织细胞内的一种重要抗氧化酶;MDA是生物体内ROS作用于脂质发生过氧化反应生成的产物,MDA的集聚能加剧细胞膜的损伤。因此检测组织内SOD和MDA水平可间接反映机体氧化应激程度。本研究通过检测大鼠胆管IRI后,胆管组织内的SOD、MDA水平,证明了氧化应激反应参与胆管IRI过程,同时TMZ减轻了胆管IRI过程中的氧化应激现象。值得注意的是,在TMZ预处理6 h后,大鼠胆管组织SOD和MDA水平与BIRI组相比无明显变化,这与本研究胆管组织病理结果相吻合。
Nrf2是组织细胞内广谱的调节氧化应激的关键因子,参与了多条抗氧化应激、抗凋亡通路[14];HO-1是Nrf2下游直接发挥抗氧化应激作用的关键酶之一,能够抑制组织细胞发生的氧化应激、凋亡等过程。有研究[15]发现,通过给予小鼠促进Nrf2释放的药物,增加HO-1的表达,减轻了小鼠肝脏IRI。为进一步明确TMZ减轻胆管IRI的机制,本研究将Nrf2和HO-1作为氧化应激通路的标志物,通过Western Blot检测了各组大鼠胆管组织中两种蛋白的表达情况,同时检测了凋亡经典信号分子Bcl-2和Caspase-3蛋白表达情况,以明确组织凋亡情况,研究结果表明TMZ可能通过Nrf2/HO-1通路,降低大鼠胆管细胞凋亡,减轻胆管IRI。
综上,本研究证明了TMZ预处理可改善胆管IRI。其机制可能为TMZ激活Nrf2,促进HO-1的表达,抑制了胆管细胞的氧化应激和凋亡。这为未来临床治疗肝移植后ITBL提供了新的思路。关于TMZ的有效给药方案,笔者团队会进一步加以探究。
伦理学声明:本研究方案于2016年3月4日经由天津市第一中心医院实验动物伦理委员会审批,批号:2016-03-A1,符合实验室动物管理与使用准则。
利益冲突声明:本研究不存在研究者、伦理委员会成员以及与公开研究成果有关的利益冲突。
作者贡献声明:张锦锐负责课题设计,实施实验,数据分析及撰写论文;吴昊参与实验,修改论文;白易负责实验指导,修改论文;张雅敏负责指导撰写文章并最后定稿。
