基于超声造影LI-RADS特征的肝细胞癌微血管侵犯列线图模型的构建及验证
2022-11-16顾美琴包作伟
奚 静,顾美琴,包作伟
1 江苏大学附属武进医院(徐州医科大学武进临床学院)超声科,江苏 常州 213000;2 常州市第三人民医院 超声科,江苏 常州 213000
肝细胞癌(HCC)在我国的发病率居男性所有恶性肿瘤第5位和女性第8位,早期手术根治性切除仍是目前主要的临床方案,但是术后5年无复发生存率较低,仅为26%~40%[1]。研究[2]证实微血管侵犯(microvascular invasion,MVI)是手术残留和术后早期复发的重要原因,是预测患者生存率的有用参数之一。与MVI阴性患者相比,MVI阳性患者更早、更易出现肿瘤肝内转移,导致总体生存预后不理想[3]。因此,MVI阳性HCC首选更大范围的手术切缘(>5 mm)。目前,术后肿瘤标本的病理检查仍然是确定MVI的“金标准”,但不能用于术前评估MVI的发生风险。因此,建立一个基于术前变量的预测模型评估MVI对制订恰当的手术方案非常重要。腹部超声检查是诊断HCC、评估肿瘤分期和制订治疗方案的重要工具[4-5]。与CT和MRI的增强模式相比,超声造影(contrast-enhanced ultrasound,CEUS)能够实现动态、实时扫描,真实反映肿瘤微环境中的血管状况,具有无射线暴露、重复性强和费用低廉的优点[6-7]。CEUS灌注特征[即动脉期高强化(arterial phase hyperenhancement,APHE)模式及造影剂清除时间]可用于识别肿瘤的侵袭特征,如分化程度和MVI[8-10]。2011年,美国放射学会发布了基于CEUS的肝脏成像报告和数据系统(liver imaging report and data system,LI-RADS),并相继进行了4次更新。目前,尚缺乏关于CEUS LI-RADS特征与HCC MVI之间的关系研究。本研究主要基于HCC患者CEUS LI-RADS特征建立预测MVI的列线图模型并进行验证。
1 资料与方法
1.1 研究对象 采用单中心、回顾性临床病例研究,纳入2017年1月—2020年7月在江苏大学附属武进医院确诊的HCC患者共262例,按照1∶1比例随机分为建模组和验证组各131例,以术后镜下病理结果确诊MVI。
纳入标准:(1)年龄>18岁;(2)符合HCC的病理诊断,术前未进行放化疗;(3)无明确的肝动脉或者静脉癌栓征象。排除标准:(1)转移性肝癌,其他部位原发肿瘤;(2)超声图像不清晰,结果判读不能达成一致;(3)肝移植、肝功能衰竭;(4)自身免疫性疾病;(5)临床资料不完整。
1.2 研究方法
1.2.1 收集资料 包括性别、年龄、是否合并乙型肝炎和肝硬化、肿瘤TNM分期和分化级别,血生化指标包括凝血酶原时间(PT)是否>14 s、血清AFP、PLT、TBil、Alb和ALT水平。二维超声观察肿瘤直径是否≥30 mm、回声类型(低、等或高)、有无边缘不清、不规则外形、Halo征和血管分布(少、多),CEUS LI-RADS特征包括分级(3~4、5和M)、LR-5动脉期增强和造影剂“后出”征象、LR-M边缘增强和“先出”征象、镶嵌图形征和结节征。
1.2.2 超声检查 采用意大利MyLab 90 X型ESAOTE超声检查仪及配套腹部线性探头,包括二维超声和造影探头。首先进行二维超声检查,确定肿瘤病灶并记录肿瘤直径的最大横截面。然后启动造影模式,经外周静脉套管团注2.4 mL SonoVue造影剂(意大利Bracco公司),随后注入5 mL生理盐水进行冲洗,同时启动超声计时器。连续扫描肝脏局灶病变(FLL)捕获动脉相,持续约60 s,对于多发病灶可适当延长观察时间;然后对每个FLL进行20~30 s的间歇性观察,直到微泡从循环中清除(通常长达5 min)。录制所有视频剪辑并传输到系统自带后处理工作站,由2名经验丰富的超声科医师独立阅片并进行判读,当结果不一致时由第3位经验丰富的超声科专家进行判断。
1.2.3 结果判读 与周围实质的回声相比,定义为等回声、低回声或高回声。病灶的外形分为圆形/椭圆形或不规则形。边缘分为清晰边界和界限不清。彩色多普勒超声图像判断肿瘤内血管形成,分为少(肿块内不超过3个血管段)和多(肿块内超过3个血管段)。LI-RADS分级[11]包括LR-3、4、5和M,其中LR-3定义为FLL超过20 mm,同时无延迟造影剂清除的APHE;LR-4定义为FLL超过20 mm,同时无APHE和造影剂“后出”征象,或者FLL<20 mm,同时无APHE,或者FLL<10 mm,同时有延迟造影剂清除的APHE;LR-5定义为FLL>10 mm,同时有APHE和造影剂“后出”征象;LR-M定义为FLL边缘强化,或造影剂“先出”征象,无论病变大小(图1)。
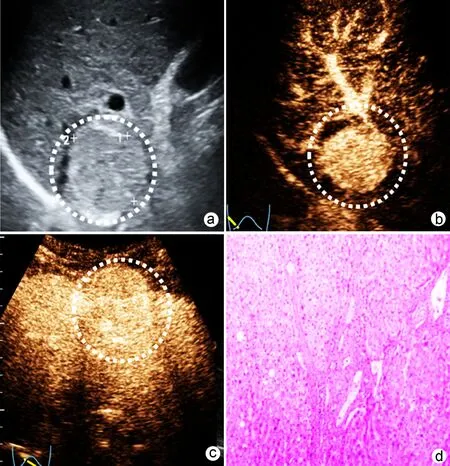
注:a,肝硬化患者超声显示肿瘤直径35.5 mm,低回声(虚线处);b,MVI阴性,LR-5动脉期增强和“后出”征象(虚线处);c,MVI阳性,LR-M边缘增强和“先出”征象(虚线处);d,病理标本显示分化良好,无MVI(HE染色,×100)。
2 结果
2.1 建模组与验证组的临床资料 建模组与验证组患者的临床资料和CEUS结果比较,差异均无统计学意义(P值均>0.05)(表1)。

表1 建模组与验证组的临床资料和CEUS特征比较
2.2 MVI的危险因素分析 建模组确诊MVI 70例,以MVI(阳性=1,阴性=0)作为因变量进行Logistic回归分析。AFP连续性变量转换为分类变量,根据百分位数,<20 ng/mL赋值=1,20~400 ng/mL赋值=2,≥400 ng/mL赋值=3。
单因素分析显示,与MVI阴性患者相比,MVI阳性患者血清AFP水平明显升高,肿瘤直径增大,LI-RADS显示LR-5“后出”和LR-M“先出”增多,LI-RADS分级较高,差异均有统计学意义(P值均<0.05)。多因素分析显示,AFP、肿瘤直径≥30 mm和CEUS显示LR-M是MVI的独立危险因素(P值均<0.05)(表2)。

表2 MVI的危险因素分析
2.3 MVI的列线图模型 根据多因素回归分析筛选的主要危险因素权重值建立列线图模型(图2)。列线图的一致性指数C-Index为0.765(95%CI:0.701~0.834)。

图2 MVI的列线图模型
2.4 列线图模型的ROC曲线分析 ROC曲线结果显示,列线图预测建模组和验证组MVI的AUC值分别为0.867和0.821,95%CI分别为0.779~0.897和0.754~0.882,P值均<0.001;敏感度分别为80.5%和76.3%,特异度分别为72.9%和65.9%(图3)。
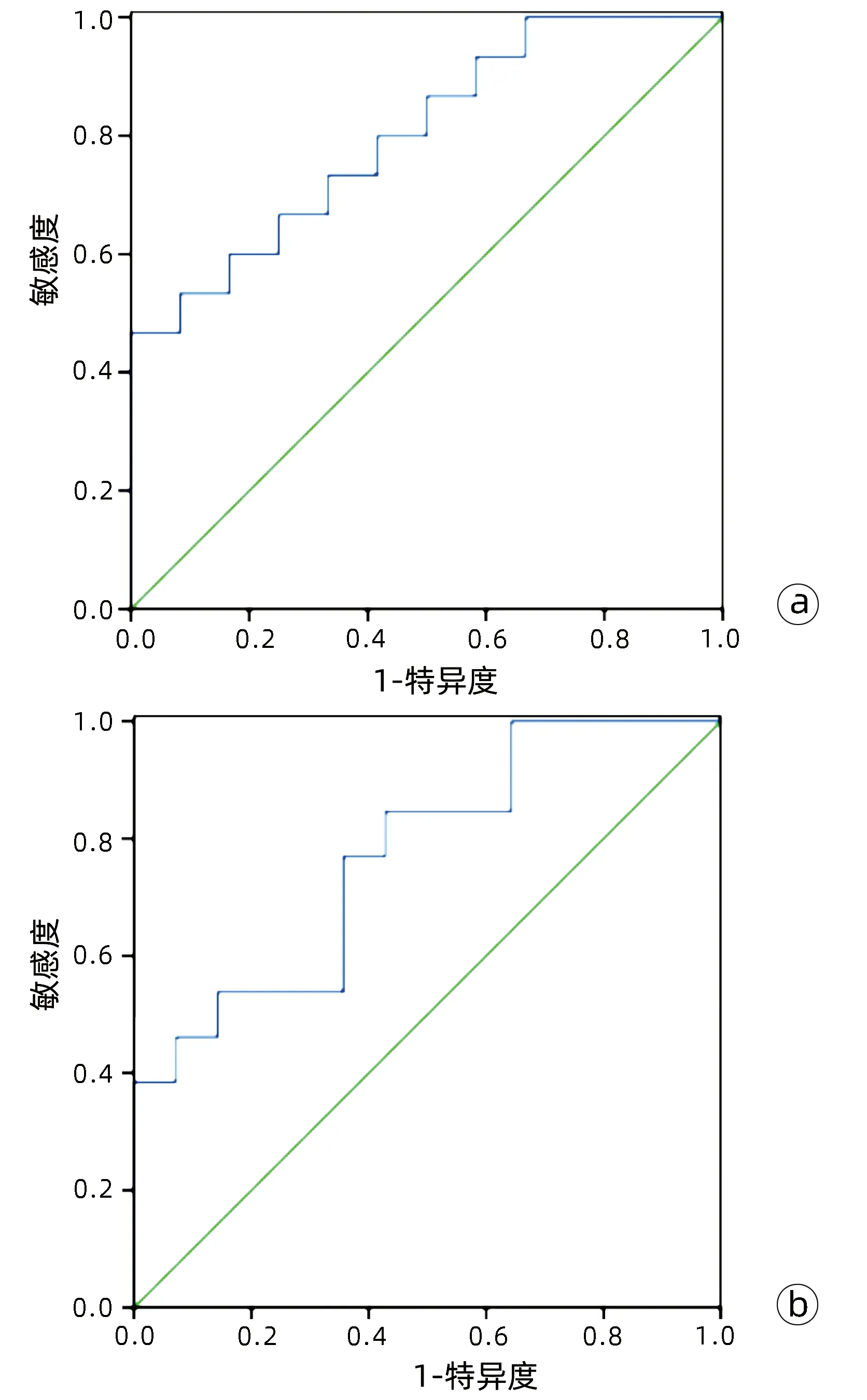
注:a,建模组;b,验证组。
2.5 列线图模型的预测曲线 建模组和验证组的预测校准曲线与标准曲线均接近(图4)。
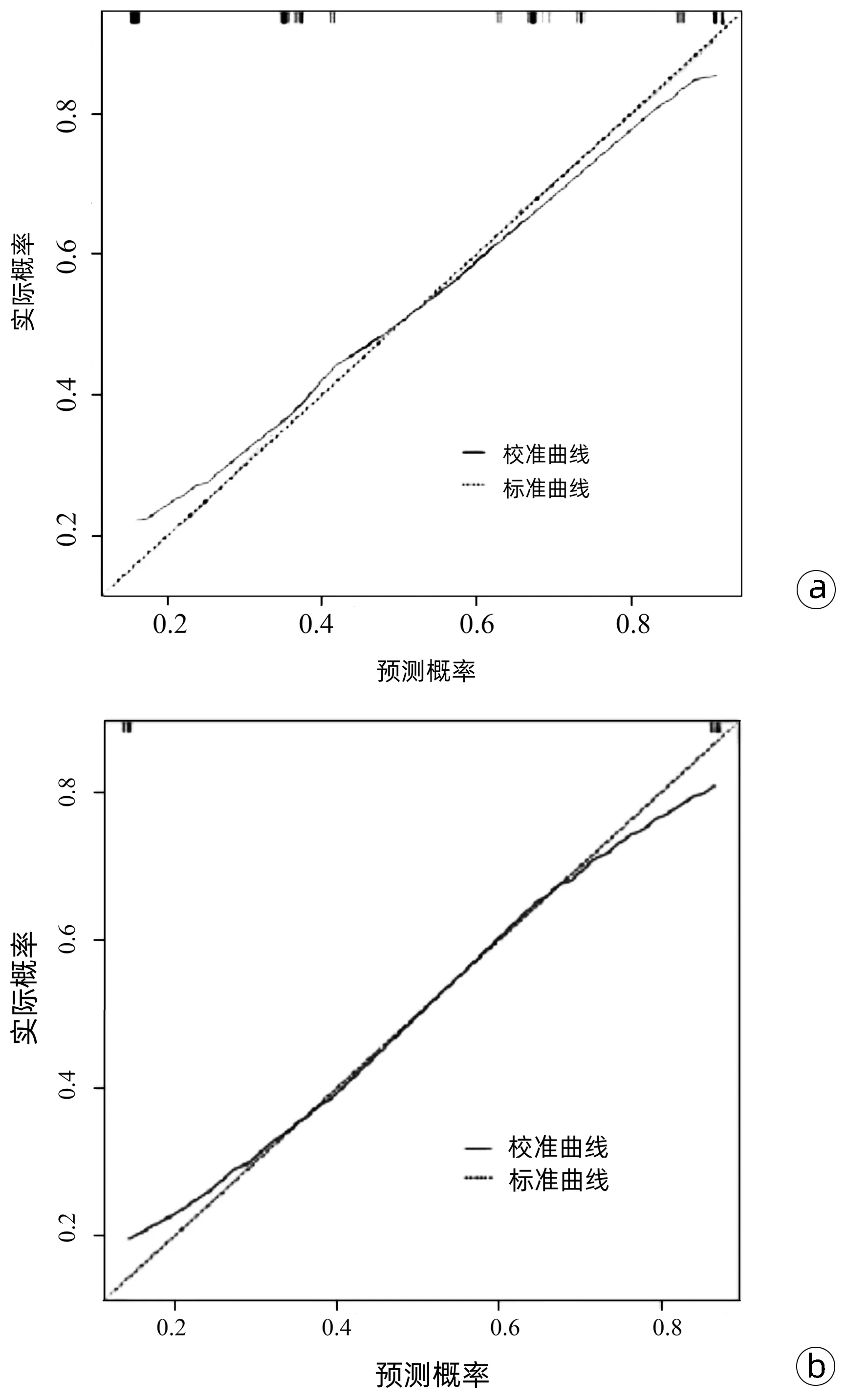
注:a,建模组;b,验证组。
3 讨论
CEUS是术前描述肝脏局灶性病变的重要工具。本研究显示,HCC患者MVI的发生率为48.1%,与既往大样本调查[12]结果基本一致。MVI在HCC中发生率较高,是导致术后肿瘤复发率升高和生存率下降的重要不利因素。影响MVI的发生因素较多,如手术是否根治、肿瘤分期和分化程度、患者自身代谢等[13-14],筛选与MVI发生密切的危险因素并建立简便、可视化的列线图模型,对指导术前识别MVI高危患者并制定恰当的手术方案具有较好的应用价值。
AFP 已被证实是诊断HCC的敏感性和特异性较高的生化标志物,AFP>400 ng/mL是MVI的最佳预测因子,水平越高提示肿瘤的恶性程度越高和代谢能力越强[15]。肿瘤直径>30 mm提示增殖活性旺盛,局部微血管侵犯和邻近组织转移的可能性越大[16]。LR-M最初设计用于各种非肝癌患者的恶性肿瘤评估,表现出明显的影像学特征[17-18]。临床上有不典型的HCC也可归类为LR-M,作为LR-M的主要特征,边缘强化和进行性中央强化是MVI的重要预测因子[19]。Zhu等[20]指出,HCC患者CEUS征象中无造影剂“先出”(即增强期时间<30 s)中MVI阳性率仅为10.5%,而表现为造影剂“先出”征象的HCC患者MVI阳性率高达86.7%,提示造影剂“先出”征象对HCC患者MVI阳性有较好的预测价值。造影剂“先出”与MVI之间的关系,原因推测为门静脉是HCC的主要引流血管,血管闭塞癌栓引起细小分支进一步恶化,减少静脉血流量,有利于“先出”的发生[21]。此外,更大的肿瘤可能表现出较低的分化程度。随着肿瘤直径的增加,细胞增殖率可能增大2~3倍并导致微血管密度进一步降低[22],也是导致“先出”发生的原因。
本研究建立的MVI列线图模型,具有较好的稳定性(C-Index为0.765)。ROC曲线显示,列线图预测建模组和验证组MVI的准确性均较高,并且校准曲线与标准曲线均接近。提示该模型有较好的预测能力。
本研究也有一定的局限性:样本量有限,仅涵盖本中心的病例数据,临床推广还需要谨慎对待。此外,还可能存在其他权重因素影响MVI的发生,如造影前后的肿瘤直径变化。对CEUS的肿瘤征象判断尽管由多位经验丰富的超声科专家进行独立判断,但仍然有一定的主观性,引入客观性更强的参数建立模型对结果的影响可能更小。
综上所述,利用CEUS得出LI-RADS用于评估HCC的MVI发生风险有较好的应用价值,结合AFP和肿瘤直径建立的列线图模型有助于指导临床术前筛选MVI高危患者,从而制订恰当的手术切除方案。
伦理学声明:本研究方案于2016年12月17日经由江苏大学附属武进医院伦理委员会审批,批号:2016-P2-010,所纳入患者均签署知情同意书。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:奚静负责课题设计,资料分析,撰写论文;顾美琴、包作伟参与收集数据,修改论文。
