鱼鳞多肽对酪氨酸酶活性的抑制作用
2022-11-16鞠馨瑶刘攀吴迪程述震徐献兵杜明
鞠馨瑶,刘攀,吴迪,程述震,徐献兵,杜明
(大连工业大学食品学院国家海洋食品工程技术研究中心,辽宁 大连 116034)
罗非鱼原产自非洲,属于热带鱼类,其养殖地遍布140余个国家和地区,是全球第二大养殖鱼品种。中国罗非鱼养殖年产量为162.5万t,约占世界总年产量的1/4,其中,罗非鱼鱼鳞年产量约30万t,鱼鳞中的胶原蛋白常作为包装保鲜剂,用于延长食品保质期[1]。虽然鱼鳞中的胶原蛋白能被有效利用,但鱼鳞中的其余组分尤其是鱼鳞多肽的利用率不高,鱼鳞总体利用率仅达20%,造成了极大的资源浪费[2]。
酪氨酸酶是控制黑色素细胞活性的关键,它决定了黑色素合成的速率,筛选酪氨酸酶抑制剂可以开发美白、祛斑等产品。对于酪氨酸酶的多肽类抑制剂,目前已知的筛选方法较少,应用较为普遍的是采用超滤-液质联用技术对具有靶酶亲和性的物质进行筛选,或先采用Autodock等软件将已知结构的物质与酪氨酸酶的活性中心进行分子对接,从中筛选出能够与酪氨酸酶活性中心有效结合的物质,进行化学合成。对酪氨酸酶的多肽类抑制剂多采用超滤膜进行分离纯化,采用反相高效液相色谱(reverse phase-high performance liquid chromatography,RP-HPLC) 法进行鉴定[3-5]。这些已知方法所制备得到的多肽类组分较复杂,且组分分离不够彻底。同时这些方法操作均十分复杂繁琐,不适合产品的大批量制备生产。
本研究选取来源于罗非鱼鱼磷的多肽粉,对其中能够成功螯合金属铜离子的多肽组分进行洗脱分离,得到具有酪氨酸酶抑制活性的多肽组合物。罗非鱼鱼鳞多肽来源天然,从中筛选到酪氨酸酶抑制剂将会是酶抑制剂领域的重要突破。
1 材料与方法
1.1 材料与试剂
罗非鱼鱼鳞多肽粉:青岛益和兴食品有限公司(中国青岛);无水硫酸铜、1-(2-吡啶偶氮)-2-萘酚[1-(2-pyridinylazo)-2-naohthalenol,PAN]:上海麦克林生化科技有限公司;胰蛋白酶(酶活≥2 500 U/mg)、熊果苷、磷酸盐缓冲液(phosphate buffered saline,PBS):上海阿拉丁生化科技股份有限公司;无水乙醇:天津市大茂化学试剂厂;硫化铵:上海振兴试剂厂;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、酪氨酸酶活性检测试剂盒:北京索莱宝科技有限公司;C18柱填料:苏州纳微科技股份有限公司。以上化学试剂均为分析纯。
1.2 仪器与设备
R502B旋转蒸发仪:巩义市予华仪器有限责任公司;SCIENTZ超声破碎仪:宁波新芝生物科技股份有限公司;C184463C具砂板闪式层析柱:重庆欣维尔玻璃有限公司;EASY-nanoLC 1200 Q ExactiveTM质谱仪:赛默飞世尔科技公司;Infinite M200多功能酶标仪:帝肯上海贸易有限公司。
1.3 方法
1.3.1 多肽溶液的制备
将脱除盐分的鱼鳞多肽粉与水按质量比1∶30混合,并搅拌制成匀浆。随后,加入胰蛋白酶,在pH7、55℃的条件下酶解4 h[6],冷却至室温后进行抽滤得到滤液。将所得滤液通过0.22 μm有机膜过滤,冷冻干燥得到酶解后的多肽粉末,将其与水按1∶25(g/mL)的料液比配制,得到多肽溶液[7]。
1.3.2 超声预处理单因素试验
超声波的空化现象产生的极大压力可以使多肽结构发生改变,氮溶系数增大,从而提高多肽与金属离子的螯合能力[8]。因此,本研究在将鱼鳞多肽与金属铜离子进行螯合前,预先对鱼鳞多肽进行超声处理。
以螯合率为指标,采用单因素试验比较不同的超声功率(300、350、400、450、500、550、600、650 W)、超声温度(30、35、40、45、50、55、60、65 ℃)和多肽浓度(0.06、0.08、0.10、0.12、0.14、0.16、0.18、0.20 g/mL)对金属铜离子螯合率的影响。
1.3.3 多肽与金属铜离子的螯合
多肽与金属铜离子的螯合方法参考郑金熊[9]对多肽锌螯合物的制备方法,并做相关改进。按多肽粉末与无水硫酸铜质量比6∶1,向超声预处理后的多肽溶液中加入无水硫酸铜,用3 mol/L的盐酸和4 mol/L的氢氧化钠调节溶液pH值至6.5,随后在50℃水浴锅中振荡反应1 h,得到多肽-金属铜离子螯合溶液。
1.3.4 金属铜离子螯合率的测定
采用PAN指示剂滴定法测定金属铜离子螯合率[10]。将多肽-金属铜离子螯合溶液冷却至室温,以转速5 000 r/min离心5 min,取上清液,加入5倍体积的无水乙醇。再以转速5 000 r/min离心20 min,收集残渣,对其进行干燥,干燥后产物即为多肽与金属铜离子的螯合物。将该螯合物用蒸馏水溶解,定容至100 mL,取25 mL加入2滴~3滴PAN指示剂,采用EDTA进行滴定,待溶液由紫红色变成淡黄色即为滴定终点,记录此时滴定所消耗EDTA的体积,记为V1(mL)。采用上述方法对螯合溶液(含螯合物及未螯合的肽、金属铜离子)直接滴定,此时滴定所消耗EDTA的体积记为V0(mL)。金属铜离子的螯合率计算公式如下。
1.3.5 柱层析分离纯化
称取50 g经过预处理的C18柱填料,采用湿法装柱(3 cm×20 cm)。将采用优化工艺制备得到的多肽-金属铜离子螯合溶液以1.5 mL/min的流速上样(体积175 mL、浓度5 mg/mL)。上样完成后,先以3倍柱体积的水洗脱,弃去洗脱液,后采用80%甲醇溶液以1.5 mL/min的流速洗脱,收集洗脱液[11]。随后,将上述洗脱后的样品用EDTA进行洗脱,除去样品中的金属铜离子。随后,将上述经EDTA洗脱后的样品溶液进行浓缩、冻干,得到具有金属铜离子螯合能力的多肽粉。
1.3.6 硫化物沉淀法鉴定金属铜离子
采用硫化铵沉淀法对具有金属铜离子螯合能力的多肽进行定性分析,判断金属铜离子是否被脱除干净[12]。分别向经柱层析分离纯化前后的多肽-金属铜离子螯合溶液滴加2滴~3滴饱和硫化铵溶液,观察各溶液颜色变化以及溶液中是否有沉淀生成。
1.3.7 酶活性测定
采用酪氨酸酶活性检测试剂盒,通过微量法测定不同样品的酪氨酸酶活性。检测原理是基于左旋多巴产生的多巴色素在475 nm处有一个特征吸收峰[13]。试验共分为4组:空白组(只含酪氨酸酶和底物酪氨酸)、阳性对照组(5 mg/mL熊果苷溶液)、未处理多肽组(5 mg/mL未经螯合和纯化处理的多肽溶液)和纯化处理多肽组(5 mg/mL柱层析分离纯化后的多肽溶液)。将各组样品与试剂盒中的试剂按体积比1∶9混合后,立即测定10 s时475 nm处的吸光度,记为A1。然后迅速放入37℃水浴中反应3 min,迅速取出,测定190 s时的吸光度,记为 A2,计算 ΔA(ΔA=A2-A1)。酪氨酸酶活性计算方法参照酪氨酸酶活性检测试剂盒说明书,计算公式如下。
式中:V反总为反应总体积,mL;ε为多巴色素的摩尔消光系数,37 000 mol/(L·cm);d为比色皿光径,cm;V样为加入的样品体积,mL;T为反应时间,min。
根据酪氨酸酶活性进一步计算各组样品对酪氨酸酶活性的抑制率,计算公式如下。
1.3.8 纳喷离子源高效液相色谱-串联质谱(nanohigh performance liquid chromatography-tandem mass spectrometry,nano-HPLC-MS/MS)法分析
将具有金属铜离子螯合能力的多肽样品进行前处理。首先,将固相萃取柱插入连有真空泵的萃取装置上,使用1 mL甲醇连续冲洗3次,随后用3 mL含0.1%甲酸的超纯水进行固相萃取柱的活化及平衡。将样品用0.1%甲酰胺水溶液溶解,使样品中蛋白质浓度在2 mg/mL~5 mg/mL,将配制好的样品加入到活化平衡好的SPE柱中,并用1 mL 0.1%FA-H2O冲洗3次脱除盐分,最后采用含80%甲醇洗脱并收集多肽溶液,氮吹干燥后即得最终样品。样品上样前需用0.22 μm滤头过滤,由配备在线纳喷离子源进行分析[14]。共上样3 μL样品(分析柱为Acclaim PepMap C18,75 μm×25 cm),以60 min的梯度分离样品,柱流量控制在300 nL/min,柱温40℃,电喷雾电压2 kV,梯度从2%的B相起始,平衡3 min,在47 min以非线性梯度升高到35%,1 min内升高到100%,维持12 min。质谱参数设置如下。
质谱条件:扫描范围(m/z)200~1 500;分辨率70 000;最大注入时间60 ms。
高分辨高能量碰撞解离质谱条件:分辨率17 500;最大注入时间50 ms;动态排除时间20 s;肽段卡值为-10lgP≥20[15]。获得的原始数据采用Data Analysis 4.0(Bruker Daltonic GmbH,Bremen,Germany)进行特征峰识别,并在PEAKS数据库中搜库匹配,以鉴定具有金属铜离子螯合能力的多肽序列。
1.3.9 分子对接研究
利用PDB数据库对酪氨酸酶的晶体结构进行下载。采用分子对接软件Discovery Studio 3.1,依据由nano-HPLC-MS/MS分析鉴定结果获得的序列绘制出各多肽的结构,并进行分析,选择Docking中的Dock Ligands(CDCOCKER)进行分子对接计算,分析比较酪氨酸酶自身的配体及各个多肽序列与酪氨酸酶活性中心的金属铜离子对接的-CDOCKER_ENERGY和-CDOCKER_INTERACTION_ENERGY值,数值越高说明其与金属铜离子的结合能力越强[16]。
1.4 数据分析
每个试验重复3次。采用Origin 2017软件进行制图。使用SPSS软件在置信区间内(p<0.05)进行统计分析。
2 结果与分析
2.1 超声预处理单因素试验
2.1.1 超声功率对金属铜离子螯合率的影响
不同超声功率对金属铜离子螯合率的影响结果如图1所示。
从图1中可以看出,超声功率对螯合率有较大影响。随着超声功率的增加,鱼鳞多肽与金属铜离子的螯合率先下降后上升再下降。在超声功率为600 W时,金属铜离子螯合率达到最大值,为36.5%。由此推测600 W是较适宜的超声功率,此时多肽结构能够有效舒展,螯合反应结合位点随之暴露,使得金属铜离子螯合率升高[17-18]。因此,本研究选择600 W的超声功率处理鱼鳞多肽。
2.1.2 超声温度对金属铜离子螯合率的影响
不同超声温度对金属铜离子螯合率的影响结果如图2所示。
由图2可知,超声温度为30℃~55℃时,随着超声温度的升高,鱼鳞多肽与金属铜离子的螯合率先降低后升高。在超声温度为55℃时,螯合率达到最大值,为31.7%。继续升温,金属铜离子螯合率反而呈快速下降的趋势。推测这是由于适当提升温度可以促进螯合反应[19]。因此,本研究选择超声温度为55℃处理鱼鳞多肽。
2.1.3 多肽浓度对金属铜离子螯合率的影响
不同多肽浓度对金属铜离子螯合率的影响见图3。
图3表明,随着多肽浓度的增加,金属铜离子的螯合率先升高后降低。当多肽浓度为0.14 g/mL时,螯合率达到最大值,为34.3%。此后,随着多肽浓度继续增加,螯合率呈现下降趋势。推测这是由于适当提高多肽浓度能够增大其与金属铜离子接触的概率,但浓度过高,多肽分子会发生聚集,暴露出的螯合位点随之减少,从而使铜离子螯合率下降[20]。因此,选择0.14 g/mL作为超声预处理的多肽浓度。
综上,对罗非鱼鱼鳞多肽进行超声预处理的工艺条件选取为多肽浓度0.14 g/mL、超声功率600 W、超声温度55℃。
2.2 硫化物沉淀法鉴定结果
通过观察试验现象,纯化前(未经EDTA洗脱)的多肽-金属铜离子螯合溶液呈蓝绿色,在滴加饱和硫酸铵溶液后,溶液中有黑褐色沉淀生成。纯化后(经过EDTA洗脱)的多肽溶液呈黄色,且在滴加饱和硫酸铵溶液后,溶液中没有黑褐色沉淀生成。由此证明,经过EDTA洗脱后的多肽中不再含有金属铜离子,即EDTA可以成功将螯合物中的金属铜离子脱除,使得最终通过C18柱层析法制备获得的样品为具有金属铜离子螯合能力的纯净鱼鳞多肽组分。
2.3 不同样品对酪氨酸酶活性的影响
不同样品对酪氨酸酶活性的影响结果如图4所示。
图4表明,未处理多肽对酪氨酸酶活性不具有抑制作用,相反,会激发酪氨酸酶的活性。因此,事先对多肽进行柱层析分离纯化处理是十分必要的。酪氨酸酶活性测定结果表明,纯化处理多肽可以有效抑制酪氨酸酶的活性。当纯化后的多肽溶液浓度为5 mg/mL时,其对酪氨酸酶活性的抑制率为60.0%,与相同浓度的熊果苷溶液相比具有显著性差异,多肽样品对酪氨酸酶活性的抑制效果更优。
2.4 nano-HPLC-MS/MS鉴定分析
通过nano-HPLC-MS/MS分析,鉴定出鱼鳞多肽组分中特征峰在数据库中能够得到匹配的多肽序列,结果如表1所示。
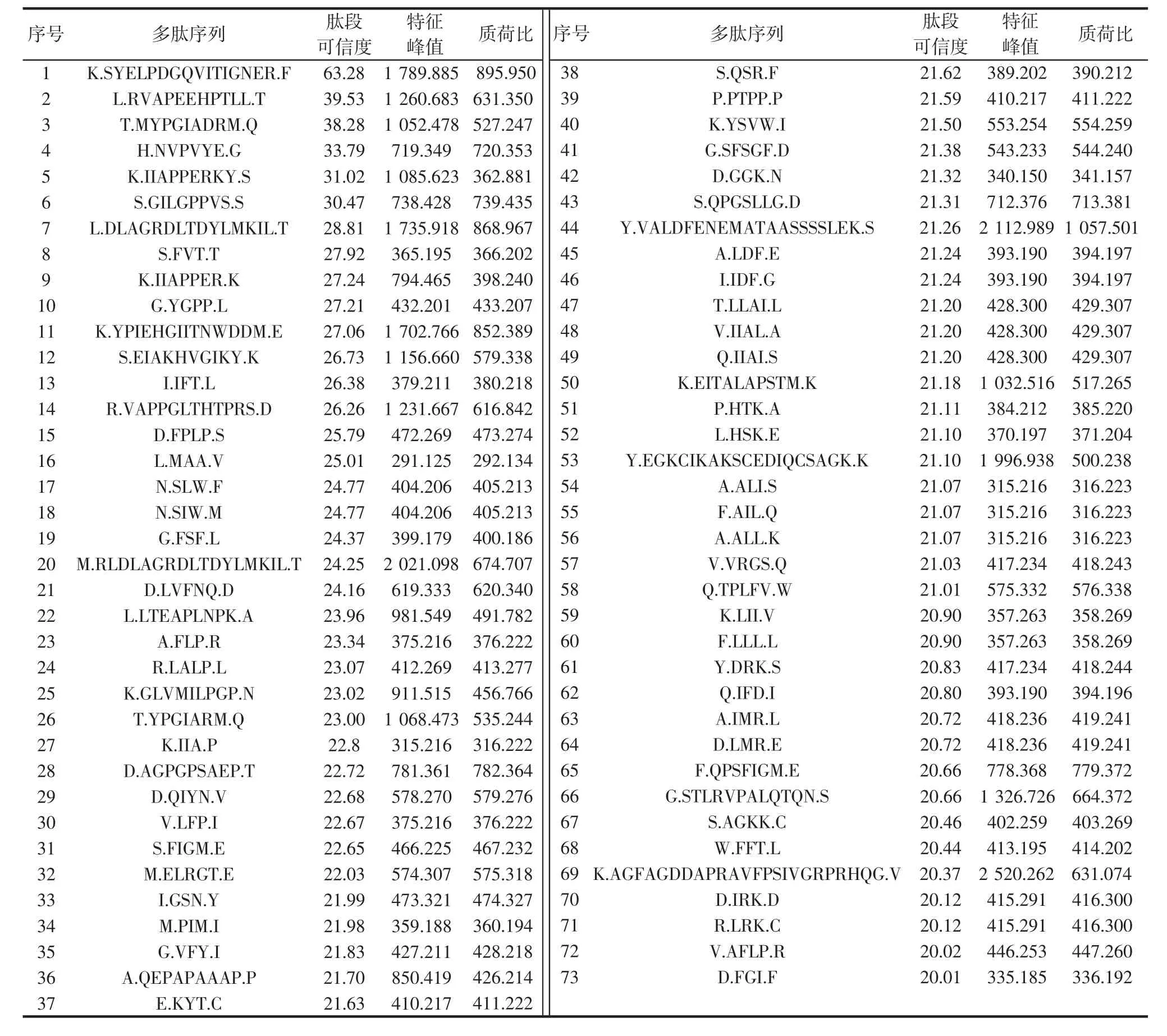
表1 特征峰与数据库匹配的多肽序列Table 1 Characteristic peaks match the polypeptide sequences in database
2.5 分子对接验证
将表1中鉴定得到的各多肽序列与酪氨酸酶活性中心的金属铜离子进行对接,筛选出能够成功与酶活性中心金属铜离子结合的多肽序列,结果如表2所示。
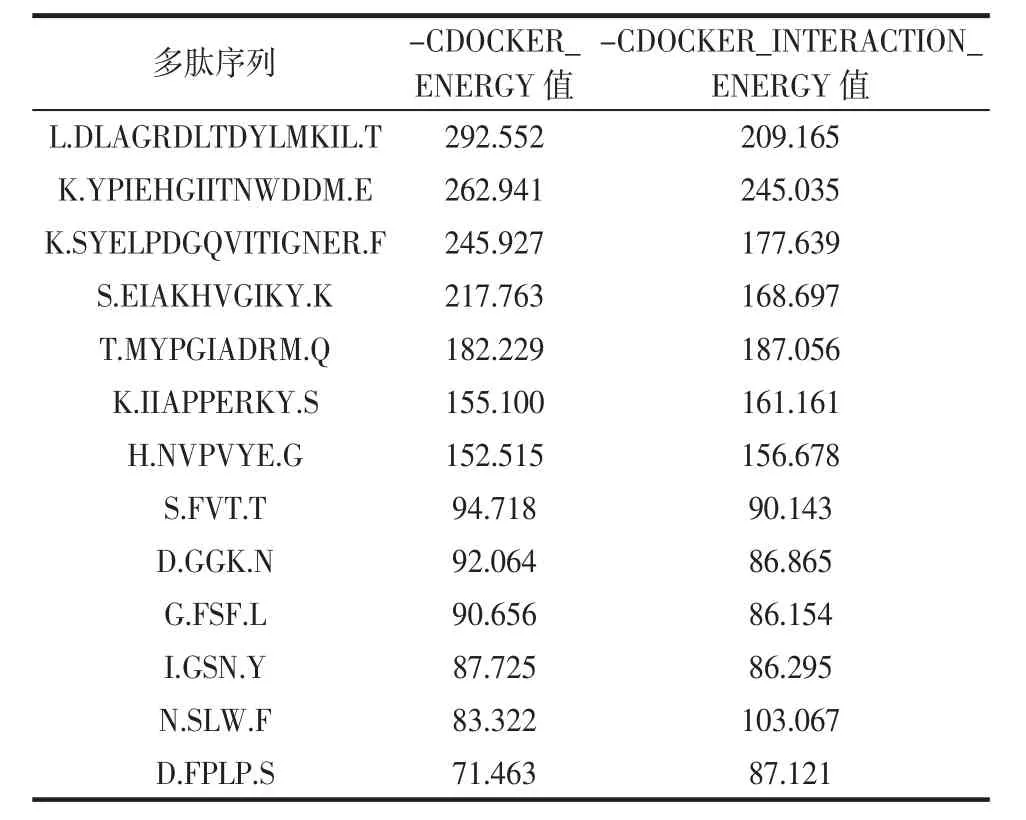
表2 多肽序列分子对接筛选结果Table 2 Molecular docking screening results of peptide sequences
酪氨酸酶自身配体-CDOCKER_ENERGY值和-CDOCKER_INTERACTION_ENERGY值分别为10.232和17.379。由表2可知,具有金属铜离子螯合能力的多肽组分,其-CDOCKER_ENERGY值和-CDOCKER_INTERACTION_ENERGY值均远高于酪氨酸酶自身配体。利用Discovery Studio 3.1软件模拟对接,推测其对酪氨酸酶活性的抑制作用机理是与酶自身配体竞争酶活性中心的金属铜离子,使得酶活性中心结构被破坏,从而对酶活性产生抑制作用。
3 结论
本研究通过单因素试验得到多肽的超声预处理工艺条件,通过柱层析法从鱼鳞多肽中分离制备出具有金属铜离子螯合能力的多肽组分。通过酶活性测定以及分子对接验证该组分对酪氨酸酶活性的抑制作用,结果表明,当纯化后的多肽溶液浓度为5 mg/mL时,对酪氨酸酶活性的抑制率达到60.0%,与相同浓度的阳性对照组熊果苷溶液相比,具有离子螯合能力的多肽组分对酪氨酸酶活性的抑制作用更强。可知具有金属铜离子螯合能力的鱼鳞多肽组分是一种安全有效的酪氨酸酶抑制剂,有望在食品工业中合理使用。
