ROMA指数与卵巢交界性肿瘤恶变能力的关系
2022-11-16邹欣欣马震吴卫丰陈玉梅吴月玲符爱珍
邹欣欣,马震,吴卫丰,陈玉梅,吴月玲,符爱珍
广东医科大学附属医院,广东 湛江 524023
0 引言
卵巢癌是女性第八大常见癌症。据统计[1],2018年全球有290,000例新发卵巢癌病例和184,000例卵巢癌相关死亡病例,早期卵巢癌通常没有特异性症状,约20%的患者在早期得到诊断[2]。在5年生存期中,I期患者约90%,而IV期患者通过适当治疗仅为20%[3-5],因此,必须及早发现以提高治愈率和降低死亡率。交界性卵巢肿瘤(borderline ovaria tumor,BOT)是区别于侵袭性卵巢癌(invasive ovarian cancer,IOC),即常说的卵巢癌的低恶性潜能卵巢肿瘤,缺少明显的肿瘤细胞向间质浸润性生长的恶性肿瘤特征,且不易转移,因此预后较卵巢癌好[6]。由于检测手段不够灵敏、检查方法有限导致无法准确诊断,最终让这部分高恶性潜能细胞有机会发展成为IOC。CA125水平和经阴道超声检查是诊断卵巢癌的最佳和最常推荐的方法[5,7]。然而,CA125水平受各种生理因素(如怀孕和月经周期的不同阶段)和良性状况(包括子宫内膜异位症)的强烈影响[8]。Moore等根据相关统计分析在2009年提出了卵巢恶性肿瘤风险预测指数(risk of ovarian malignancy algorithm,ROMA),这是一种评分模型,该模型于2012年获批用于临床评估盆腔包块的良恶性[9-10],提示绝经前妇女ROMA≥11.4%为卵巢癌高风险,绝经后妇女ROMA≥29.9%为卵巢癌高风险。因此,本研究主要探讨ROMA指数区分BOT患者肿瘤细胞的良恶性程度的能力,现报道如下。
1 资料与方法
1.1 一般资料
选择2018年10月-2021年11月广东医科大学附属医院妇科手术并经病理诊断确诊的卵巢交界性肿瘤患者23例(卵巢交界性肿瘤组),均为初治患者。所有研究对象均对本研究知情同意,并自愿签署知情同意书。本研究已通过医院伦理委员会审核批准。术前完善血常规、肝肾功能、胸片、B超等各项检查,未见其他疾病;年龄17~66岁,平均(30.00±15.21)岁。另选取同期手术后病理确诊的卵巢癌患者33例(卵巢癌组),术前完善血常规、肝肾功能、胸片、B超等各项检查,未见其他疾病;年龄31~78岁,平均(53±2.86)岁。患者一般资料情况见表1。
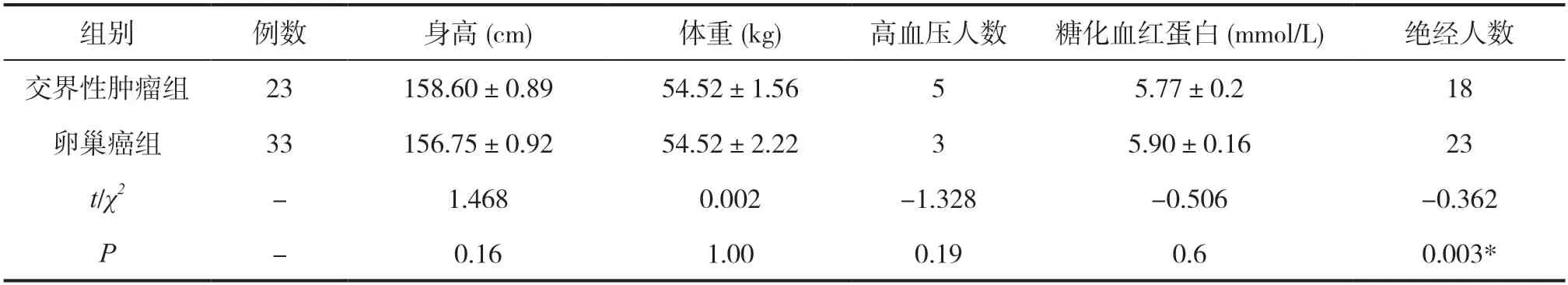
表1 两组一般资料比较
1.2 方法
采集术前空腹静脉血,离心后-80℃保存,使用酶联免疫吸附法和微粒子化学发光法检测血清HE4、CA125水平。根据月经状态计算ROMA指数,计算公式如下。预测指数(PI)根据下述公式计算。
绝经前:PI=-12.0+2.38*LN(HE 4)+0.0626*LN(CA125)
绝经后:PI=-8.0 9+1.04*LN(HE 4)+0.732*LN(CA125)
将计算出的PI值带入公式后:ROMA(%)=(PI)/[1+exp(PI)]。
1.3 统计学方法
采用SPSS 24.0统计软件进行分析。分类资料采用χ2检验,以P<0.05为差异有统计学意义。非参数检验采用斯皮尔曼分析,定量资料采用方差分析。通过ROC曲线及AUC评价诊断效能。
2 结果
2.1 两组HE4、CA125水平比较
交界性肿瘤组CA125平均值69Umol/mL,低于卵巢癌组(352Umol/mL)(P<0.05),具有统计学意义;交界性肿瘤组HE4平均值146pmol/L,低于卵巢癌组(357pmol/L);交界性肿瘤组ROMA指数低于卵巢癌组(P<0.05);根据上述计算公式绝经前、后临界值,高于临界值者归入高风险,低于临界值则归至低风险。23例交界性肿瘤中ROMA高风险者8例(34.7%),33例卵巢癌患者中ROMA高风险者11例(33.3%),两者具有统计学差异(P<0.05),见表2。
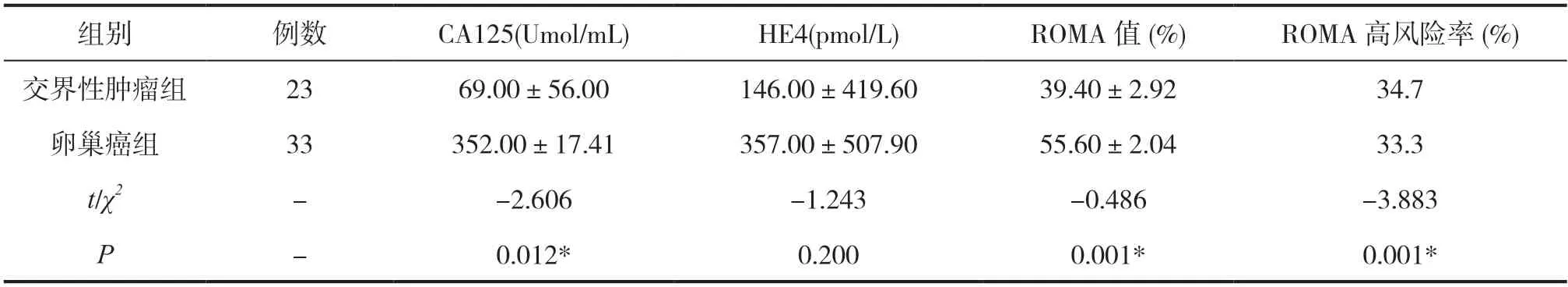
表2 两组CA125 及HE4 水平比较
2.2 绝经前与绝经后ROMA的水平
交界性肿瘤组绝经前ROMA 水平(13.3±4.4)%明显低于绝经后(35.6±11.1)%,差异具有统计学意义(P<0.05)。交界性肿瘤中绝经前ROMA高风险者6例,绝经后ROMA高风险者2人,两者具有统计学差异(P<0.05),见表3。
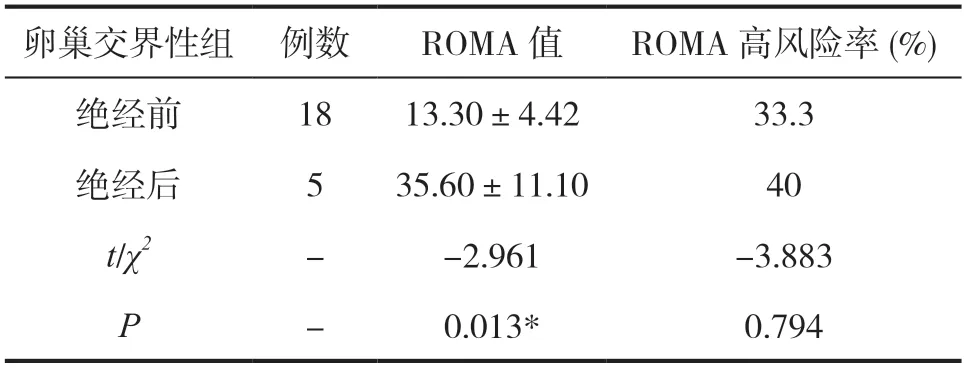
表3 交界性肿瘤组绝经前后ROMA 水平高风险及检出率
卵巢癌组绝经前ROMA水平(46.8±9.47)%与绝经后(48.8±8.8)%比较,差异无统计学意义(P>0.05)。卵巢癌患者组中绝经前ROMA高风险者11例,绝经后ROMA高风险者9例,差异有统计学意义(P<0.05),见表4。

表4 卵巢癌组绝经前后ROMA 水平及其高风险检出率
2.3 ROMA值对交界性及卵巢癌的诊断效能
绘制ROC曲线判断ROMA值对交界性及卵巢癌的诊断效能。交界性肿瘤组ROMA的ROC曲线为图1,卵巢癌ROMA的ROC曲线为图2。交界性肿瘤组ROMA的AUC为22.8%,卵巢癌ROMA的AUC为曲线为77.2%,结果显示ROMA值对卵巢癌的检出率更高。
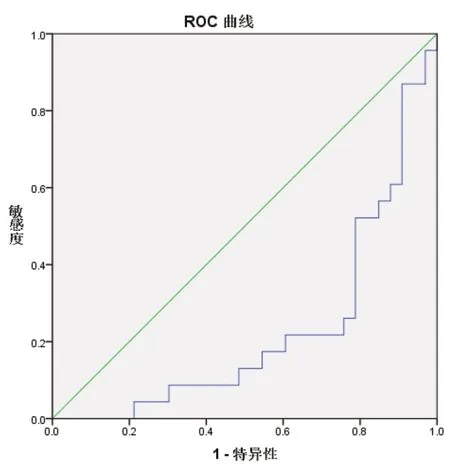
图1 交界性肿瘤组图

图2 卵巢癌组
3 讨论
BOT在育龄妇女中发病率较高,大约占上皮性卵巢恶性肿瘤的15%,对希望保留生育功能的年轻患者,可采取保留生育功能的保守性手术[11]。有20%~30%BOT患者因为没有诊断出恶变或高恶性潜能细胞,而错过了最佳的治疗时间最终发展成为IOC。对于BOT的早期干预非常必要,有利于准确判断BOT的恶性程度,这对后续治疗手段的合理选择有重要指导意义。1981年发现的CA125[13]于1983年被列为EOC的诊断标志物[12-13],血清CA125水平在卵巢癌患者中可能会升高,但该标志物在卵巢癌的早期阶段敏感性较低,在其他生理或病理状况中也报告了CA125水平升高,例如月经、怀孕、子宫内膜异位症和腹膜炎性疾病[14]。为了提高卵巢癌的特异性,人类附睾蛋白4(HE4)[15]进入了人们的视线,据报道该生物标志物在卵巢癌中过度表达[16]。虽然这些标志物的特异性相当可靠,但它们不是很敏感。出于这个原因,开发了RMI(恶性肿瘤风险指数)和ROMA(卵巢恶性肿瘤风险算法)等算法,以尝试改善这些生物标志物的固有特征。研究表明,ROMA指数可提高绝卵巢癌的诊断率[17-20],为探讨ROMA指数在卵巢交界性及卵巢癌的区分价值,特做此研究。
本研究中卵巢交界性肿瘤患者23例,年龄17~66岁。卵巢癌患者33例(卵巢癌组),年龄31~78岁。符合交界性肿瘤常发生于育龄期女性的特点。通过比较交界性肿瘤及卵巢癌组的CA125及HE4水平,交界性肿瘤组CA125低于卵巢癌组(P<0.05),可见CA125作为卵巢癌分子标志物的可靠性。交界性肿瘤组HE4平均值(146pmol/L),低于卵巢癌组(357pmol/L),但两者统计学未见明显意义,考虑为样本量太少所致偏差。前人研究指出CA125及HE4对卵巢癌诊断的局限性,引入ROMA作为评估的卵巢肿瘤恶性程度的新指标。考虑到年龄状态及绝经状态对ROMA水平的影响较大,根据绝经前后进行了进一步分析,卵巢癌组绝经前ROMA水平(46.8±9.47)%与绝经后(48.8±8.8)%比较,差异无统计学意义(P>0.05);有趣的是,交界性肿瘤组绝经前ROMA水平(13.3±4.4)%明显低于绝经后(35.6±11.1)%(P<0.05),即在绝经前,交界性肿瘤的ROMA水平无明显参考意义,绝经后其诊断效力更高,提示BOT随时间发展,其恶性程度会有所增加,ROMA值可作为其区分交界性肿瘤潜在恶性行为的一个指标。交界性肿瘤组中绝经前ROMA高风险检出率(33.3%),高于绝经后检出率(40%),虽然无明显统计学差异,但是有一定的上升,与前述ROMA变化趋势一致,但是不如卵巢癌组差异明显。交界性肿瘤组ROMA的AUC为22.8%,卵巢癌ROMA的AUC为曲线为77.2%,ROMA对卵巢恶性癌症的诊断更敏感,侧面反映卵巢恶性程度越重,其被ROMA所鉴别的能力越高。合理推测,卵巢交界性肿瘤在恶性的进展上,会伴有ROMA指数的提升,这与前人的研究结果一致[21]。
综上所述,在交界性卵巢肿瘤中,随着时间的增长,肿瘤的恶变可能会反应在ROMA值上,ROMA在早期区分卵巢交界性及恶性肿瘤方面,能实现优劣互补,对于BOT的早期排除诊断非常必要,有利于进一步综合判断BOT的恶性程度,这对后续治疗手段的合理选择有重要指导意义,并最终让BOT且有生育要求的妇女避免卵巢子宫切除,最大程度保留育龄妇女生育能力、提高生活质量。
