肝纤维化病因与机制研究进展
2022-11-15何迪陈鹏刘锋徐杨韩磊丁文静
何迪,陈鹏,刘锋,徐杨,韩磊,丁文静
(1)昆明医科大学第二附属医院肝胆胰外科,云南 昆明 650101;2)保山中医药高等专科学校临床医学院,云南 保山 678000)
肝脏是人体较为重要的脏器之一,其功能主要包括机体的代谢、分泌、合成、生物转换和排泄胆汁等等,较为复杂的功能致使各种外源性和内在的因素可以引起肝脏功能异常,甚至发生病变。正常情况下,肝脏可以调节肝脏细胞的外基质平衡,而遗传性疾病、酗酒、酒精性疾病、慢性病毒性肝炎、寄生虫感染和一些不明原因引起的慢性肝损伤会引起正常肝细胞死亡,继而会引起肝组织调节功能失调;当多种细胞出现外基质沉淀过多就会发展成肝脏纤维化,肝纤维化在没有及时干预的情况下将进展为不可逆的肝硬化,甚至转变成肝癌[1]。
一切慢性肝病的发生、转变都有肝纤维化反应的参与,过度的肝纤维化反应会改变免疫系统、组织修复相关途径与细胞外间隙的细胞间通讯。所有引起肝组织慢性损伤的因素,都可以激活多种细胞与通路引起肝组织的修复反应,这种修复反应将引起细胞外基质(extracellular matrix,ECM)等纤维化成分沉积在Disse 间隙,来包裹并隔离修复组织的受损部分[2]。正常情况下,组成肝脏Disse 间隙中ECM 的重要物质包括可以合成硫酸乙酰肝素和IV 型胶原(非纤维化)的蛋白多糖、糖蛋白的纤维连接蛋白和层粘连蛋白[2]。静止状态的肝星状细胞在肝Disse 间隙中起到调节外基质平衡的作用,当损伤修复反应发生时,多种细胞因子和趋化因子作用于静止的肝星状细胞而被激活,从而产出大量ECM;此时非纤维化的IV 型胶原逐渐被纤维化I 型和Ⅲ型胶原纤维代替,透明质酸和α-平滑肌肌动蛋白也发生沉淀现象,随着异常物质蓄积在肝组织中,肝脏的硬度增加,弹性减弱,继而发生肝组织纤维化[2]。进而血管的收缩舒张受限,将导致门脉高压的发生。导致肝组织损伤的因素如果没有根除,肝纤维化就会加剧变化。大量实验表明在前期去除损伤因素的情况下小鼠肝纤维化的进程停止,且表现出纤维化减退,表明肝纤维化是可逆的;因此在肝纤维化进一步发展成为不可逆的病变之前及时干预是非常有必要且意义重大的。在探究肝纤维化的治疗中,了解肝纤维化的病因和机制则尤为重要。
1 导致肝脏纤维化的病因
肝组织纤维化实则是肝内的慢性损伤修复反应,因此可以导致肝组织损伤的因素都会引起肝纤维化反应,而引起肝组织损伤的常见因素在临床中主要有遗传性疾病、酗酒、酒精性疾病、慢性病毒性肝炎、寄生虫感染和其他不明原因的肝损伤。
1.1 遗传相关因素导致肝脏容易发生肝纤维化
如表1 所示,遗传性基因变异导致肝组织损伤,随后会产生肝纤维化甚至肝硬化、肝癌,是引起儿童肝组织纤维化或者硬化的首要原因,但不包括儿童肥胖因素[3]。随着当代分子遗传学与医学科技的发展,遗传性肝纤维化的病因被一一解释。但是针对以上疾病的有效治疗方案还没有完善。以上基因突变中,在任何时期都可能发生的非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)其主要易感因素是在肝细胞、脂肪细胞以及肝星状细胞中大量表达并且编码Patatin 样磷脂酶结构域蛋白3 或脂联素的PNPLA3 基因的突变[4]。肝星状细胞(hepatic stellate cells,HSC)储存大量的维甲酸,可以激活视黄酸受体介导的转录,然后控制纤维化反应的产生。PNPLA3 基因已被证明具有视黄酸酯酶活性和三酰甘油脂肪酶活性,突变后会改变视黄酯酶活性,降低HSC 中维甲酸的含量,从而影响HSC 对肝纤维化的控制[5-7]。另外,PNPLA3 在肝细胞中的作用仍然具有争议,因为其作用是双面的。遗传性基因突变的影响机制较为复杂,对儿童生活与生命影响很大,需要进一步加深研究。
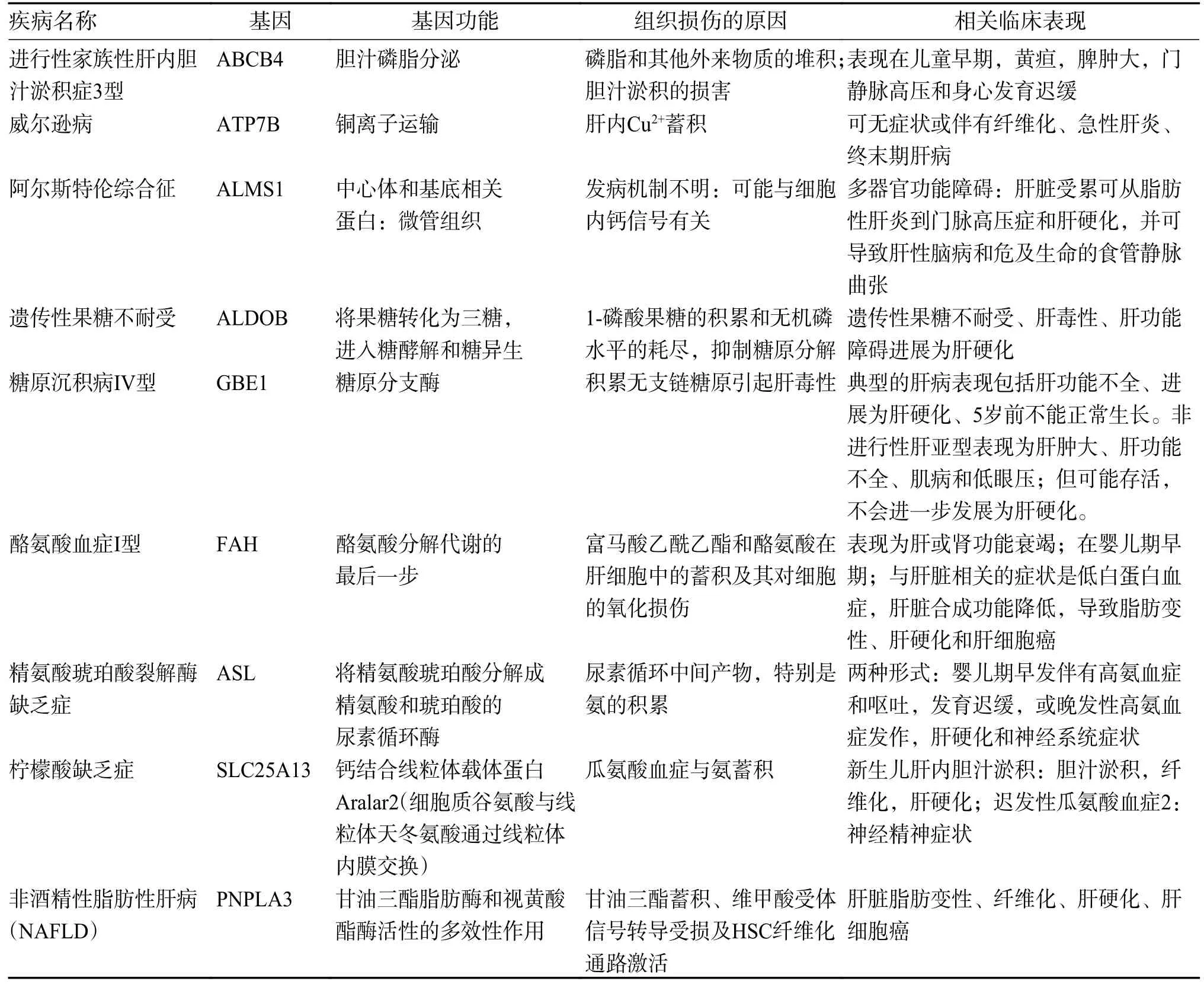
表1 遗传相关因素导致肝纤维化Tab.1 Liver fibrosis due to genetically related factors
1.2 酒精和药物性肝损伤
肝脏是乙醇和药物最主要的代谢场所,药物性肝病相对不常见,主要发生在一些药物的副作用或者某些中草药治疗中,一旦出现,如果不及时干预,将引起其他比较严重的临床症状,甚至有生命危险。长时间大量摄入乙醇的人,肝脏的正常代谢将被打乱,引起一系列肝脏疾病,其中最常见的是脂肪肝、肝纤维化、肝硬化。肝脏中有3 种酶参与代谢乙醇为乙醛,分别是醇脱氢酶(alcohol dehydrogenase,ADH)、醇诱导型肝细胞色素P450 CYP2E1(又称微粒体乙醇氧化系统,MEOS)和过氧化物酶体过氧化氢酶。在乙醇代谢中会产生大量的NADH,NADH 会抑制糖异生过程中的乳酸转化为丙酮酸的步骤,导致乳酸蓄积性酸中毒(酒精性酮症酸中毒)和糖异生被抑制产生的低血糖症状[3]。乙醛是可以参与修饰肝组织中很多蛋白质和酶的,长时间大量摄入乙醇将导致乙醇的代谢过程中乙醛在肝组织蓄积,下一步引起肝细胞的功能问题,引起肝细胞受损死亡[3]。长期的肝细胞受损死亡将导致肝纤维化,肝硬化的发生。可以看出,控制乙醇的摄入是非常有必要的,特别是肥胖、病毒性肝炎等有基础肝病的患者。
1.3 胆汁淤积
胆汁淤积的原因大致可以分为3类,先天性的胆道闭锁、肝细胞胆汁分泌异常和胆道阻塞(寄生虫、肿瘤或者结石)。这其中由原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)和原发性胆管炎(primary cholangitis,PBC)引起的慢性胆汁淤积最为常见。胆汁酸在慢性胆汁淤积后导致肝细胞损伤,进而发生炎症反应,下一步可以激活HSC,长时间的淤积将导致肝脏纤维化发生[8]。同时引起PSC 和PBC 的病因也被认为与炎症反应和自身免疫因素相关,可以看出炎症反应在胆汁淤积致肝纤维化中起重要作用[9]。至今,对胆汁淤积导致肝纤维化的机制仍存在争议,还需要进一步研究。
1.4 病毒性肝炎
由甲型、乙型等病毒引起的慢性肝炎导致的早期肝损伤、肝纤维化已被证实通过抗病毒或者免疫相关治疗是可以被治疗甚至逆转的。病毒性肝炎在我国的总体感染率依然较高,但是随着我国对婴幼儿乙型肝炎病毒疫苗接种的重视,在非成人中的病毒性肝炎感染率显著降低。肝纤维化是病毒性肝炎发展成为肝硬化和肝癌的初期中心阶段,因此,病毒性肝炎的诊疗重点是消灭病毒阻止其发展成为肝硬化或肝癌。
病毒性肝炎引起肝纤维化的机制主要是病毒性肝炎引起的肝细胞损伤、死亡和凋亡引起的炎症反应。早期炎症反应起到保护作用,长时间的炎症刺激将巨噬细胞、树突状细胞等免疫细胞过度激活,作用于肝组织的星状细胞,并分泌促炎因子TGF-β、内皮生长因子和血小板衍生生长因子等继续促使炎症反应发生,另外也会作用于肝星状细胞使其过度激活成为肌成纤维细胞并且分泌大量的平滑肌肌动蛋白、Ⅰ型和Ⅲ型胶原纤维等非可溶性细胞外基质,最终将引起肝纤维化,由此进展为肝硬化肝癌[10-12]。因此,对病毒性肝炎应该遵循早发现早治疗的原则,来最大限度地减少病毒性肝炎引起肝硬化或肝癌的发生。
2 肝纤维化机制
2.1 肝星状细胞
肝细胞与肝窦内皮细胞之间的空隙称为肝窦间隙。在正常情况下,静止的肝星状细胞(hepatic stellate cells,HSC)呈现星型形态位于Disse 空间,且细胞内富含脂滴与维生素A 的初级储存形式及视黄酯[13]。在正常肝组织Disse 间隙内存在各种细胞因子与免疫细胞,而免疫细胞又分泌细胞因子与趋化因子,可以通过媒介管理细胞之间的关系,这样就能改变细胞的基因表达,连带着增值、激活和衰亡都能控制,并有助于产生促炎反应或肝脏保护反应[14]。当病毒性肝炎、酒精中毒、药物等肝病对肝组织造成慢性损伤、肝细胞死亡和肝组织修复反应时,静态HSC 激活细胞因子分泌在周围肝巨噬细胞,肝窦内皮细胞,肝细胞,血小板,免疫细胞。纤维生长因子主要是生产和发布的血小板,如血小板源生长因子、转化生长因子β1、表皮生长因子等。可导致HSC 活化[15-16]。
HSC 是肌成纤维细胞的重要转变来源,而促使纤维化之后就能通过肝祖细胞和门脉成纤维细胞来转换成肌成纤维细胞,促进胶原分泌[17]。肌成纤维细胞的主要功能是分泌细胞外基质,如平滑肌肌动蛋白、I 型和III 型胶原纤维、纤连蛋白、凝血酶敏感性蛋白-1 和蛋白多糖。另外赖氨酰氧化酶(lysyl oxidase,LOX)、赖氨酰氧化酶样蛋白(lysyl oxidase-like protein,LOXL)和转谷氨酰胺酶由肝星状细胞产生并介导细胞外间隙胶原的交联[18-20]。在正常的生理环境下基质金属蛋白酶(matrix metalloproteinase,MMPs)降解ECM 来保持肝窦间隙中的物质平衡,可是HSC 产生出来的金属蛋白酶会改变其活性的生成,作为一种抑制剂存在[21]。当损伤刺激因素持续存在,肝星状细胞继续被激活并向肌成纤维细胞转变,继而肝窦间隙中物质交换平衡被打破,ECM 大量沉积,导致肝窦间隙的血流不畅、不可溶性纤维持续增加,肝脏的结构发生改变,肝脏的弹性降低,血管收缩门脉产生高压,导致肝纤维化继续加重,最终恶变。因此抑制未激活肝星状细胞活化、已活化或变异的肝星状细胞凋亡可以成为一个新的治疗方向和研究创新点。
2.2 肝巨噬细胞
肝巨噬细胞主要由Kupffer 细胞(KCs)和单核细胞来源的巨噬细胞组成,是高度异质性的血管实质细胞(占肝细胞的10%~15%),占巨噬细胞总数的90%。这些巨噬细胞在系统内稳态、感染、肝损伤炎症反应的启动、纤维化的进展、促进创面愈合和肝纤维化的消退中起着关键作用[22]。通过肝星形细胞来相互传输信息是肝巨噬细胞的能力,它可以将炎症和纤维化具现化[22]。
在早期肝损伤阶段和肝损伤恢复阶段,肝巨噬细胞多起到保护性作用,这种保护作用是通过分泌一些保护性炎症因子,例如IL-6、IL-10等,IL-6 通过Stat3 信号通路上调细胞转导抑制因子3(SOCS3)的表达,使SOCS3 与gp130 基因结合促进其转录,促进肝细胞存活和肝再生以及改善脂肪变性[23]。肝巨噬细胞主要分泌转化生长因子β(TGF -β),Interleukin-1β(IL-1β)、肿瘤坏死因子α(TNF -α)、活性氧(ROS)和脂质过氧化作用刺激肝星状细胞的激活和增殖[15-16]。KCs 还释放炎症因子(如IL-6)促进炎症反应;缓解包含CXC 亚科的趋化因子,如CXCL1、CXCL2、CXCL8和CXCL16。CXCL1、CXCL2 和CXCL8 通过与趋化因子受体CXCR1 和CXCR2 结合,释放细胞毒素和ROS,诱导肝细胞损伤,产生和发展肝纤维化[24]。
2.3 树突状细胞
树突状细胞(dendritic cells,DCs)是存在于人体内的一种特异的抗原提呈细胞,在人体内监视并将发现的抗原交给T 细胞后也会促进T 细胞的免疫应答,DCs 对人体的免疫系统有着重要作用[25]。DCs 由于表面标记物的不同在不同的组织中可以完全不同,存在于肝脏中的DCs 主要分布在肝组织的汇管区,来监控血源性的抗原[26]。其在肝移植免疫耐受中也是起到关键作用。在CCl4制造的肝纤维化小鼠模型中,停止CCl4的损伤后,使小鼠肝脏DCs 耗竭后观察小鼠肝纤维化的消退减慢,当增加DCs 的生长因子Flt3L后,肝纤维化消退加速,说明在早期肝损伤去除阶段DCs 有助于肝纤维化的消退[27]。另外研究者还发现DCs在肝纤维化的发生中还会分泌IL-6 和TNF-α 来促进炎症反应,并促进肝星状细胞的激活导致ECM 沉积加速,最终促进纤维化的发生[28]。可以看出DCs 在不同的时期存在不同的作用,因此关于DCs 的研究需要进一步探究。
2.4 内质网应激反应
在细胞中管理分泌和膜蛋白的合成、翻译修饰、合成、药物代谢等等都是内质网的工作内容[29]。内质网稳态被扰乱后,立即启动未展开蛋白反应(unfolded protein reaction,UPR)的保护机制,称为内质网应激(endoplasmic reticulum stress,ERs)[30]。UPR 由肌醇依赖酶1α、PKR 样ER 激酶和激活转录因子6α 三条信号通路组成[30]。在稳态条件下,每个UPR 传感器的腔的一侧与ER是合作伙伴,主要是免疫球蛋白结合蛋白/葡萄糖调节蛋白78。合成蛋白质过程中内质网发生错误折叠或者未折叠的蛋白增多时,传感器通过以上三条通路激活UPR 产生ERs 来恢复内质网的稳态,不能改变细胞衰亡的现象,也不能减少ERs和激活不了的UPR[31]。ERs 诱导细胞的凋亡机制有CHOP 途径、IRE1/ASK1/JNK 途径和Caspase-12 途径,其中最主要的是CHOP 途径[32]。CHOP在转录水平上激活了许多促凋亡基因,包括死亡受体5(DR5)、Bcl-2 样蛋白11(BIM)、Gadd34和Tribble 同源物3(TRB3),且抑制抗凋亡B 细胞淋巴瘤2(BCL2)的表达,这样就能在内质网应激反应中增加细胞衰亡的程度[33]。
肝脏参与合成白蛋白、α-1 抗胰蛋白酶和脂蛋白等多种蛋白质,由各种原因引起的急慢性肝损伤引起的肝纤维化中涉及肝细胞和肝星状细胞的功能变化,可以推断大量的ERs 参与其中[32]。ERs 在肝细胞和肝星状细胞中有着不同的作用,这增加了通过UPR 理解ERs 及其下游信号在肝病中的复杂性。在一项实验中,使用四氯化碳灌胃一次的野生型小鼠肝细胞中早期出现ERs,然后出现了肝损伤与肝细胞凋亡,小白鼠经过多次灌输也开始肝纤维化[34]。在最近一项实验中证实,塞来昔布可以抑制由硫代乙酰胺诱导的肝硬化大鼠内质网应激来减轻肝细胞凋亡[35]。能发现ERs是改变肝细胞衰亡的一种根据,同时也是肝纤维的产生的开始。
有一项实验通过对轻度和重度肝纤维化患者的组织检测发现,重度肝纤维化组织中ERs 明显增加[36]。在小鼠模型中,肝纤维化小鼠肝组织中分离出的肝星状细胞内ERs 水平明显高于正常组[36]。肝星状细胞的激活伴随着ERs 的出现与轴索过度生长抑制因子-B 表达上调,当进行轴索过度生长抑制因子-B 敲降后检测到ERs 减少与肝星状细胞激活减少[37]。上述实验可以证明一个观点,那就是ERs 会改变肝星形细胞,将活化细胞改变成肝纤维化,逆转成功。
肝纤维化会通过ERs 的转变,促进细胞色素c 释放到胞浆中,这时再激活Caspase 级联反应,就会引起肝星状细胞的凋亡[38-39]。有实验证明ERs 介导的 Kupffer 细胞源性TNF-α 经TNFR/caspase-8 途径也会诱导肝星状细胞凋亡[40]。在另外一项药物实验中,异甘草酸镁可促进肝星状细胞的凋亡,当加入ERs 特异性抑制剂后,这种促凋亡现象被抑制,证实ERs 在肝星状细胞的凋亡中是一个重要角色[41]。ERs 在肝纤维化的早期会促进发展,而后期大量的ERs 会促进肝星状细胞的凋亡。上述实验说明了一些关键问题,那就是ERs 诱导肝星状细胞的减少会让肝纤维化出现意想不到的转变。
2.5 自噬
自噬很好的理解就是细胞在进行一种降解的过程,这种时候,蛋白质会能凝聚成集合体,将受损的细胞或者细胞群进行运输到溶酶体里,来维持细胞的稳态[42]。自噬小体也可以称作双模小泡,它的形成可以看出自噬的一种开启模式,因为这些小体会和身体中溶酶体融合继而形成自溶酶体,这样更加容易降解[43]。参与自噬小体形成的Atg 蛋白由几个功能单位组成:Atg1 激酶及其调节剂、PI3K 复合物、Atg9、ATG2-ATG18 复合物和两种泛素样偶联物[44]。
自噬在大多数类型的肝细胞中被认为是一种细胞保护和抗纤维化机制,对肝细胞的代谢稳态非常重要[45]。自噬在肝纤维化的产生机制中比较复杂,在肝纤维化不同时期发生于不同细胞,产生不同的反应。肝纤维化的核心模式是需要靠激活肝星形细胞来决定的,实验也渐渐发现这一规律,说明自噬能调节脂滴,并且适当活化肝星状细胞的运作[46]。激活了肝星状细胞的时候,产生出和自噬有关的特征就会越加明显,如自噬空泡、自噬通量和LC3-II 水平都会影响到肝星形细胞的数量[46]。在体外细胞实验中用3-甲基腺嘌呤(3-MA)或针对Atg5 的特异性siRNAs 阻断培养细胞的自噬,可以导致肝星状细胞活化和纤维化的减弱[46]。有实验证明自噬缺陷型巨噬细胞通过分泌炎性细胞因子IL-1A 和IL-1B 增强肝肌成纤维细胞的纤维化特性,这个可以解释肝巨噬细胞有着自我吞噬能力,而这种能力会保护[47]。肝细胞的慢性持续性损伤是肝纤维化的早期进程,有实验证明自噬在肝细胞中具有保护作用,也具有抗纤维化作用[48-49]。
3 小结
所有慢性或者急性肝病都有着复杂的病理过程,其中都有肝纤维化反应的参与,进些年的研究中已证实早期的肝组织纤维化是可逆的。因此,在肝组织纤维化的早期及时干预,阻止其进一步恶化是非常有临床意义的。实验表明,不同细胞和细胞因子都会在不同发展状况时参与肝纤维化反应。肝纤维化是一个动态发展过程,除了与肝星状细胞、肝巨噬细胞、自噬、内质网应激和细胞相关因子等有关,还有一些更为复杂的因素,例如氧化应激反应、慢性炎症反应等。针对肝纤维化的治疗药物已被证实在小鼠或者体外细胞实验中有效,但是治疗效果依然需要继续研究。在临床上关于肝纤维化的治疗,最关键的措施依然是早期去除病因治疗(控制体重、戒酒、早期积极病毒性肝炎规律治疗等)。肝星状细胞与细胞通路中重要的细胞因子仍然是治疗肝纤维化的研究热点,临床工作中想要高效地治疗肝纤维化还需要进一步的探究。
