1株酪氨酸脱羧酶产生菌的构建及其诱导条件优化
2022-11-15罗秀针郑金华林燕燕吴伟斌
罗秀针,郑金华,林燕燕,吴伟斌
(1.漳州卫生职业学院, 福建 漳州 363000;2.福建生物工程职业技术学院, 福建 福州 350007)
酪胺(Tyramine)又名对羟基苯乙胺(分子式:C8H11NO,分子量137.18),为白色或类白色的晶体粉末。酪胺具有多种的生理功能和药用价值,常应用于治疗偏头痛,制备降血脂药物、合成诊断嗜铬细胞瘤的药物等[1-4]。酪胺及其衍生物广泛应用于医药、保健及化妆品行业,市场需求量大[5-7],价格较高。
目前酪胺的制备主要通过化学合成法,但化学合成法具工艺复杂、反应中间体多、产物提纯难、总体回收率较低、成本高和环境污染严重等问题[8-11]。相对化学合成法来说,生物酶法利用酪氨酸脱羧酶(Tyrosine decarboxylase,TDC)[12]将酪氨酸催化脱羧生成酪胺,具有反应条件温和、周期短、成本较低、高效、绿色等[13]优势具有广阔的应用前景。
酪氨酸脱羧酶的来源丰富,研究表明微生物来源的酪氨酸脱羧酶酶活相对其他来源的脱羧酶要高[14-15]。目前已实现了多种不同来源的TDC异源表达,但普遍存在易形成包涵体、酶活低等问题[16]。为了有效解决包涵体问题,本研究将Lactobacillusbrevis来源的TDC(Gen Bank:JX204286.1)基因密码子进行低翻译效率优化,在E.coliBL21-AI(DE3)中的异源表达,并通过摇瓶对诱导条件进行优化,为今后的研究提供一些依据。
1 材料与方法
1.1 菌株和质粒
E.coliJM109、E.coliBL21-AI(DE3)、表达质粒pBAD/His为实验室保藏。
1.2 主要试剂和仪器
限制性内切酶(SacⅠ和KpnⅠ)、T4连接酶、DNA Marker、蛋白Marker、基因组提取试剂盒、PCR产物回收试剂盒、胶回收试剂盒,购自Takara生物技术有限公司;酪氨酸、磷酸吡哆醛(PLP)、氨苄青霉素(Amp)、L-阿拉伯糖,购自生工生物工程(上海)有限公司;5 L发酵罐,购自上海国强生化工程装备有限公司;凝胶成像系统,购自Bio-Rad公司。
1.3 培养基
(1)LB培养基:蛋白胨10 g·L-1,酵母浸粉5 g·L-1,氯化钠10 g·L-1,pH 7.0 g·L-1。(2)固体LB培养基:LB培养基中加入20 g·L-1的琼脂粉。(3)重组菌的发酵液体培养基:牛肉膏10 g·L-1,酵母膏5 g·L-1,葡萄糖2.5 g·L-1,蛋白胨10 g·L-1,磷酸氢二钾2 g·L-1,无水乙酸钠5 g·L-1,柠檬酸氢二铵2 g·L-1,硫酸镁0.58 g·L-1,硫酸锰0.25 g·L-1,吐温-80 1 mL,pH 6.8,基因工程菌在培养前加终浓度50 mg·L-1的氨苄青霉。
1.4 酪氨酸脱羧酶基因工程菌构建
1.4.1目的基因优化与合成 利用在线密码子优化网站,将NCBI上发布的短乳杆菌(Lactobacillusbrevis,EU195891.1,NCBI)中酪氨酸脱酸酶(TDC)基因序列进行密码子优化,在密码子优化过程添加稀有密码子,提高稀有密码子tRNA丰度,降低翻译效率[17]。在基因序列两端引入SacⅠ和KpnⅠ的切位点,优化后的基因序列由生工生物工程(上海)有限公司进行全基因合成,片段长度为1 893 bp,合成pUC-tdc质粒。
1.4.2表达载体的构建 将pUC-tdc/top10甘油菌扩大培养后,提取pUC-tdc质粒,用SacⅠ和KpnⅠ对质粒进行酶切,回收酶切产物,回收的酶切产物与SacⅠ、KpnⅠ双酶切的pBAD/His载体通过T4连接酶进行连接,构建重组质粒pBAD/His-TDC,挑取阳性克隆重组菌验证。
将验证成功的重组菌E.coliJM109-tdc接种到含终浓度50 μg·mL-1Amp的液体培养基中,37℃、180 r·min-1培养12 h后,提取质粒,将pBAD/His-TDC转入E.coliBL21-AI(DE3)感受态中细胞,构建重组表达TDC的基因工程菌E.coliBL21-AI(DE3)-tdc。
1.4.3目的产物的诱导表达 将-20℃保存的阳性克隆E.coliBL21-AI(DE3)-tdc甘油菌按照1%接种量接种于含终浓度50 μg·mL-1Amp的5 mL LB液体培养基中,37℃、220 r·min-1振荡培养12 h;12 h取出种子液,按照2%接种量接种于含终浓度50 μg·mL-1Amp的发酵液体培养基中(250 L的三角瓶中装液体量为50 mL),37℃、220 r·min-1振荡培养6 h,温度降低到30℃,加入诱导剂L-阿拉伯糖(终浓度为2 g·L-1),诱导12 h后离心收集菌体,SDS-PAGE电泳检测重组蛋白的表达情况。
1.5 酪氨酸脱羧酶酶活的检测
TDC酶活定义为[12]:在37℃条件下,1 min生成1 mmol·L-1酪胺所需生物催化剂的量。TDC的比活力:每克湿重菌体所具备的酶活力单位(U·g-1)。
TDC酶活测定[18]:底物溶液5 mmol·L-1酪氨酸0.9 mL,0.1 mmol·L-1PLP的乙酸缓冲液 (0.2 mmol·L-1,pH 5.0),加入处理好的菌体,在37℃下振荡反应 10 min,然后在100℃金属浴中放置10 min终止反应。用高效液相色谱(HPLC)检测反应液中生成的酪胺。
HPLC 检测酪胺条件[19]为色谱柱:Kromasil C18;流动相:0.02 mmol·L-1磷酸氢二钠-乙腈(体积比 85∶15);流速:1.0 mL·min-1;检测波长:225 nm。
1.6 表达条件优化
1.6.1确定最佳诱导温度 按1.4.3将种子液接入含Amp的发酵液体培养基,培养6 h,将培养温度分别设置为24、26、28、30、32和34℃,加入诱导剂L-阿拉伯糖(终浓度为2 g·L-1),诱导表达12 h,收集菌体,-20℃冷藏24 h后进行酶活测定。
1.6.2确定L-阿拉伯糖最佳诱导剂用量 取上述最优结果,在发酵培养基中分别添加终浓度为0.5、1.0、1.5、2.0、2.5 g·L-1的L-阿拉伯糖,诱导表达12 h,收集菌体,-20℃冷藏24 h后进行酶活测定。
1.6.3确定添加诱导剂时间 取上述最优结果,分别于培养4、6、8和10 h加入L-阿拉伯糖,诱导表达12 h,收集菌体,-20℃冷藏24 h后进行酶活测定。
1.6.4确定诱导剂作用时间 取上述最优结果,加入L-阿拉伯糖诱导表达,诱导表达时间为4、6、8、10、12 h,收集菌体,-20℃冷藏24 h后进行酶活测定。
1.7 5 L发酵罐放大验证
在摇瓶发酵条件优化的基础上,进行重组基因工程菌E.coliBL21-AI(DE3)-tdc 5L发酵罐的发酵试验,条件如下:5 L发酵罐发酵初体积为2.5 L,移种量为4%,起始通风比0.6 v·(vm)-1,起始转速为300 r·min-1,发酵液中初始葡萄糖为2.5 g·L-1,初始葡萄糖耗完后,浓度控制在1~2 g·L-1,发酵培养温度为37℃,发酵过程中控制溶氧在20%~40%范围,当菌体OD600约为6时,温度降低到28℃,加入L-阿拉伯糖(终浓度为1.6.2确定的最佳诱导剂用量)继续培养12 h,收集菌体,-20℃冷藏24 h后进行酶活测定。
2 结果与分析
2.1 重组菌的构建与鉴定
提取重组质粒 pBAD/His-TDC,用SacⅠ和KpnⅠ双酶切,琼脂糖凝胶电泳检测,见图1。pBAD/His-TDC 质粒双酶切后出现2条带,与pBAD/His和tdc基因长度相符,经测序与NCBI所公布的TDC基因序列相符。
2.2 SDS-PAGE检测重组蛋白的表达
重组工程菌E.coliBL21-AI(DE3)-tdc在L-阿拉伯糖诱导表达后,收集菌体经超声波破碎进行SDS-PAGE电泳检测,以未诱导表达的样品作为空白对照,结果见图2,在诱导表达后的E.coliBL21-AI(DE3)-tdc样品在相对分子质量63 kD处有明显的特异性条带。
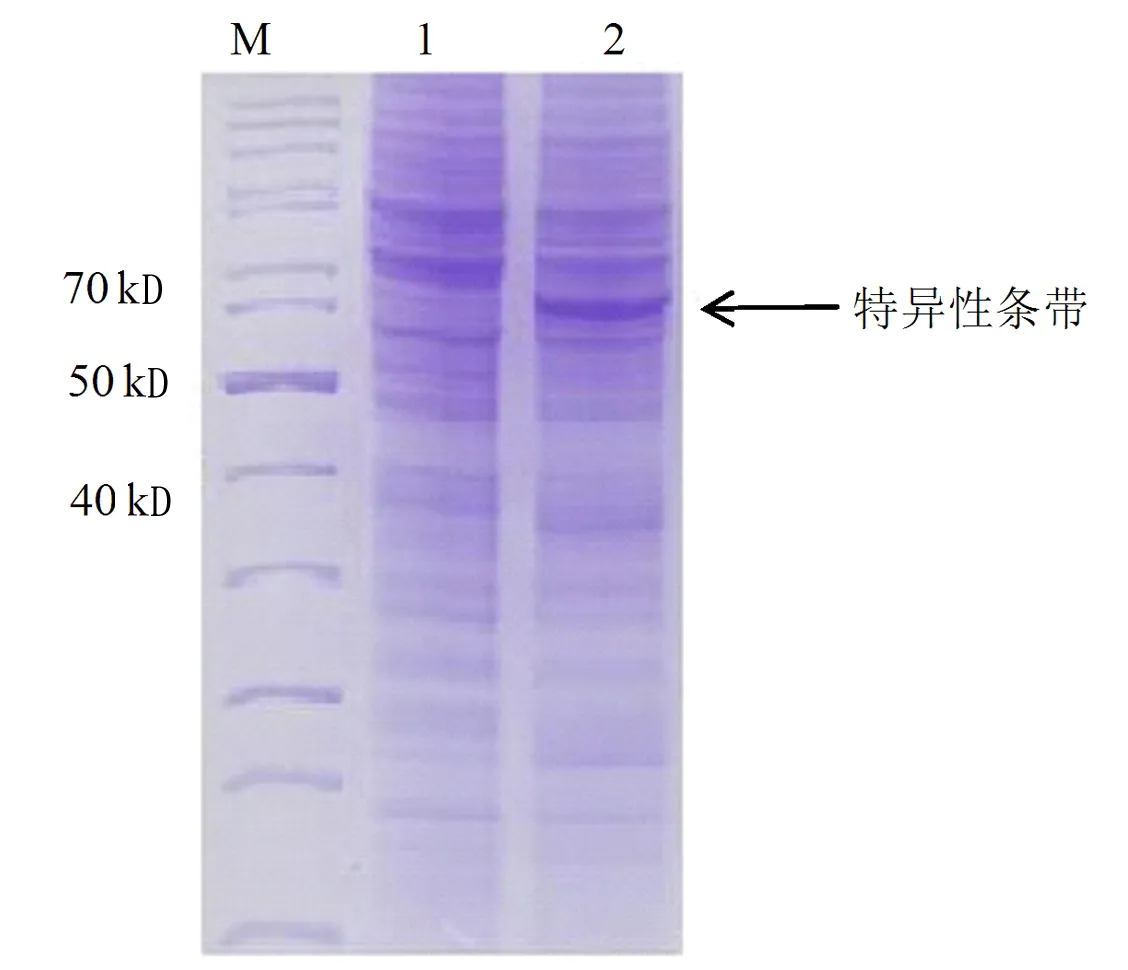
注:M为marker,1为原始菌,2为重组菌
2.3 酪胺的液相检测
酪胺含量检测采用高效液相色谱法,酪胺液相检测标准图谱见图3,反应液中生成的酪胺检测图谱见图4。
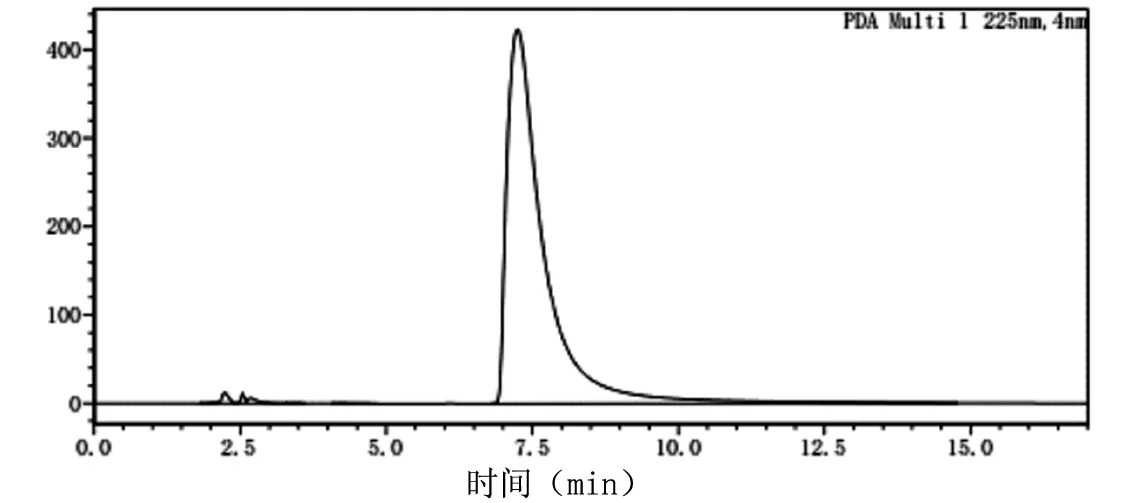
图3 酪胺液相检测标准图谱
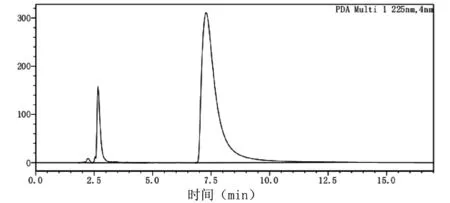
图4 反应液中生成酪胺的检测图谱
2.4 诱导条件优化
2.4.1确定最佳诱导温度 诱导温度对菌体生长速率及蛋白的可溶性表达都很重要,是重组蛋白表达调控的关键因素之一[20]。由图5可知,当诱导温度为26℃时,TDC活性最高;但当诱导温度继续升高,TDC活性开始下降,原因可能是较高的诱导温度导致目的蛋白合成速率过快,其不能正确折叠而形成“包涵体”。但如果诱导温度太低,对于菌体的生长也不利。因此,确定最佳诱导温度为26℃。
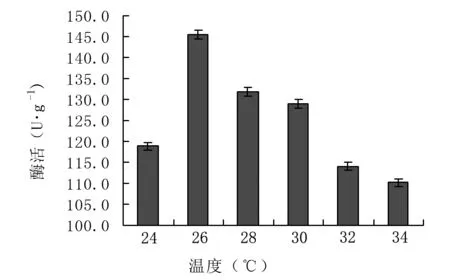
图5 温度对重组菌诱导表达的影响
2.4.2确定L-阿拉伯糖最佳诱导剂用量 由图6可知,当L-阿拉伯糖浓度从0.5 g·L-1增加至1.0 g·L-1时酶活上升,最高酶活达152.1 U·g-1,L-阿拉伯糖浓度继续增加,表达相对稳定,确定L-阿拉伯糖最佳诱导剂用量为1.0 g·L-1。
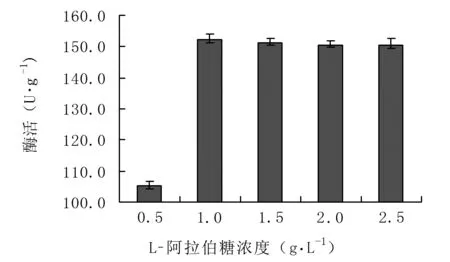
图6 L-阿拉伯糖浓度对重组菌诱导表达的影响
2.4.3确定诱导剂添加时间 由图7可知,4、6 h为对数中前期添加L-阿拉伯糖效果较好,6 h添加L-阿拉伯糖TDC活性最高,酶活可达166.6 U·g-1,8、10 h为接近稳定期,添加诱导剂,TDC表达量下降,确定诱导剂添加时间为6 h。
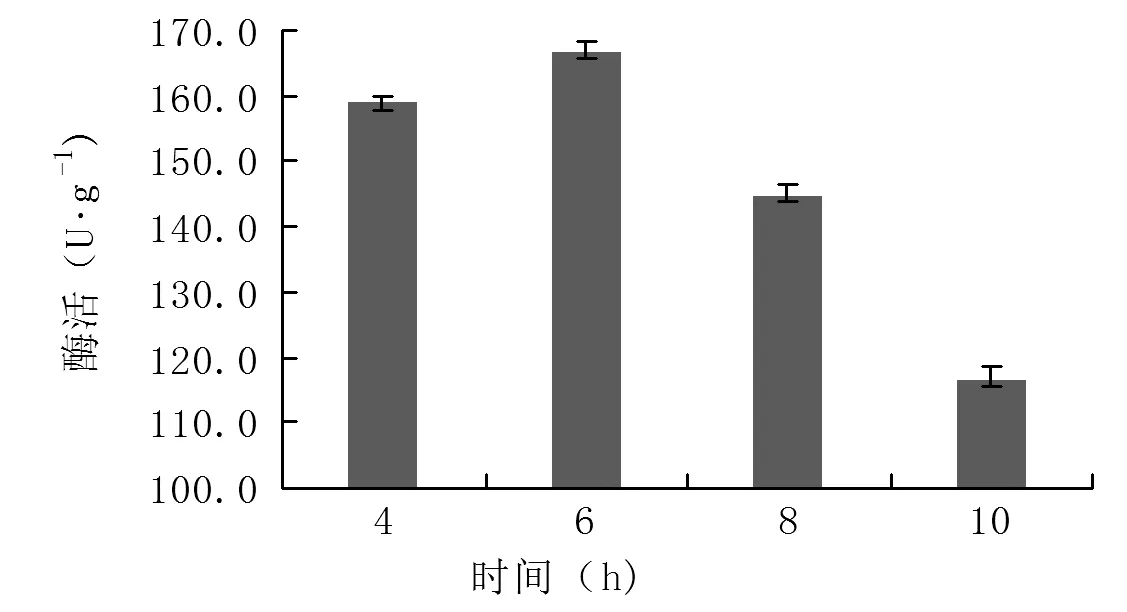
图7 诱导剂添加时间对重组菌诱导表达影响
2.4.4确定诱导时长 诱导时间也是影响基因工程菌产物表达的重要因素。诱导时间过短,菌体量过少。诱导时间过长,诱导剂被消耗殆尽,菌体进入衰亡期。本试验考察诱导时间对TDC活性影响,结果见图8,诱导8 h左右,TDC活性最高,达到183.2 U·g-1。
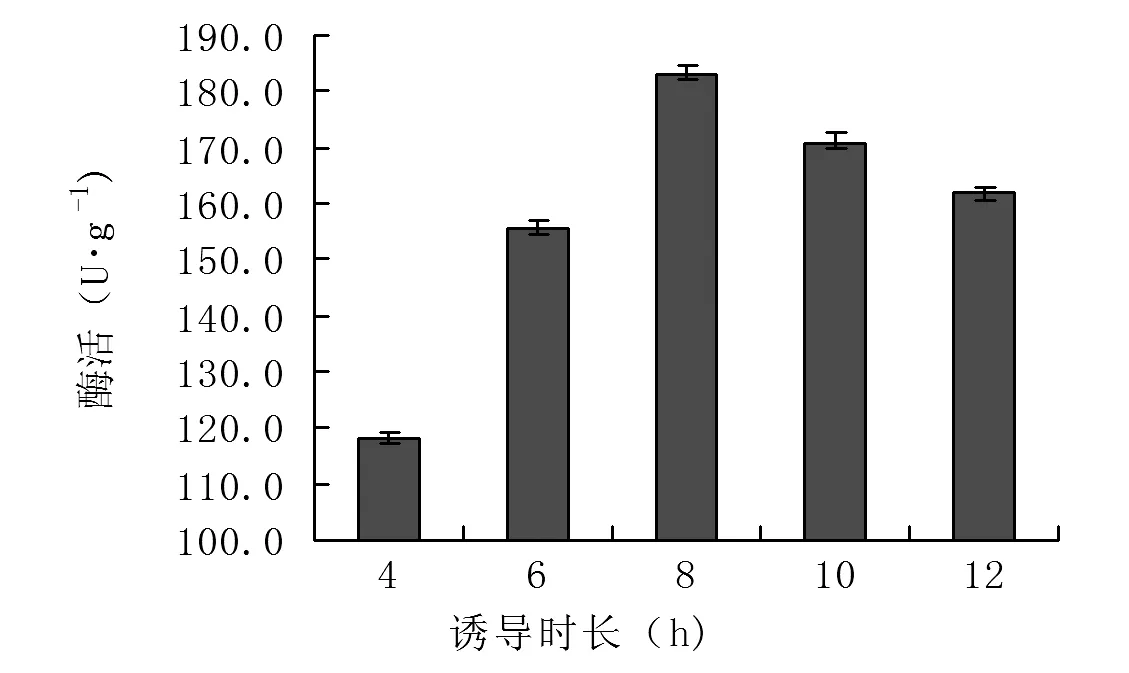
图8 诱导时长对重组菌诱导表达影响
2.5 发酵罐放大试验
由图9可知,5 L发酵罐的发酵培养,经过2 h左右的迟缓期后进入快速增长期,10~14 h为稳定期,之后进入衰亡期,在对数中前期即发酵6 h开始降温诱导,TDC开始表达,到培养到14 h时TDC的活性最高,可达192 U·g-1,而后进入衰亡期,18 h TDC的酶活有所下降。5 L发酵罐放大试验,发酵过程条件得到了更好的控制和调节,菌株在发酵罐中发酵长势和产量都应优于摇瓶。菌体浓度可达到18.2 g·L-1,相对于摇瓶发酵的pH 1.92 g·L-1增长了8.47倍。
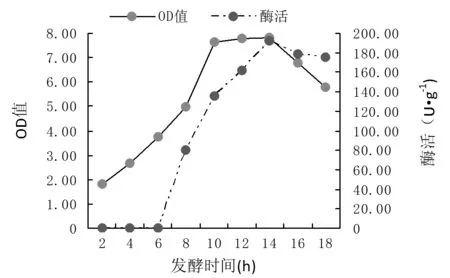
图9 重组菌发酵罐细胞生长曲线和TDC酶活
3 结论与讨论
本研究利用在线密码子优化网站,在短乳杆菌(Lactobacillusbrevis,EU195891.1,NCBI)中酪氨酸脱酸酶(TDC)基因序列添加稀有密码子,提高稀有密码子tRNA丰度,进行密码子优化,降低翻译效率,有效解决了异源表达TDC易形成包涵体的问题,实现了短乳杆菌来源的TDC基因在E.coliBL21-AI(DE3)中的异源表达,通过摇瓶发酵对诱导表达TDC的条件进行摸索,在较低温度26℃下,发酵6 h,加入1.0 g·L-1L-阿拉伯糖其TDC效率最高,诱导8 h,酶活可达183.2 U·g-1;在摇瓶发酵基础上,通过5 L发酵罐放大试验,发酵过程条件得到了更好的控制和调节,菌株在发酵罐中发酵长势和产量都应优于摇瓶。TDC酶活达到192 U·g-1,菌体浓度可达到18.2 g·L-1,相对于摇瓶发酵的1.92 g·L-1增长了8.47倍。与化学合成方法相比,本研究通过重组表达的酪氨酸脱羧酶制备酪胺,绿色环保,转化效率高,为酪胺的工业化生产奠定基础。
