黄连解毒汤对急性鼻窦炎模型大鼠鼻窦黏膜MAPK/NF-κB信号通路的影响
2022-11-11徐辉聪钟零珠梁卫勤王少军
徐辉聪,钟零珠,梁卫勤,王少军
(海口市第三人民医院,海南 海口 571100)
急性鼻窦炎(acute rhinosinusitis,ARS)是鼻旁窦和鼻腔的一种急性炎症,主要表现为少于12周的脓性鼻腔引流,且伴有鼻塞,嗅觉丧失,和/或面部疼痛/压力/充盈[1]。ARS是耳鼻喉科门诊最常见的疾病之一,也是使用抗生素的最常见原因之一。研究[2]表明,ARS的细菌感染发生率在0.5%~2%之间。临床上,ARS的鼻黏膜炎症反应包括液体渗出、黏液分泌过多、水肿和黏膜破裂。ARS的炎症级联包括与Ⅰ型炎症相关的细胞因子,如TNF-α、TNF-β、干扰素-γ、IL-1β、IL-6,它们与疾病的病理过程和结局有关[3]。最近的研究[4]显示,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/核因子-κB(nuclear factor-κB,NF-κB)信号通路参与了许多炎症性疾病的发病机制。有证据[5]表明,MAPK/NF-κB信号通路与慢性鼻窦炎TGF-β1诱导的鼻黏膜重塑的发病机制有关。然而,其在ARS中的作用仍不清楚。黄连解毒汤来源于《肘后备急方》,由黄连、黄柏、黄芩、栀子4种药材组成,具有清热解毒的功效。在临床上黄连解毒汤被广泛应用于败血症、炎症性疾病的治疗[6-7]。其抗炎作用可能与对多种蛋白靶点的作用有关[8-9]。但黄连解毒汤对ARS的治疗作用及其机制尚不清楚。本研究以大鼠为研究对象,探讨黄连解毒汤对ARS的影响及其对MAPK/NF-κB信号通路的调控作用,旨在为ARS临床治疗提供新思路。
1 材料与方法
1.1 实验动物7~8周龄SPF级成年雄性SD大鼠69只,体质量250~280 g,购于上海灵畅生物科技有限公司,动物生产许可证号:SCXK(沪)2018-0003。大鼠均在SPF级动物房饲养,自由摄食及饮水,12 h光照/12 h黑暗,室温24~26℃,相对湿度40%~70%。该研究经本院医学实验动物管理委员会批准(伦理批准号:2019-013)。
1.2 药物与试剂 克拉霉素分散片(批号:H19990375)购自扬子江药业集团有限公司;桉柠蒎肠溶软胶囊(批号:H20052401)购自北京九和药业有限公司;玉米胚芽油购自山东玉膳房食品有限公司;肺炎链球菌(批号:49619)购自上海硕欣生物科技有限公司;苏木精-伊红(HE)染色试剂盒(批号:ME9200-200T)购自上海迈基生物技术有限公司;TNF-α ELISA检测试剂盒(批号:JN4759)、IL-6 ELISA检测试剂盒(批号:JN3398)均购自上海纪宁生物公司;Trizol(批号:15596026)购自美国Invitrogen公司;cDNA反转录试剂盒(批号:PR036A)、SYBR Green I PCR试剂盒(批号:DRR420A)购自日本TaKaRa公司;TNF-α一抗(批号:ab215188)、IL-6一抗(批号:ab259341)、C-Jun N末端激酶(C-Jun N-terminal kinase,JNK)一抗(批号:ab225572)、p-JNK一抗(批号:ab219584)、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK1/2)一抗(批号:ab184699)、p-ERK1/2一抗(批号:ab201015)、p38一抗(批号:ab170099)、p-p38一抗(批号:ab195049)、NF-κB p65一抗(批号:ab32536)、p-NF-κB 65一抗(批号:ab76302)、GAPDH一抗(批号:ab9485)、与辣根过氧化物酶结合的二抗(批号:ab6728)均购自美国Abcam公司。
1.3 主要仪器NanoDrop 2000/2000C型NanoDrop(美国Thermo Fisher公司);Prism7500型ABI 7500 PCR仪(美国应用生物系统公司)。
1.4 造模与分组69只大鼠随机选取10只作为空白对照组,其余59只建立急性鼻-鼻窦炎模型。造模方法如下:将肺炎链球菌在血琼脂平板上培养,在注射大鼠之前将肺炎链球菌菌落悬浮在无菌的生理盐水中。根据WU T等[10]提供的方法建立大鼠急性鼻-鼻窦炎模型:腹腔注射10%水合氯醛溶液,标准注射剂量为3~4 mL/kg,膨胀海绵填塞大鼠双侧鼻腔,将小滴的细菌溶液经鼻腔给药,持续7 d。7 d后使用大鼠鼻窦炎症状评分对模型大鼠进行检测:鼻窦炎症状评分>7分则认为造模成功。共成功建模50只,造模成功率为84.75%(50/59)。
造模成功后,将50只模型大鼠按随机数字表法分为模型组、黄连解毒汤低剂量组、黄连解毒汤中剂量组、黄连解毒汤高剂量组和阳性对照组,每组10只。
1.5 实验给药 根据刘书芹等[11]的方法制备黄连解毒汤:取黄连、黄芩、黄柏、栀子各10 g,加入10倍量的水煮沸1.5 h后过滤;药渣加10倍量的水煮沸1 h后过滤;合并两次过滤后的药液,继续煮沸并蒸干浓缩至300 mL。黄连解毒汤低、中、高剂量组分别以生药量5、10、20 g/kg鼻腔灌洗[11];克拉霉素分散片研磨成粉末后溶入生理盐水后进行超声并以78 mg/kg的剂量鼻腔灌洗,桉柠蒎肠溶软胶囊和玉米胚芽油以1∶2的质量比混合后以138 mg/kg的剂量鼻腔灌洗[12],模型组及空白对照组大鼠鼻腔灌洗等量的生理盐水,1次/d,连续用药7 d。各组大鼠采用颈椎脱臼法处死,取血、鼻窦黏膜和鼻腔灌洗液。
1.6 观察指标
1.6.1 大鼠体征观察及鼻窦炎症状评分 观察并记录各组大鼠在造模、给药后的鼻部症状和体征,如鼻痒、流涕、喷嚏等,并根据表1进行评分[10]。

表1 ARS症状评分标准
1.6.2 样本收集 水合氯醛麻醉大鼠,眶静脉窦采血。然后以5 000 r/min离心5 min,收集血清,并在-20℃下保存,备用。手术中仔细解剖鼻窦黏膜,用10%中性缓冲福尔马林固定,备用。
1.6.3 鼻腔灌洗液培养观察肺炎链球菌生长情况 大鼠麻醉后鼻腔灌洗300 μL PBS。将回收的灌洗液稀释100倍后,置于哥伦比亚绵羊血琼脂板上。培养48 h,计数肺炎链球菌菌落数。菌落形成单位(CFU)用于估计菌落数量,并以各组大鼠每微升鼻窦灌洗液菌落形成单位进行数据统计。
1.6.4 HE染色观察大鼠鼻窦黏膜病理损伤 固定头骨在Surgipath DecalcifierⅡ中脱钙,并在PBS中洗涤3次。用乙醇和二甲苯在48℃下快速脱水,然后用低温石蜡在真空压力下浸润。用切片机在5 μm处切开鼻腔,然后仔细解剖鼻窦黏膜并固定在玻片上。切片用苏木精和伊红染色。用计算机辅助光学显微镜结合重建和成像软件对单个切片进行分析。
1.6.5 ELISA检测血清中炎症因子水平 根据说明书,使用特异性ELISA试剂盒检测血清样本中TNF-α和IL-6的水平。
1.6.6 qRT-PCR检测鼻窦黏膜TNF-α mRNA、IL-6 mRNA水平 用Trizol试剂提取总RNA。然后根据说明书,使用NanoDrop检测浓度,并采用cDNA反转录试剂盒进行反转录。然后,用SYBR GreenⅠPCR试剂盒对获得的cDNA进行qRT-PCR。qRT-PCR反应均在ABI PRISM 7500系统上进行。GAPDH作为内参。使用2-ΔΔCt方法计算mRNA表达的相对定量,并归一化至GAPDH。引物序列设计如下:TNF-α正向:5’-CAGCCTCTTCT CCTTCCTGA-3’,反向:5’-GGAAGACCCCTCCCAGATAGA-3’;IL-6正向:5’-GGCCCTTGCTTTCTCTTCG-3’,反向:5’-ATAAT AAAGTTTTGATTATGT-3’;GAPDH正向:5’-TGCACCACCAA CTGCTTAG-3’,反向:5’-GATGCAGGGATGATGTTC-3’。
1.6.7 Western blotting法 检 测 鼻 窦 黏 膜TNF-α、IL-6及MAPK/NF-κB信号通路蛋白水平 提取鼻窦黏膜总蛋白,然后进行SDS-PAGE,电转到PVDF膜上。用5%牛血清白蛋白或脱脂牛奶在室温下封闭膜1.5 h,然后用TNF-α、IL-6、JNK、p-JNK、ERK1/2、p-ERK1/2、p38、p-p38、NF-κB p65、p-NF-κB p65或GAPDH一抗在4℃下孵育过夜。上述一抗按说明书稀释至1∶1 000。用含0.1% Tween 20的缓冲盐水(TBST)洗涤5次后,将二抗与辣根过氧化物酶结合在TBST中室温孵育2 h。用增强的化学发光检测系统检测免疫反应条带,用Image Lab软件定量蛋白含量。
1.7 统计学方法 采用SPSS 26.0软件对数据进行分析。计量资料以“均数±标准差”(±s)表示,组间比较采用单因素方差分析,两两比较采用Dunnett’s t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠体征及鼻窦炎症状评分比较 空白对照组大鼠体征良好;模型组大鼠表现为挠鼻、流鼻涕、打喷嚏;黄连解毒汤低、中、高剂量组和阳性对照组大鼠流鼻涕、打喷嚏症状明显改善,且黄连解毒汤高剂量组和阳性对照组的效果最好。给药前,模型组、黄连解毒汤低剂量组、黄连解毒汤中剂量组、黄连解毒汤高剂量组和阳性对照组大鼠鼻窦炎症状评分均明显高于空白对照组(P<0.05)。给药后,黄连解毒汤低剂量组、黄连解毒汤中剂量组、黄连解毒汤高剂量组和阳性对照组大鼠鼻窦炎症状评分均明显低于给药前(P<0.05);黄连解毒汤低剂量组、黄连解毒汤中剂量组、黄连解毒汤高剂量组和阳性对照组大鼠鼻窦炎症状评分均低于模型组(P<0.05),黄连解毒汤具有剂量依赖性。黄连解毒汤高剂量组大鼠鼻窦炎症状评分与阳性对照组比较,差异无统计学意义(P>0.05)。(见表2)
表2 各组大鼠鼻窦炎症状评分比较 (±s)

表2 各组大鼠鼻窦炎症状评分比较 (±s)
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与黄连解毒汤低剂量组比较,cP<0.05;与黄连解毒汤中剂量组比较,dP<0.05
给药剂量 鼻窦炎症状评分(分)黄连解毒汤(g/kg)克拉霉素分散片(mg/kg)桉柠蒎肠溶软胶囊(mg/kg)给药前 给药后空白对照组 10 - - - 0.16±0.02 0.13±0.01模型组 10 - - - 7.51±0.39a 7.26±0.58a黄连解毒汤低剂量组 10 5 - - 7.46±0.38a 2.89±0.21a b黄连解毒汤中剂量组 10 10 - - 7.69±0.45a 2.51±0.18a bc黄连解毒汤高剂量组 10 20 - - 7.31±0.80a 2.13±0.17a bc d阳性对照组 10 - 78 138 7.54±0.63a 2.09±0.21a bc d组别 动物数(只)
2.2 各组大鼠鼻腔灌洗液细菌菌株比较 与空白对照组比较,模型组大鼠鼻腔灌洗液CFU值明显升高(P<0.05);与模型组比较,黄连解毒汤低、中、高剂量组和阳性对照组大鼠鼻腔灌洗液CFU值均明显降低(P<0.05),且黄连解毒汤呈剂量依赖性。黄连解毒汤高剂量组大鼠鼻腔灌洗液CFU值与阳性对照组比较,差异无统计学意义(P>0.05)。(见表3)
表3 各组大鼠鼻腔灌洗液细菌菌株比较 (±s)

表3 各组大鼠鼻腔灌洗液细菌菌株比较 (±s)
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与黄连解毒汤低剂量组比较,cP<0.05;与黄连解毒汤中剂量组比较,dP<0.05
给药剂量黄连解毒汤(g/kg)克拉霉素分散片(mg/kg)桉柠蒎肠溶软胶囊(mg/kg)空白对照组 10 - - - 53.48±4.69模型组 10 - - - 2 348.63±235.27a黄连解毒汤低剂量组 10 5 - - 2 156.92±214.18ab黄连解毒汤中剂量组 10 10 - - 786.49±89.67ab c黄连解毒汤高剂量组 10 20 - - 493.21±65.83ab c d阳性对照组 10 - 78 138 456.38±52.24ab c d组别 动物数(只) CFU(μL)
2.3 各组大鼠鼻窦黏膜病理损伤情况 空白对照组大鼠未发现鼻窦黏膜炎症簇;模型组大鼠鼻窦黏膜上皮纤毛脱落、炎症细胞浸润、腺体损伤、血管扩张、水肿,符合急性鼻窦炎病理表现;阳性对照组大鼠鼻窦黏膜上皮细胞排列整齐,鼻窦黏膜及黏膜下层炎症细胞少量浸润;黄连解毒汤低剂量组大鼠鼻窦黏膜部分上皮纤毛脱落、炎症细胞浸润、腺体损伤、血管扩张、水肿,但较模型组明显减轻;黄连解毒汤中剂量组大鼠鼻窦黏膜及黏膜下层炎症细胞浸润减少,上皮细胞较为整齐,局部仍有血管扩张、水肿;黄连解毒汤高剂量组大鼠鼻窦黏膜上皮细胞排列整齐,鼻窦黏膜及黏膜下层炎症细胞浸润减少,病变程度明显改善,同阳性对照组相似。(见图1)

图1 各组大鼠鼻窦黏膜病理损伤情况 (HE)
2.4 各组大鼠炎症因子水平比较 模型组大鼠血清TNF-α、IL-6水平均明显高于空白对照组(P<0.05);黄连解毒汤低、中、高剂量组和阳性对照组大鼠血清TNF-α、IL-6水平均明显低于模型组(P<0.05),且黄连解毒汤对血清TNF-α、IL-6的影响呈剂量依赖性;黄连解毒汤高剂量组大鼠血清TNF-α、IL-6水平与阳性对照组比较,差异无统计学意义(P>0.05)。(见表4)
模型组大鼠鼻窦黏膜TNF-α、IL-6的mRNA及蛋白相对表达量均明显高于空白对照组(P<0.05);黄连解毒汤低、中、高剂量组和阳性对照组大鼠鼻窦黏膜TNF-α、IL-6的mRNA及蛋白相对表达量均明显低于模型组(P<0.05);黄连解毒汤对大鼠鼻窦黏膜TNF-α、IL-6的mRNA和蛋白表达的影响呈剂量依赖性;黄连解毒汤高剂量组大鼠鼻窦黏膜TNF-α、IL-6的mRNA及蛋白相对表达量与阳性对照组比较,差异无统计学意义(P>0.05)。与血清TNF-α、IL-6结果趋势一致。(见图2、表4)
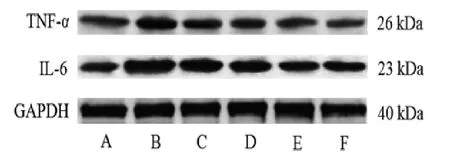
图2 各组大鼠鼻窦黏膜TNF-α、IL-6表达Western blotting图
表4 各组大鼠炎症因子水平比较 (±s)

表4 各组大鼠炎症因子水平比较 (±s)
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与黄连解毒汤低剂量组比较,cP<0.05;与黄连解毒汤中剂量组比较,dP<0.05
给药剂量 血清炎症因子 鼻窦黏膜TNF-α mRNA、IL-6 mRNA鼻窦黏膜TNF-α、IL-6蛋白组别 动物数(只)黄连解毒汤 克拉霉素 桉柠蒎肠溶软TNF-α IL-6 TNF-α mRNA IL-6 mRNA TNF-α蛋白 IL-6蛋白(g/kg) 分散片(mg/kg)胶囊(mg/kg) (pg/mL) (pg/mL)空白对照组 10 - - - 8.46±0.35 24.53±0.72 1.00±0.02 1.00±0.03 0.79±0.03 0.83±0.05模型组 10 - - - 29.38±3.69a 82.57±4.24a 7.65±0.87a 7.69±0.91a 1.84±0.22a 1.89±0.21a黄连解毒汤低剂量组 10 5 - - 25.85±3.46a b 78.36±3.48a b 6.78±0.75a b 6.68±0.89a b 1.61±0.19a b 1.63±0.22a b黄连解毒汤中剂量组 10 10 - - 21.23±2.34a b c 57.69±3.14a b c 5.93±0.64a b c 5.14±0.72a b c 1.38±0.21a b c 1.39±0.19a b c黄连解毒汤高剂量组 10 20 - - 15.42±1.25a b c d 32.43±2.6a b c d 3.05±0.31a b c d 3.23±0.38a b c d 1.16±0.15a b c d 1.18±0.17a b c d阳性对照组 10 - 78 138 13.48±1.09a b c d 30.56±2.13a b c d 2.89±0.27a b c d 3.04±0.29a b c d 1.12±0.13a b c d 1.16±0.15a b c d
2.5 各组大鼠鼻窦黏膜MAPK/NF-κB信号通路蛋白表达比较 与空白对照组比较,模型组大鼠鼻窦黏膜中p-JNK/JNK、p-ERK1/2/ERK1/2、p-p38/p38、p-NF-κB p65/NF-κB p65比值均明显升高(P<0.05);与模型组比较,黄连解毒汤低、中、高剂量组和阳性对照组大鼠鼻窦黏膜中p-JNK/JNK、p-ERK1/2/ERK1/2、p-p38/p38、p-NF-κB p65/NF-κB p65比值均明显降低(P<0.05),且黄连解毒汤呈剂量依赖性;黄连解毒汤高剂量组大鼠鼻窦黏膜中p-JNK/JNK、p-ERK1/2/ERK1/2、p-p38/p38、p-NF-κB p65/NF-κB p65比值与阳性对照组比较,差异无统计学意义(P>0.05)。(见图3、表5)
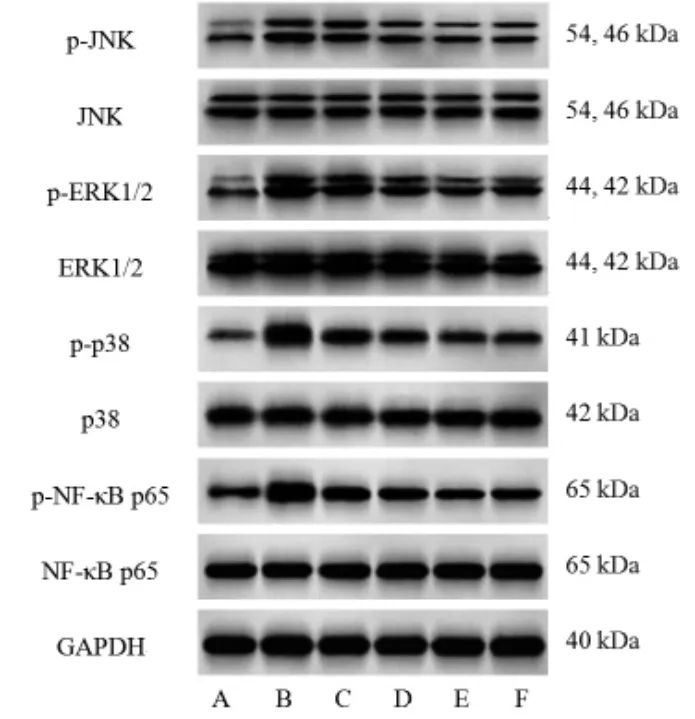
图3 各组大鼠鼻窦黏膜MAPK/NF-κB信号通路蛋白表达Western blotting图
表5 各组大鼠鼻窦黏膜MAPK/NF-κB信号通路蛋白相对表达量比较(±s)

表5 各组大鼠鼻窦黏膜MAPK/NF-κB信号通路蛋白相对表达量比较(±s)
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与黄连解毒汤低剂量组比较,cP<0.05;与黄连解毒汤中剂量组比较,dP<0.05
给药剂量黄连解毒汤(g/kg)克拉霉素分散片(mg/kg)桉柠蒎肠溶软胶囊(mg/kg)空白对照组 10 - - - 0.25±0.02 0.19±0.02 0.26±0.03 0.22±0.04模型组 10 - - - 1.23±0.15a 1.15±0.13a 1.33±0.10a 1.52±0.16a黄连解毒汤低剂量组 10 5 - - 0.89±0.09a b 0.96±0.10a b 0.98±0.11a b 0.83±0.09a b黄连解毒汤中剂量组 10 10 - - 0.72±0.08a b c 0.78±0.08a b c 0.74±0.05a b c 0.61±0.07a b c黄连解毒汤高剂量组 10 20 - - 0.58±0.05a b c d 0.67±0.08a b c d 0.59±0.08a b c d 0.43±0.06a b c d阳性对照组 10 - 78 138 0.55±0.07a b c d 0.65±0.06a b c d 0.53±0.06a b c d 0.49±0.06a b c d组别 动物数(只)p-JNK/JNK p-ERK1/2/ERK1/2 p-p38/p38 p-NF-κB p65/NF-κB p65
3 讨 论
ARS是耳鼻喉科常见的炎症性疾病。然而,ARS模型的建立非常困难,ARS动物模型的选择有很长的发展历史。BOMER K等[13]通过向小鼠鼻腔注射肺炎链球菌成功构建了鼻窦炎模型。此后,将肺炎链球菌吸入小鼠鼻腔已成为构建ARS模型的主流方法。一项研究表明,植入鼻海绵可诱导小鼠ARS模型,但炎症反应比植入浸有金黄色葡萄球菌混悬液的鼻海绵要轻[14]。本研究发现将肺炎链球菌液体吸入膨胀海绵并填充大鼠鼻腔是诱发ARS的一种非常有效的方法。大鼠鼻窦黏膜和血清的提取比小鼠更容易。大鼠也比小鼠更强壮,在麻醉和建模过程中不容易死亡。当鼻腔被扩张海绵堵塞时,会阻碍通气和引流,并且鼻腔滴加肺炎链球菌会加速急性鼻窦炎的发生发展,从而提高建模效率。因此,该方法取得了较好的效果。
细胞因子作为炎症的关键调节因子,在ARS的病理过程中起着重要作用[15]。急性病毒性鼻炎中检测到一系列上调的细胞因子,包括IL-1β、IL-6、IL-7、IL-17、IFN-γ、TNF-α、IL-8、G-CSF和GM-CSF11[16]。本研究结果表明,模型组大鼠血清中TNF-α和IL-6水平均明显升高,这主要是Th1相关的细胞因子,符合ARS的发病机制。
黄连解毒汤除了在肿瘤[17]中发挥作用外,还具有明显的抗炎、抗菌和抗内毒素活性[7],被广泛用于败血症[6]、小儿高热[18]等疾病的治疗。黄连解毒汤在炎症性疾病,如结肠炎[8]、肺炎[19]中表现出很强的抗炎作用。黄连解毒汤的抗炎作用与其干扰白细胞转移的能力有关,这主要是由IL-6和TNF-α介导的。在本研究中,黄连解毒汤在鼻腔灌洗浓度达到20 g/kg时,能有效降低IL-6和TNF-α的释放。黄连解毒汤可减轻ARS的炎症状态,从而减少细胞因子IL-6和TNF-α的大规模释放。
虽然抗生素通常用于控制细菌源性急性呼吸道感染,但抗生素耐药性是一个全球性问题,阻碍了细菌感染的治疗。为了避免抗生素耐药性,需开发非抗生素抗炎药物治疗细菌性炎症。近年来,黄连解毒汤的抗炎作用引起了科学家们的广泛关注。刘书芹等[11]发现黄连解毒汤可以改善鼻黏膜的炎症反应。本研究发现,黄连解毒汤鼻腔灌洗能减少炎症介质的释放,减少细菌菌落的形成。黄连解毒汤可以同时对抗炎症介质和抑制细菌生长,它的使用可能有助于解决抗生素滥用。
MAPK通路在机体炎症中发挥重要作用。MAPK通路通过将应激信号从细胞表面传递到细胞核,从而引起特定的生物反应,并与细胞事件如增殖、衰老、分化和凋亡有关[20]。MAPK通路有4个主要分支,包括ERK、JNK、p38/MAPK和ERK5。每个MAPK信号通路都有相对独立的功能。MAPK信号通路的一个重要作用是调节细胞对细胞外环境变化的反应。ERK途径主要参与细胞的增殖和分化,而JNK途径和p38MAPK途径主要参与细胞的炎症反应、应激反应和凋亡[21]。NF-κB是一种主要的转录因子,是有害细胞刺激的第一反应者,在调节炎症和免疫反应中发挥重要作用。MAPK通路激活后诱导IκBα磷酸化和降解,使活性NF-κB进入细胞核,诱导促炎性细胞因子基因表达[4]。研究[5]表明,MAPK/NF-κB通路的阻滞有助于缓解慢性鼻窦炎中TGF-β1诱导的鼻黏膜重塑。黄连解毒汤可通过抑制MAPK通路降低脂多糖诱导的发热大鼠体内的炎症因子,因此本研究将探讨黄连解毒汤与MAPK/NF-κB通路在ARS中的相互作用机制。本研究发现,黄连解毒汤可通过抑制MAPK/NF-κB信号通路,引起炎症细胞因子IL-6、TNF-α的释放,黄连解毒汤对NF-κB p65的抑制作用与其在脑缺血模型中的作用一致。高浓度(20 g/kg)黄连解毒汤抑制作用最明显。提示黄连解毒汤以剂量依赖的方式抑制MAPK/NF-κB通路,进而发挥其抗炎特性。
综上所述,黄连解毒汤可以改善ARS的炎症状态,对大鼠鼻窦黏膜具有剂量依赖的保护作用。这一结果提示了ARS的进一步治疗方式,并为预防抗生素滥用提供了新的建议。黄连解毒汤对ARS大鼠鼻窦黏膜的保护作用可能与抑制MAPK/NF-κB信号通路的激活,以剂量依赖的方式下调炎症因子的基因转录,从而减少炎症因子的产生有关。
